Image de la semaine | 10/06/2024
Les ocres et autres pigments utilisés à Lascaux et autres lieux pour les peintures rupestres
10/06/2024
Auteur(s) / Autrice(s) :
Publié par :
- Olivier DequinceyENS de Lyon / DGESCO
Résumé
Quelques exemples de sites originaux ou reconstitués présentant des peintures rupestres colorées : Dordogne, Ardèche, Namibie, Australie.

Source - © 2019 — Pierre Thomas
Cette représentation illustre l'utilisation de pigments (ocre – cf. Les mines d'ocre de Bruoux (commune de Gargas, Vaucluse) – pour les rouges et les jaunes, argile riche en oxyde de manganèse ou charbon de bois pour les pigments noirs) par nos ancêtres du Magdalénien (17 000 ans AP, AP = Avant Présent). À part le charbon de bois, tous ces pigments étaient extraits du sous-sol local (voire relativement lointain). Cette photo (ou plutôt mosaïque de photos) n'a pas été prise dans la vraie grotte (fermée au public depuis 1963), ni dans son fac-similé (Lascaux 2 puis 4, ce dernier étant ouvert depuis 2016) où les photos sont interdites, mais dans « l'atelier » , une des salles du « complexe touristique Lascaux 4 ».
Localisation par fichier kmz du site Lascaux 4, reproduction de la grotte de Lascaux (Montignac, Dordogne).
La célèbre grotte de Lascaux (Montignac, Dordogne) a été appelée la « Chapelle Sixtine de la Préhistoire » peu après sa découverte en 1940. Le site a été ouvert à la visite en 1948, mais les peintures ont commencé à se dégrader à cause de la mise en communication de l'intérieur de la grotte avec l'extérieur (elle était complètement isolée depuis des millénaires avant sa découverte), à cause du nombre des visiteurs qui apportaient chaleur, CO2, spores diverses, à cause de l'éclairage favorisant la photosynthèse de microalgues… Elle a été définitivement fermée au public 15 ans après son ouverture, et des fac-similés « grandeur nature » ont été construits. Ces fac-similés respectent la géométrie en 3D des différentes salles, reproduisent le « grain » et les couleurs des parois… Ce fut d'abord Lascaux 2, qui ne montraient “que” 80 à 90 % des peintures, puis Lascaux 4 où sont reproduites la quasi-totalité des peintures, à l'exception de la célèbre « scène du puits » où il faudrait faire ramper les visiteurs dans une reproduction d'une galerie étroite se terminant par un puits au fond duquel est dessinée cette célèbre scène (voir figures 15 à 17). Mais, on ne peut pas rester le temps qu'on désirerait devant les peintures (au moins pendant les périodes d'affluence), on ne peut pas revenir en arrière ou s'approcher des répliques des parois pour en voir des détails, on ne peut pas accéder à une réplique reproduite sur une surface non plane pour la regarder “sous toutes les coutures”, et on ne peut pas prendre de photographies (problème de droit d'auteur pour protéger les droits des artistes – ceux du XXIe siècle, pas ceux du Magdalénien – et pour ne pas ralentir le flot des visiteurs. Mais, heureusement, les concepteurs du complexe de Lascaux 4 ont installé, juste à côté du fac-similé de la grotte, une salle appelée « l'Atelier ». Ce vaste espace montre des reproductions des principales parois du fac-similé (donc identiques à celles de la grotte) mais bien plus accessibles, à hauteur d'homme… Comme il n'y a pas ici de limite de temps, on peut y rester autant que l'on veut, regarder les détails, regarder telle peinture sous plusieurs angles, profiter des éclairages changeants, faire des photographies… Cette disposition n'a pas la prétention de représenter l'ensemble de la cavité en 3D ni de reconstituer « l'ambiance » qu'avaient les visiteurs de la grotte originale, mais simplement des représentations (en 3D) des principales parois, suspendues à des fils d'acier : c'est à la fois beau et aérien, et on oublie vite qu'on n'est pas face aux vraies peintures. La scène du puits été reproduite, et on peut littéralement rentrer dans la cavité de cette fameuse scène et réfléchir à sa signification, mais sans se courber ou ramper dans une galerie !

Source - © 2019 — Pierre Thomas
Le trapèze rouge délimite (approximativement) la figure 1.
Les photographies des figures 1 à 17 ont toutes été prises dans cet “atelier”. On pourra y voir tout ce que savaient faire les Magdaléniens (certains d'entre eux du moins) avec des poudres colorées majoritairement minérales. Homo sapiens maitrisait déjà l'utilisation combinée de trois couleurs : ocre plus ou moins jaune (argile plus ou moins riche en goethite et en limonite), rouge (argile riche en hématite), noir (argile riche en dioxyde de manganèse – ou en charbon de bois) et leur mélange. On pourra essayer de séparer la peinture au doigt pour les traits, au pinceau (poils animaux ou faits à base de végétaux) pour les traits comme pour remplir une surface, ou encore la technique du soufflé (ou du crachis) pour remplir les surfaces. Dans de nombreuses grottes sont représentés des animaux maintenant disparus (mammouth, rhinocéros laineux…) ; à Lascaux, la quasi-totalité des animaux représentés existent encore (auroch – vache sauvage, cheval, cerf…) et ne permettent pas de faire de la paléontologie. Les figures 3 à 8, ainsi que la figure 14 sont situées dans la salle dite des taureaux. Les autres peintures sont situées dans d'autres parties de la grotte (diverticule axial, nef…).
 Source - © 2019 — Pierre Thomas On peut y voir les différentes couleurs de pigments, les différentes techniques de peinture… |  Source - © 2019 — Pierre Thomas On peut y voir les différentes couleurs de pigments, les différentes techniques de peinture… |
 Source - © 2019 — Pierre Thomas On peut y voir les différentes couleurs de pigments, les différentes techniques de peinture… | |
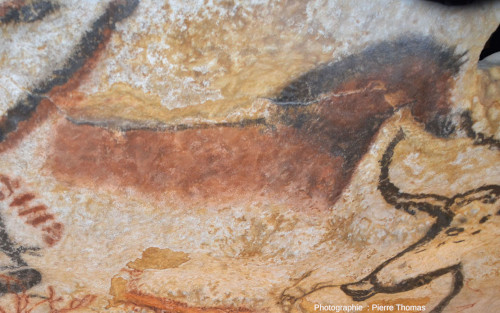 Source - © 2019 — Pierre Thomas On peut y voir les différentes couleurs de pigments, les différentes techniques de peinture… |  Source - © 2019 — Pierre Thomas On peut y voir les différentes couleurs de pigments, les différentes techniques de peinture… |
 Source - © 2019 — Pierre Thomas | |
 Source - © 2019 — Pierre Thomas |  Source - © 2019 — Pierre Thomas |
 Source - © 2019 — Pierre Thomas Ce cheval “renversé” représente-t-il un cheval mort après la chasse ? |  Source - © 2019 — Pierre Thomas |
 Source - © 2019 — Pierre Thomas Les deux traits noirs au-dessus de son dos sont-ils des flèches ou des sagaies ? | |

Source - © 2019 — Pierre Thomas
Cet animal qui ne ressemble à rien de connu a été appelé “licorne” par l'abbé Breuil(lien externe - nouvelle fenêtre), par analogie avec l'animal mythique(lien externe - nouvelle fenêtre) présent depuis l'Antiquité jusqu'au XIXe siècle dans de nombreuses civilisations (de l'Inde au Proche Orient et à l'Europe). Mais les licornes n'avaient qu'une corne ! Cette “licorne”-là a fait couler beaucoup d'encre (cf., par exemple, La mythique licorne de Lascaux, l'élément Ω de sa bande).
La “scène du puits” est l'une des scènes les plus énigmatiques de la grotte de Lascaux. Elle est difficile d'accès et ne devait être vue que d'une minorité d'initiés parmi les Magdaléniens qui entraient dans la grotte. C'est la seule représentation humaine de la grotte, et quelle représentation ! De droite à gauche, on voit un bison “éventré” avec ses entrailles pendantes (et traversé par ce qui ressemble à un harpon). Ce bison semble charger un homme à moitié renversé, affublé d'une tête d'oiseau, de mains à quatre doigts et d'un sexe en érection. Sous cet homme, on voit un bâton surmonté d'un oiseau et ce qui peut s'interpréter comme un harpon. À gauche, un rhinocéros à queue redressée, séparé de l'homme par trois paires de ponctuations. Il serait trop long de faire la liste des multiples interprétations que cette scène a suscitée. Nous vous montrons trois images de cette célèbrissime et énigmatique peinture de Lascaux.
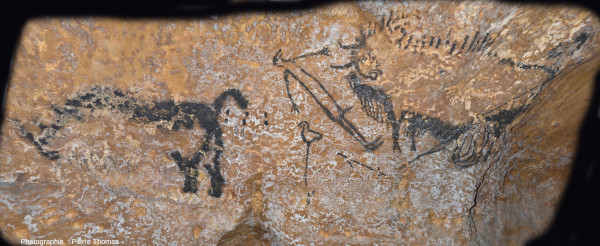 Source - © 2019 — Pierre Thomas | |
 Source - © 2019 — Pierre Thomas La paroi sur laquelle a été peint le bison étant courbe, il faut se déplacer sur la droite pour mieux voir l'arrière-train et les entrailles pendantes du bison. |  Source - © 2019 — Pierre Thomas Le grand trait droit traversant l'arrière du bison se terminant en bas par une “flèche” symbolise-t-il le harpon ayant blessé le bison ? |
Les humains du Paléolithique et du Néolithique n'utilisaient pas les pigments que pour des représentations animales, des scènes énigmatiques, des figures géométriques… Parmi ces autres “usages” absents à Lascaux, et dont la signification reste discutée, citons et montrons les mains (positives et négatives) et les galets peints. Ces derniers, si abondants à la limite Magdalénien/Néolithique, ont servi à définir une “culture”, l'Azilien, nommée ainsi car initialement découverte dans la grotte du Mas d'Azil (Ariège, cf. Le Mas d'Azil (Ariège) : la perte et la résurgence de l'Arize).
 Source - © 2016 — Claude Valette – CC BY-SA 4.0 Ces peintures de “mains” ont été obtenues en plaquant sur la paroi une main enduite d'une “boue” d'ocre rouge (argile riche en hématite). Localisation par fichier kmz du site Chauvet 2, réplique de la grotte de Chauvet (Ardèche). |  Source - © 2016 — Claude Valette – CC BY-SA 4.0 Cette “main” a été obtenue en plaquant une main sur la paroi et en colorant la périphérie soit avec un pochoir, soit en soufflant-crachant de la boue liquide colorée. |
 Source - © 2012 — Didier Descouens – CC BY-SA 4.0 |  Source - © 2012 — Didier Descouens – CC BY-SA 4.0 Avant d'être appliqués sur les parois des grottes, les pigments devaient être broyés et/ou mélangés. |
L'art rupestre a été pratiqué un peu partout par l'humanité depuis plus de 30 000 ans. Les plus vielles peintures connues à ce jour datent de 40 000 ans (Indonésie), et même de 65 000 ans (peintures faites par des Néandertaliens en Espagne). Simplement pour montrer l'universalité de l'utilisation de pigments colorés par nos ancêtres (ou cousins) lointains, nous vous montrons quelques peintures rupestres de Namibie et d'Australie.
 Source - © 2017 — Pierre Thomas Les peintures rupestres se trouvent sur la paroi à l'abri sous l'énorme masse de granite non diaclasé, derrière la clôture et les panneaux explicatifs. D'autres informations sur ce site dans Arches, mais aussi boules, diaclases et peintures rupestres, dans le massif granitique crétacé du Spitzkoppe, Namibie. Localisation par fichier kmz du site de Small Bushman Paradise, massif du Spitzkoppe (Namibie). | |
 Source - © 2017 — Pierre Thomas |  Source - © 2017 — Pierre Thomas Ce cheval mesure une quinzaine de centimètres de la tête à la queue. |
 Source - © 2017 — Pierre Thomas L'échelle est donnée par les “grains” du granite. Au milieu, dessin à l'ocre rouge montrant deux silhouettes humaines dessinées au trait, un adulte et un enfant jouant à saute-mouton (ou se livrant à d'autres activités). “Dessinés” en blanc, on croit reconnaitre, en haut, un zèbre et, en bas, une girafe. Dans ces deux cas, il ne s'agit pas de peinture, mais de “gravure”. Le granite y a été “écrasé” par un «“poinçon” dur. Or une roche rendue “pulvérulente” est plus claire que la roche “saine”. |  Source - © - — 2017-Pierre Thomas / Claude Valette – CC BY-SA 4.0 En haut, petit rhinocéros de Namibie (site de Small Bushman Paradise). En bas, rhinocéros ocre peint dans la grotte Chauvet (Ardèche). Ces deux peintures sont de tailles très différentes, une quinzaine de centimètres pour le rhinocéros namibien, 1,20 m pour l'ardéchois. Ces deux rhinocéros ne sont pas de la même espèce : Diceros sp. en Namibie, et Coelodonta antiquitatis (espèce éteinte) en Ardèche. |
 Source - © 2012 — Pierre Thomas Les peintures rupestres se trouvent sur les parois et le plafond de l'abri sous roche fait par le bloc de grès éboulé depuis le sommet d'Uluru. D'autres informations sur Uluru dans Uluru, l'inselberg emblématique de l'Australie. Localisation par fichier kmz du site de peintures rupestres sur un bloc éboulé à la base d'Uluru (Australie). |  Source - © 2012 — Pierre Thomas Les peintures rupestres se trouvent sur les parois et le plafond de l'abri sous roche fait par le bloc de grès éboulé depuis le sommet d'Uluru. |
 Source - © 2012 — Pierre Thomas On voit des traits rouges, jaunes, blancs… ne dessinant pas de figures aisément reconnaissables, mais des dessins “géométriques”. | |
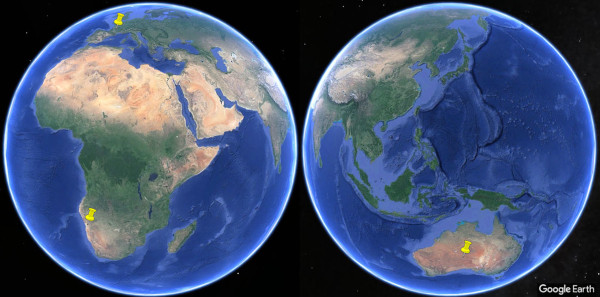
Source - © 2024 — D’après Google Earth, modifié
La localisation des ces sites en des points si éloignés illustre l'universalité de la pratique des peintures rupestres par l'humanité.