Article | 07/05/2024
Stromatolithes, minerais de fer rubanés (BIF) et oxygénation de l'atmosphère précambrienne jusqu'au Grand Évènement Oxydant
07/05/2024
Résumé
Apparition des stromatolithes et formation de BIF avant la présence de cyanobactéries, et délai entre apparition de la photosynthèse oxygénique et oxygénation de la surface de la Terre.
Table des matières
L'étude de la composition et des propriétés des enveloppes externes pendant le Précambrien, de l'apparition et de l'évolution de la vie à ce moment, constitue un domaine scientifique en évolution rapide. Il existe parfois des contradictions entre la bibliographie disponible pour les concours de l'enseignement et les données scientifiques les plus récentes. Si les observations rapportées dans la bibliographie restent valables, les interprétations peuvent changer face à de nouveaux résultats ou à la prise en compte de données autrefois écartées.
Les roches sédimentaires les plus anciennes, témoins des conditions de surface d'alors, sont majoritairement des stromatolithes, et des minerais de fer rubanés ou BIF (Banded Iron Formations). Les explications les plus classiques pour expliquer la formation de ces roches impliquent la présence de cyanobactéries, seuls organismes capables de réaliser la photosynthèse oxygénique (c'est-à-dire avec production de dioxygène, O2). Les chloroplastes des eucaryotes photosynthétiques dérivent de ces mêmes cyanobactéries. Selon ces explications largement partagées, les cyanobactéries, apparues précocement (3 700 Ma), auraient formé les stromatolithes par déplacement de l'équilibre des carbonates en fixant le CO2 et libéré progressivement de l'oxygène moléculaire O2. Cet oxygène aurait d'abord été “consommé” par l'oxydation abiotique plus ou moins ménagée du fer, à l'origine des BIF, puis, lorsque tout ce fer aurait été oxydé, le Grand Évènement Oxydant (GOE, Great Oxidation Event) aurait eu lieu. Ce scénario suppose une apparition précoce des cyanobactéries, une origine cyanobactérienne des stromatolithes et une oxydation abiotique du fer pour former les BIF.
Le but de cet article est de présenter une synthèse actualisée sur la formation de roches sédimentaires à l'Archéen, les minerais de fer rubanée (BIF) et les stromatolithes, en relation avec le développement de la biosphère. Les conditions conduisant au Grand Évènement Oxydant (2,45 à 2,2 Ga) seront discutées, ainsi que les conditions et dates d'apparition des cyanobactéries.
Les stromatolithes
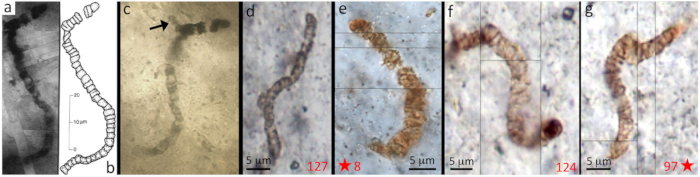
Les premières traces de vie sont apparues dans des conditions environnementales qui n'existent plus à l'heure actuelle. En outre, les roches portant ces traces ont été soumises potentiellement à des milliards d'années de processus tectoniques, métamorphiques et érosifs. Il est ainsi très difficile d'attribuer sans ambigüité un caractère biogénique à une structure ancienne, et de prouver que cette structure ne résulte pas d'une contamination plus récente ou de processus abiotiques. Des structures microbiennes simples (coques) peuvent être confondues avec des concrétions minérales sub-sphériques (billes de silice), une structure organominérale en feuillets peut être confondue avec un biofilm. Les pseudofossiles d'Apex Chert en Australie (3,46 Ga) sont un exemple classique d'interprétation erronée. Initialement interprétés comme des organismes proches des cyanobactéries (Schopf, 1993 [19]), des études ultérieures avec un microscope électronique à balayage de haute résolution ont montré que des morphologies filamentaires avec des septas supposés (Figure 1) étaient du matériel argileux sur lequel du carbone organique s'était fortuitement adsorbé (Wacey et al., 2016 [22]).
Source - © 2016 D’après Wacey et al. [22]
La formation des stromatolithes
Les stromatolithes sont des roches carbonatées laminées, dont la présence sur Terre est attestée depuis 3,7 Ga (stromatolithes d'Isua) jusqu'à l'heure actuelle (Moyen et Thomas, 2007 [14]). Les morphologies de ces structures, présentées sur la Figure 2, sont variées, avec des lamines planes et continues, des structures plus ou moins ondulées (sous l'action de vagues), des cônes, des structures en boite à œufs (Allwood et al., 2006 [1]). On considère que ces structures résultent du développement de biofilms bactériens, dont les exopolysaccharides (polyssaccharides sécrétés par les microorganismes, qui forment une gangue visqueuse retenant l'eau et protégeant les microorganismes) piègent des particules sédimentaires, et dont l'activité biologique induit la précipitation de calcite. La stabilisation de plans de sédimentation par des exopolysaccharides entraine la formation de ces structures verticales laminées.
Figure 2. Photographies d'affleurements stromatolithiques de la formation de Strelley Pool, Australie
Barre d'échelle : 18 cm pour b, h et i ; 1 cm pour c, e, k, l, n et o ; 5 cm pour f.
La précipitation de la calcite est induite par des microorganismes autotrophes. Ces microorganismes déplacent l'équilibre de précipitation des carbonates, Ca2+ + 2 HCO3− ⇌ CaCO3 + CO2 + H2O, vers la précipitation de calcite par consommation de CO2. Si la précipitation de calcite dans les stromatolithes induite par des microorganismes autotrophes est une proposition consensuelle, l'attribution de cette précipitation à des cyanobactéries n'est plus certaine.
Taxonomie des organismes à l'origine des stromatolithes actuels
Des méthodes d'écologie moléculaire (méta-barcoding, séquençage d'ADN environnemental dont le gène codant pour la sous-unité 16S des ribosomes) ont été employées sur des stromatolithes actuels lacustres, de lagunes hypersalées, en milieu marin (Shark Bay, Bahamas…). Les taxons les plus abondants dans les stromatolithes actuels sont des membres des cyanobactéries, des Bacteroidetes et d'autres groupes, dont des eucaryotes unicellulaires. La composition des communautés est très variable selon les sites. Les cyanobactéries constituent généralement (mais pas toujours) le groupe le plus abondant contribuant à la précipitation de la calcite ; les eucaryotes photosynthétiques, les phototrophes anoxygéniques et les sulfato-réducteurs sont également très abondants (Saghaï et al., 2015 [18]).
Si les cyanobactéries constituent un groupe majeur impliqué dans la formation des stromatolithes actuels, l'identification ou l'équivalence entre stromatolithes et cyanobactéries est fausse.
Les cyanobactéries ont joué un rôle fondamental dans l'oxygénation de la biosphère. La date de leur apparition n'est pas connue avec certitude. Deux types de méthodes permettent de l'estimer, les méthodes analytiques sur le terrain et les reconstructions phylogénétiques avec horloges moléculaires.
Une méthode de datation pourrait être la découverte de molécules caractéristiques des cyanobactéries dans des sédiments anciens. Des composés tels les 2-methylhopanoïdes ont été identifiés à partir de roches sédimentaires archéennes du craton de Pilbara (Australie). Ces lipides, retrouvés principalement dans les membranes des cyanobactéries (Summons et al., 1999[20]) donneraient un âge minimal d'apparition de ces dernières vers 2,65 Ga. Néanmoins, il a été démontré que ces molécules ne sont pas caractéristiques des cyanobactéries (un phototrophe anoxygénique, Rhodopseudomonas palustris, au métabolisme très diversifié, en produit aussi – Rashby et al., 2007 [16]), et que ces molécules provenaient d'une contamination post-2,2 Ga (French et al., 2015 [6]) (grâce à des analyses isotopiques précises au micromètre, on a montré que le bitume dont ont été extraits les 2-méthylhopanoïdes a un δ13C différent lié à un épisode métamorphique que n'a pas subi le 2-méthylhopanoïde).
Par des méthodes phylogénétiques, l'état ancestral supposé des cyanobactéries a été reconstruit. Ces méthodes utilisent l'élaboration d'arbres phylogénétiques à partir de grands jeux de données (nombreux gènes essentiels pour une bonne précision), de jeux de données différents (pour vérifier la “robustesse” des arbres, que les relations entre taxons soient toujours les mêmes quel que soit le jeu de données, pour éviter les biais liés aux transferts latéraux de gènes et à l'attraction des longues branches) pour inférer les propriétés des lignées primaires de cyanobactéries. Toutes ces méthodes convergent vers un même résultat : les lignées ancestrales de cyanobactéries, qui habitaient probablement des environnements d'eau douce, étaient unicellulaires (ne formaient pas de biofilm) et étaient de petite dimension (< 2 μm) (Blank et Sánchez-Baracaldo, 2009 [3]).
Des méthodes d'horloges moléculaires relâchées ont permis de contraindre l'âge d'apparition des cyanobactéries. Ces méthodes utilisent différents points de calage fournis par la paléontologie, par exemple 2,1 Ga pour l'apparition des Nostocéales, 1,7 Ga pour l'apparition des Pleurocapsales. L'âge d'apparition des cyanobactéries se situe au plus tôt aux environs de 2,8 Ga (Blank et Sánchez-Baracaldo, 2009 [3]).
Les premières cyanobactéries ne pouvaient pas former de biofilms, habitaient dans des environnements sans doute continentaux (eau douce) et sont apparues très longtemps (pas avant 2,8 Ga) après les premiers stromatolithes marins (3,45 à 3,7 Ga). Elles ne peuvent donc pas être à l'origine des premiers stromatolithes ni des premiers minerais de fer rubanés (BIF), qui ont vraisemblablement été formés via l'action d'autres microorganismes.
Les BIF (Banded Iron Formations)
La chimie de l'océan anoxique archéen est caractérisée par une faible teneur en sulfates (qui auraient été réduits en conditions anoxiques puis précipités sous forme de pyrite sinon) et des concentrations élevées en Fe(II) d'origine principalement hydrothermale (Poulton et al., 2004 [15], Canfield et al., 2007 [4]). Depuis la colonne d'eau ferrugineuse, des dépôts alternant silice et oxydes de fer ont précipité entre 3,8 et 1,8 Ga et ont été préservés sous forme de minerais de fer rubanés. Les premiers BIF sont datés de 3,8 Ga.
Architecture des BIF
Les BIF, ou minerais de fer rubanés, sont des sédiments stratifiés alternant niveaux siliceux et niveaux riches en oxydes de fer (sous forme de magnétite Fe3O4 et/ou hématite Fe2O3 avec parfois de la sidérite FeCO3). Ces minerais caractéristiques du Précambrien (principalement de l'Archéen, dans une moindre mesure de la fin du Protérozoïque) constituent la principale ressource en fer exploitée (Klein, 2005 [10]).
La comparaison du spectre de terres rares de ces BIF et des fluides hydrothermaux des rides océaniques (anomalie positive en europium) suggèrent une origine hydrothermale de ce fer, avec quelques apports continentaux (Li et al., 2015 [13]). Ces dépôts se seraient donc formés à partir de l'oxydation ménagée du fer hydrothermal. Ces minerais existent tout au long de l'éon Archéen, pour disparaitre au profit des Red Beds (dans lesquels le fer est totalement oxydé) lors de la transition Archéen-Protérozoïque, avec quelques occurrences à la fin du Protérozoïque. Le modèle le plus communément accepté impliquait une oxydation abiotique du fer par le dioxygène émis par les cyanobactéries. Une observation fréquente appuyant ce modèle est la quasi absence de matière organique dans les BIF. Cette explication ne tient plus vu le caractère “récent” (plus récent que les BIF les plus anciens) de l'apparition des cyanobactéries.
Métabolisme bactérien et précipitation de phases oxydées du fer
Le fer est un élément dont le noyau contient 26 protons (z=26) et un nombre variable de neutrons. Les principaux isotopes stables du fer sont le 56Fe (91,8 %), le 54Fe (5,8 %) et le 57Fe (2,1 %). La composition isotopique du fer terrestre est incomprise à l'heure actuelle, le fer terrestre étant enrichi en isotopes lourds par rapport aux chondrites. Les mesures de composition isotopique du fer, δ56Fe = ((56Fe/54Fe)échantillon / (56Fe/54Fe)standard chondritique − 1), sur les BIF, les pyrites et les carbonates riches en fer d'Isua présentent une variabilité entre des valeurs légères (δ56Fe = 0,1 à 0,5 ‰ dans la magnétite des BIF) et élevées (δ56Fe jusqu'à 1,2 ‰ dans la pyrite au sein des carbonates). Ces valeurs sont compatibles avec une action des êtres vivants, les bactéries faisant précipiter des phases enrichies en isotopes légers lors de l'oxydation du fer (magnétite Fe3O4, hématite Fe2O3) et des phases enrichies en isotopes lourds lors de la réduction et la précipitation de phases réduites (pyrite FeS2). Les valeurs légères du fer dans les BIF peuvent être expliquées aussi bien par des phénomènes biologiques (oxydation ménagée par des bactéries réalisant la photosynthèse anoxygénique, métabolisme photosynthétique dont le donneur d'électrons n'est pas l'eau comme pour la photosynthèse oxygénique, mais le fer Fe2+, par exemple) que physico-chimiques. Les valeurs élevées dans la pyrite des carbonates seraient expliquées par l'action de bactéries ou d'archées ferri-réductrices (respiration du Fe3+) lors de la diagenèse des sédiments (Li et al., 2015 [13]).
Bactéries et formation des BIF
Bien que l'évolution des appareils photosynthétiques soit complexe, des transferts horizontaux de gènes ayant joué un rôle considérable (Raymond et al., 2003 [17]), l'apparition des bactéries réalisant la photosynthèse anoxygénique avant celle des cyanobactéries oxygéniques est bien acceptée (Battistuzzi et al., 2004 [2]). La recherche d'analogues actuels à l'océan archéen (anoxique, très salé, ferrugineux, sans sulfate) est compliquée. Le cycle du fer a été étudié dans le lac La Cruz (Espagne), un analogue “convenable” (bien que d'eau douce) de l'océan archéen. Il s'agit d'un lac stratifié avec une chimiocline dans la zone euphotique et une colonne d'eau ferrugineuse, sans sulfates. En utilisant des techniques d'analyse microbiologiques et biogéochimiques, une équipe a prouvé dans ces conditions la précipitation d'oxydes mixtes Fe(III)-Fe(II) en conditions anaérobies, sous la dépendance de bactéries réalisant la photosynthèse anoxygénique (Walter et al., 2014 [23]).
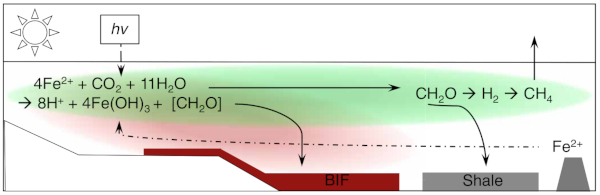
Un argument qui soutenait l'oxydation abiotique du fer par du dioxygène dans les BIF est l'absence de matière organique dans ces roches. Parmi les bactéries qui effectuent la photosynthèse anoxygénique, celles qui utilisent le fer Fe2+ comme donneur d'électrons (et non l'eau comme dans le cas de la photosynthèse oxygénique) sont appelées photoferrotrophes. Le résultat de leur activité est la précipitation de phases minérales contenant du fer oxydé Fe3+. L'observation et les modèles numériques montrent que les photoferrotrophes sont capables d'oxyder le Fe(II) à des vitesses suffisantes pour former les dépôts massifs de BIF, et soutiennent une productivité primaire importante. Les photoferrotrophes pélagiques doivent maintenir leur position dans la zone euphotique alors que les oxyhydroxydes de fer précipités ont tendance à adhérer aux surfaces cellulaires et à causer leur sédimentation rapide. Les oxyhydroxydes de fer ont des charges de surface positives, qui entrainent une forte affinité pour les surfaces cellulaires chargées négativement. Dans les océans, le dépôt de Fe(III) en présence de biomasse photosynthétique pourrait nourrir la respiration qui couplerait l'oxydation de matière organique à la réduction du Fe(III), empêchant la préservation de cette forme oxydée dans les BIF. Des expériences avec le photoferrotrophe Chlorobium ferrooxidans ont montré qu'en présence d'une millimole (mM) de silice dissoute, une concentration raisonnable pour l'océan archéen, la souche bactérienne ne s'associait pas avec les particules d'oxyhydroxydes de fer : l'incorporation d'anions SiO44− dans les oxyhydroxydes de fer baisse leur charge et leur affinité pour les surfaces cellulaires (Thompson et al., 2019 [21]). Cette répulsion explique la formation de BIF très pauvres en matière organique. Les auteurs postulent que la biomasse des phototrophes se serait déposée au sein d'environnements côtiers, formant des couches riches en matière organique propices à la production biologique de méthane. Ces émissions de méthane auraient stabilisé le climat alors que le Soleil était moins actif que maintenant. Ce modèle est explicité sur la Figure 3. La disparition de ce méthane lors du GOE, due à l'oxygénation de l'atmosphère, aurait entrainé la première Snowball Earth (Hoffman et Schrag, 2002 [9]).
Source - © 2019 D’après Thompson et al. [21]
Les microorganismes à l'origine des BIF seraient vraisemblablement des bactéries ferrophototrophes.
La ligne pointillée indique la provenance hydrothermale du Fe2+.
Refroidissement de la Terre interne, métabolisme des Procaryotes et Grand Évènement Oxydant (GOE)
La datation du Grand Évènement Oxydant
Si l'élément oxygène est abondant dans l'Univers, la molécule d'O2, ou dioxygène, sous une forme dominante gazeuse est très rare vu sa réactivité, notamment vis-à-vis de l'hydrogène et de la matière organique. Les données géochimiques suggèrent que l'oxygénation de la surface de la Terre s'est produite en deux étapes principales (Figure 4). La première étape, le Grand Évènement Oxydant que nous allons développer, a eu lieu entre 2,45 et 2,2 Ga, conduisant à l'oxygénation de l'atmosphère et de l'océan de surface. La deuxième étape a eu lieu à la fin du Néoprotérozoïque et a conduit à l'oxygénation de l'océan profond il y a 580 Ma (Kump, 2008 [12]).
Source - © 2008 D’après Kump [12]
Figure 4. Évolution de la teneur en oxygène de l'atmosphère terrestre depuis 4 Ga
Le fractionnement indépendant de la masse des isotopes du soufre avant 2,45 Ga impose une teneur très basse en dioxygène (Farquhar et al., 2000 [5]) ; l'enregistrement de l'altération oxydante (absence de pyrite ou d'uraninite détritique) après 2,2 Ga donne une limite inférieure à 1 % de la teneur actuelle tandis que la limite supérieure à 40 % de la teneur actuelle est supposée d'après la persistance d'anoxie dans les océans protérozoïques. Depuis 420 Ma, l'enregistrement continu de charbon de bois dans des sédiments encadre la teneur en oxygène : les flammes ne peuvent pas persister en dessous de 60 % de la teneur actuelle ; au-dessus de 160 %, les feux de forêt continuels empêcheraient l'établissement de forêts.
Liens entre le Grand Évènement Oxydant et le refroidissement de la Terre
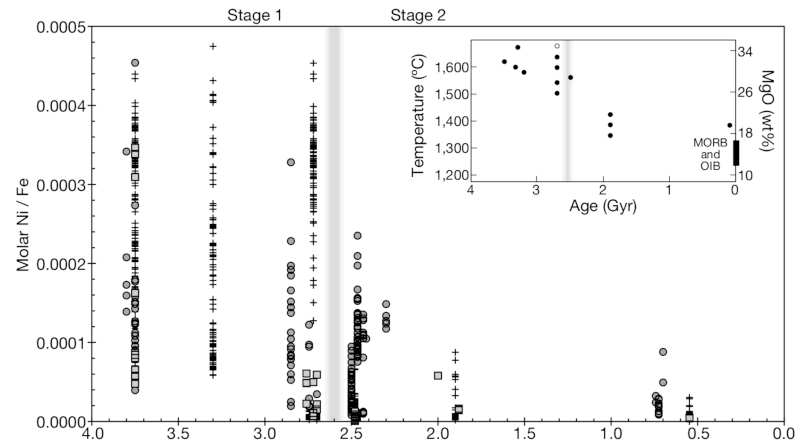
Le premier facteur causal du Grand Évènement Oxydant (GOE) est l'apparition de la photosynthèse oxygénique chez les cyanobactéries. Mais les cyanobactéries sont apparues au moins 300 Ma avant cet évènement. Il faut alors penser à des puits à oxygène pour expliquer le décalage, des molécules réductrices dont la présence aurait temporairement limité l'oxygénation de l'atmosphère. Des changements de style tectonique et volcanique vers la transition Archéen-Protérozoïque auraient aussi pu faciliter l'oxygénation de l'atmosphère. Le puits d'oxygène pourrait avoir été le méthane produit par les Archées (Archaea). Une équipe a mesuré en 2009 le rapport Ni/Fe dans les BIF archéens (Figure 5) et a pu proposer un scénario crédible pour la survenue du GOE (Konhauser et al. [11]).
Le manteau se refroidissant pendant l'Archéen, les épanchements de laves ultramafiques riches en nickel (élément compatible) diminuent. L'altération de ces laves libère moins de nickel, donc la teneur en nickel des océans diminue (attestée par la mesure de Ni/Fe dans les BIF au cours du temps) ; or les Archées méthanogènes ont besoin de nickel pour le site actif de certaines enzymes comme les hydrogénases ou les méthyl-coenzyme-M réductases ; la diminution de l'accessibilité du Ni les auraient soumises à une famine, leur moindre développement entrainant une production plus faible de méthane donc une diminution de la consommation de l'oxygène et une augmentation de la teneur en oxygène de l'atmosphère. Le phénomène se serait auto-entretenu, les Archées méthanogènes étant très sensibles à l'oxygène. Ce scénario est corroboré par la survenue de la première Snowball Earth vers 2,4 Ga, qui serait ainsi liée à la diminution de la teneur atmosphérique en méthane (puissant gaz à effet de serre).
Source - © 2009 D’après Konhauser et al. [11]
Le rapport Ni/Fe des BIF, représentant le rapport molaire océanique d'alors, chute vers 2,7 Ga, traduisant le refroidissement du manteau terrestre.
Les causes du Grand Évènement Oxydant sont, outre la présence de cyanobactéries, le refroidissement à long terme de la Terre, qui a limité le fonctionnement de puits à oxygène (molécules réduites issues soit de l'hydrothermalisme, soit de l'activité biologique des Archées). Le Grand Évènement Oxydant a été un passage majeur dans l'histoire de la Terre, avec des conséquences minéralogiques, climatiques et biologiques considérables. Après le Grand Évènement Oxydant, les teneurs en oxygène de l'atmosphère sont estimées entre 0,2 et 8 %. Les premières conséquences du Grand Évènement Oxydant sont tout simplement minéralogique : la pyrite, la sidérite et l'uraninite détritiques disparaissent tandis qu'apparaissent une grande diversité d'oxydes de fer, manganèse, cuivre. Les sulfates deviennent plus abondants, d'où la présence de gypse (CaSO4, 2H2O), célestine (SrSO4), barytine (BaSO4). Les conséquences biologiques du Grand Évènement Oxydant ont été sans doute gigantesques. Tout d'abord, cet évènement a posé un énorme problème aux microorganismes qui n'étaient pas habitués à la toxicité de l'oxygène. De plus, de nombreux ions métalliques, comme Fe2+, utilisés dans de nombreuses métalloprotéines, et abondants dans un océan anoxique, ont précipité, conduisant à une catastrophe écologique. La disponibilité de l'oxygène moléculaire a rendu possible l'existence de chaines respiratoires avec O2 comme accepteur final d'électrons, cet évènement étant proche dans le temps de l'apparition des eucaryotes vers 2,1 Ga (Hedges et al. [8], Han et Runnegar, 1992 [7]).
Bibliographie
A.C. Allwood, M.R. Walter, B.S. Kamber, C.P. Marshall, I.Z. Burch, 2006. Stromatolite reef from the Early Archaean era of Australia, Nature, 441, 714-718 [pdf]
F.U. Battistuzzi, A. Feijao, S.B. Hedges, 2004. A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land, BMC Evolutionary Biology, 4, 44 [Open Access]
C.E. Blank, P.S. Sánchez-Baracaldo, 2009. Timing of morphological and ecological innovations in the cyanobacteria - a key to understanding the rise in atmospheric oxygen, Geobiology, 8, 1, 1-23 [pdf]
D.E. Canfield, S.W. Poulton, G.M. Narbonne, 2007. Late-Neoproterozoic Deep-Ocean Oxygenation and the Rise of Animal Life, Science, 315, 5808, 92–95 [pdf]
J. Farquhar, H. Bao, M. Thiemens, 2000. Atmospheric influence of Earth's earliest sulfur cycle, Science, 289, 5480, 756–758
K.L. French, C. Hallmann, J.M. Hope, P.L. Schoon, J.A. Zumberge, Y. Hoshino, C.A. Peters, S.C. George, G.D. Love, J.J. Brocks, R. Buick, R.E. Summons, 2015. Reappraisal of hydrocarbon biomarkers in Archean rocks, PNAS, 112, 19, 5915-5920 [Free Access]
T.-M. Han, B. Runnegar, 1992. Megascopic eukaryotic algae from the 2.1-billion-year-old Negaunee iron-formation, Michigan, Science, 257, 5067, 232-355
S.B. Hedges, H. Chen, S. Kumar, D.Y.C. Wang, A.S. Thompson, H. Watanabe, 2001. A genomic timescale for the origin of eukaryotes, BMC Evolutionary Biology, 1, 4 [Open Access]
P.F. Hoffman, D.P. Schrag, 2002. The snowball Earth hypothesis: testing the limits of global change, Terra Nova, 14, 129–155 [Free Access]
C. Klein, 2005. Some Precambrian banded iron-formations (BIFs) from around the world: Their age, geologic setting, mineralogy, metamorphism, geochemistry, and origins, American Mineralogist, 90, 10, 1473–1499
K.O. Konhauser, E. Pecoits, S.V. Lalonde, D. Papineau, E.G. Nisbet, M.E. Barley, N.T. Arndt, K. Zahnle, B.S. Kamber, 2009. Oceanic nickel depletion and a methanogen famine before the Great Oxidation Event, Nature 458, 750–753
L.R. Kump, 2008. The rise of atmospheric oxygen, Nature, 451, 277-278 [pdf]
W. Li, B.L. Beard, C.M. Johnson, 2015. Biologically recycled continental iron is a major component in banded iron formations, PNAS, 112, 27, 8193-8198 [Free Access]
J.-F. Moyen, P. Thomas, 2007. Les stromatolithes, Planet-Terre, ISSN 2552-9250
S.W. Poulton, P.W. Fralick, D.E. Canfield, 2004. The transition to a sulphidic ocean approximately ~1.84 billion years ago, Nature, 431, 173-177 [pdf]
S.E. Rashby, A.L. Sessions, R.E. Summons, D.K. Newman, 2007. Biosynthesis of 2-methylbacteriohopanepolyols by an anoxygenic phototroph, PNAS 104, 38, 15099-15104 [Free Access]
J. Raymond, O. Zhaxybayeva, J.P. Gogarten, R.E. Blankenship, 2003. Evolution of photosynthetic prokaryotes: A maximum-likelihood mapping approach, Philosophical Transactions of the Royal Society B: Biological Sciences, 358, 1429, 223-30 [pdf]
A. Saghaï, Y. Zivanovic, N. Zeyen, D. Moreira, K. Benzerara, P. Deschamps, P. Bertolino, M. Ragon, R. Tavera, A.I. López-Archilla, P. López-García, 2015. Metagenome-based diversity analyses suggest a significant contribution of non-cyanobacterial lineages to carbonate precipitation in modern microbialites, Frontiers in Microbiology, 6, 797 [CC BY]
J.W. Schopf, 1993. Microfossils of the Early Archean Apex chert: new evidence of the antiquity of life, Science, 260, 5108, 640-646
R.E. Summons, L.L. Jahnke, J.M. Hope, G.A. Logan, 1999. 2-Methylhopanoids as biomarkers for cyanobacterial oxygenic photosynthesis, Nature, 400, 554-557 [pdf]
K.J. Thompson, P.A. Kenward, K.W. Bauer, T. Warchola, T. Gauger, R. Martinez, R.L. Simister, C.C. Michiels, M. Llirós, C.T. Reinhard, A. Kappler, K.O. Konhauser, S.A. Crowe, 2019. Photoferrotrophy, deposition of banded iron formations, and methane production in Archean oceans, Science Advances, 5, 11, eaav2869 [Open Access]
D. Wacey, M. Saunders, C. Kong, A. Brasier, M. Brasier, 2016. 3.46 Ga Apex chert ‘microfossils' reinterpreted as mineral artefacts produced during phyllosilicate exfoliation, Gondwana Research, 36, 296-313 [pdf]
X.A. Walter, A. Picazo, M.R. Miracle, E. Vicente, A. Camacho, M. Aragno, J. Zopfi. 2014. Phototrophic Fe(II)-oxidation in the chemocline of a ferruginous meromictic lake, Frontiers in Microbiology, 5 [CC BY]