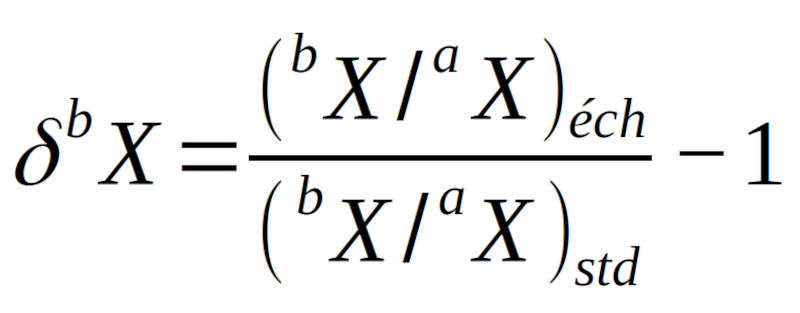Article | 17/11/2023
Les cycles biogéochimiques
17/11/2023
Résumé
Comprendre les cycles en général pour mieux appréhender, entre autres, le cycle du carbone et ses liens avec le climat.
Table des matières
- Étape 1 – L’eau et son cycle, pour poser les bases
- Étape 2 – Cycle du carbone et climat, pour revenir à un classique
- Étape 3 – Le soufre et les interactions entre cycles, pour pimenter
- Étape 4 – L’océan et l’âge de la Terre, de Joly à la spillitisation
- Étape 5 – Cycles, cyclicité et fractionnement isotopique
- Et pour aller plus loin en intégrant ce qui a été vu
Déroulé augmenté d'une formation en ligne
Le parcours proposé ci-dessous est basé sur le déroulé de la formation en ligne délivrée du 14 septembre au 20 octobre 2023. Après relecture du déroulé initial, corrections, précisions et compléments d'information aboutissent, avec la reformulation de certains passages, à un parcours plus complet dont les commentaires proviennent essentiellement des réponses des participants et d’échanges durant la formation.
Étape 1 – L’eau et son cycle, pour poser les bases
Ressources à (re)découvrir / parcourir et questions
- M.T. Chahine, 1992. The hydrological cycle and its influence on climate, Nature, 359, 373-380 – figure 1 p.373
- A. Jambon, A. Thomas, 2009. Géochimie – Géodynamique et cycles, Dunod, 408p – figure 9.1 p.204
- J.-M. Caron et al., 1992. Comprendre et enseigner la planète Terre, Ophrys, 274p. – figure 179 p.199
Après avoir pris connaissance des 3 figures proposées ci-dessus, répondez aux questions ci-dessous avec l'aide éventuelle de ressources complémentaires du site Planet-Terre ou d’ailleurs.
- Dans les 3 figures proposées, quels sont les 3 paramètres toujours considérés pour représenter le cycle de l’eau ? Quel est le paramètre supplémentaire qui est proposé dans la figure de Caron et al. ? Exprimez-le, si possible, en fonction des autres paramètres disponibles. Quelles grandes différences et similitudes remarquez-vous entre ces représentations du cycle de l’eau ? Proposez une explication.
- Ajoutons l’information suivante : le volcanisme terrestre génère un flux d’eau d’environ 2.1012 kg/a vers l’atmosphère. Pourquoi cette information n’a-t-elle pas été prise en compte dans les représentations précédentes ? Comment l’intégrer à une représentation plus “complète” ?
- Depuis plusieurs décennies, le volume des glaces (montagnes, inlandsis) diminue. Confronter cette information aux cycles proposés pour mettre en évidence l’hypothèse sous-jacente à la représentation des cycles. Comment cette hypothèse apparait-elle néanmoins dans les représentations ?
Éléments de réponse
On trouve toujours des réservoirs délimités ayant un nom et un stock de l’élément considéré (ici l’eau), réservoirs entre lesquels sont représentés et quantifiés des flux. Un temps de résidence est parfois indiqué. Le temps de résidence d’un élément est, pour un réservoir donné, le rapport entre le stock et la somme des flux entrants (ou sortants).
Dans les trois figures, les mêmes grands réservoirs sont toujours présents, mais certaines représentations précisent des sous-réservoirs individualisés ou non, séparent ou non l’atmosphère en atmosphère terrestre (continentale) et atmosphère marine et les données, bien que non exactement égales, sont du même ordre de grandeur. Si les grands réservoirs terrestres à distinguer sont à priori évidents, on est amené ou non à focaliser son regard sur le ou les réservoirs les plus impliqués dans les processus que l’on étudie. Par exemple, on distinguera ou non les glaces selon les processus étudiés. On peut aussi penser que les représentations diffèrent en fonction du public visé : chercheurs modélisateurs, climatologues, étudiants.
- Ce flux est minime par rapport aux flux considérés. À court et moyen terme, il peut donc être négligé (attention un apport même apparemment minime sur de très longues périodes géologiques peut avoir de grandes conséquences). De plus, sa prise en compte nécessiterait de représenter un réservoir supplémentaire, le manteau terrestre, et les flux le reliant aux autres réservoirs. Si les cycles proposés sont réalisés dans le cadre de la compréhension de phénomènes externes à court ou moyen terme, on peut ne pas intégrer ces échanges mathématiquement minimes non (ou peu) impliqués dans les phénomènes de surface étudiés.
- Dans le cycle de Jambon et Thomas qui distingue bien le réservoir “glaces”, on note des flux entrants et sortants égaux. Aucune variation du stock de glace n’est donc “envisagée”. Cela vient du fait que l’on considère généralement un état stationnaire pour les réservoirs représentés car on représente souvent d’abord un état des lieux des réservoirs, flux et processus globaux moyens impliqués dans le cycle étudié. Les échanges se font alors entre réservoirs de stocks constants, ce que l’on peut vérifier par le fait que les flux entrants et sortants d’un réservoir sont égaux.
Commentaires
- Si on prend les chiffres des trois documents pour calculer le temps de résidence de l’eau dans l’atmosphère, on trouve de l’ordre de 0,022 à 0,030 an (soit 8 à 11 jours) et pas 0,3 a (110 jours) comme indiqué sur la figure du Caron et al. (pas facile d’éditer un livre sans coquille).
- Le temps de résidence d’un élément dans un réservoir, parfois noté τ, est le rapport de la masse de l’élément considéré dans ce réservoir sur la somme des flux entrants (ou sortants, chaque réservoir étant considéré à l’équilibre). Ce temps est parfois appelé temps de renouvellement car il correspond au temps nécessaire pour apporter (ou extraire) une quantité d’élément égale à la capacité du réservoir. Mais, les réservoirs étant considérés comme bien mélangés et homogènes, on ne peut pas considérer que tout nouvel apport, à t>0, ”pousse” une quantité équivalente d’élément présent à t<0, de fait qu’à t=τ, tout ce qui était présent initialement serait remplacé. Si on reprend l’exemple de l’eau qui a un temps de résidence de l’ordre de 10 jours dans l’atmosphère, cela ne signifie pas que toute l’eau présente un lundi matin dans l’atmosphère a précipité le mercredi soir de la semaine suivante et a été totalement remplacée. Par contre cela signifie que pendant ces 10 jours, la quantité totale d’eau précipitée est égale à la quantité présente dans l’atmosphère. De l’eau peut s’évaporer et reprécipiter dans les minutes ou heures qui suivent. Parfois l’eau évaporée au-dessus d’un océan peut parcourir des milliers de kilomètres avant de précipiter bien plus loin en étant restée plus de 10 jours dans l’atmosphère. Cependant, on peut montrer par le calcul que le temps de résidence, tel qu’il est défini, correspond au temps moyen passé par l’élément considéré dans le réservoir étudié : parfois il y reste moins longtemps, parfois plus, mais en moyenne il y reste un temps τ.
- Point de vocabulaire : un bassin est dit endoréique lorsque son réseau de rivières n’atteint jamais les océans (l’eau des rivières n’atteint jamais “la mer”).
Étape 2 – Cycle du carbone et climat, pour revenir à un classique
Ressources à (re)découvrir / parcourir et questions
Source - © 2000 D’après Gaillardet[figure 3]
- J. Gaillardet, 2000. Cycle du carbone - Le cycle géologique du carbone, Planet-Terre (réponses aux questions)
- A.-S. Krémeur, 2008. Modélisation du cycle du carbone, Planet-Terre, diapositive 4 et diapositive 5 (diaporama complet)
Après avoir lu l’article de J. Gaillardet et pris connaissance des deux diapositives d’A.S. Krémeur, répondez aux questions ci-dessous avec l'aide éventuelle de ressources complémentaires du site Planet-Terre ou d’ailleurs.
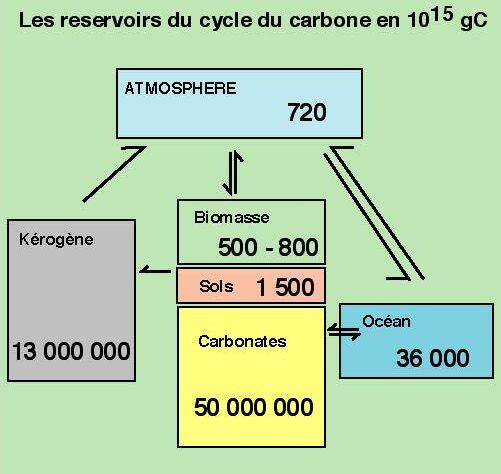
- En prenant en compte les réservoirs représentés sur la figure 3 de Gaillardet (2000), et en comparant aux cycles de l’eau vus en première étape, indiquer les différences globales entre eau et carbone concernant leurs formes / états dans les différents réservoirs et la nature des flux représentés. Quel réservoir important n’est pas représenté sur cette figure ? Pourquoi, à votre avis ?
- Quels sont les différences entre les cycles présentés sur les diapositives 4 et 5 de Krémeur (2008) ?
- La diapositive 5 indique en rouge ce qui est lié à l’activité humaine depuis 1820-1850 environ (début de l’ère industrielle). Que remarque-t-on lorsqu’on fait le bilan des flux affectant l’océan de surface ? À quoi cela est-il dû ? Quels sont les réservoirs affectés et, d’après vos connaissances, quels en sont les impacts globaux observables et/ou envisageables (au moins 1 exemple) ?
- [subsidiaire] Peut-on aujourd’hui négliger le réservoir et les flux mantelliques et les processus géologiques associés pour l’étude rigoureuse du climat à l’échelle du siècle à venir ?
Éléments de réponse
- Pour l’eau, on suit partout la même molécule H2O (sauf éventuellement –OH pour les minéraux hydroxylés quand on prend en compte le manteau), et les flux sont des transferts de matières avec ou sans changement d’état. Pour le C, cet élément est contenu dans des molécules diverses : CO2, HCO3−, CO32−, matière organique, charbon, hydrocarbures, carbonates… et les flux sont parfois de simples transferts ou équilibres mais aussi des transformations importantes (photosynthèse, synthèse, combustion, précipitation…). Le manteau, réservoir principal en masse, n’est par représenté car on s’intéresse souvent au seul cycle externe et les flux entre externe et interne sont faibles et considérés comme équilibrés à l’échelle de temps des études.
- Le cycle à long terme nous présente les grands processus géologiques à l’échelle de la planète qui se jouent sur des milliers voire des millions d’années. Pour le cycle à court terme, quantifié, on reste sur le cycle externe concernant les processus biologiques et l’équilibre océan-atmosphère, non détaillés dans les processus à long terme, pour une modélisation à “court terme”.
- Le bilan des flux sur l’océan superficiel montre que les flux entrants sont supérieurs aux flux sortants avec un excédent de 0,3 Pg de C par an (1 Pg = 1015g soit, autre notation classique mais non conforme à la notation scientifique, 1 Gt – 1 milliard de tonnes). Il n’y a pas équilibre, ce réservoir “grossit”. La source initiale de cet afflux de C est la combustion des combustibles fossiles (fossile fuels) ainsi que la déstabilisation du réservoir de biomasse par la déforestation et l’usage des sols. L’atmosphère est directement impactée et ensuite, l’océan superficiel et profond. Cet apport de carbone à l’atmosphère sous forme de CO2, gaz à effet de serre, engendre une augmentation de la température globale et, par équilibre avec les océans, une acidification des océans. L’augmentation de température induit une dilatation de l’océan superficiel et une fonte des glaces qui expliquent une augmentation du niveau des océans. Température en hausse et acidification entrainent aussi un des stress sur les coraux induisant un blanchissement de ces derniers.
- Le climat est lié à l’énergie solaire et aux réservoirs et processus externes. Les échanges avec le manteau étant faibles, leurs éventuelles variations n’auraient d’impact qu’à plus long terme, au-delà de la fin du siècle. Les variations climatiques liées à des crises volcaniques historiques (observées et consignées), par exemple, n’ont eu d’effet que sur quelques semaines, mois ou années. Certes, une éruption volcanique importante aurait un effet… mais on ne peut prévoir ni sa survenue, ni son intensité (et donc l’éventuel impact au-delà de quelques semaines).
Commentaires
- Il semble important de bien redonner l’équation d’équilibre des carbonates, parfois encore écrite “trop vite”, CO2 + CO32− + H2O ↔ 2 HCO3−, à retrouver, par exemple dans La Fontaine de Réotier (Hautes-Alpes)… et l'acidification des océans (article dans lequel il est aussi question, comme indiqué dans le titre, de l’acidification des océans).
- Il est important de bien se rappeler l’échelle de temps pour laquelle on considère un processus. Par exemple, le bilan carbone de la biomasse est nul à l’échelle de temps de la vie des organismes. Une forêt climacique (à l’équilibre) relargue autant de carbone qu’elle n’en séquestre. Par contre, remplacer une prairie par une forêt piège du carbone pendant toute la phase de croissance de la forêt (quelques décennies).
- Un cycle à l’équilibre ne signifie pas que les flux entre chaque couple de réservoirs sont égaux, mais bien que pour chaque réservoir la somme des entrants égale la somme des sortants.
- Attention à ne pas lire trop vite et à confondre Pg (pétagramme, 1015 g) et pg (picogramme, 10−12 g). On pourra se rafraichir la mémoire en relisant Multiples et sous-multiples jusqu’à 10^(−)30.
- Proposition de lecture : L’océan, puits de carbone à l’avenir incertain (M. Pérez, 2021) sur le site du CNRS.
- À (re)voir pour retrouver les liens climat-carbone, la conférence de Laurent Bopp (2019) Rétroaction entre le climat et le cycle du carbone et la diapo 5 de son diaporama montrant le cycle “déséquilibré” du carbone.
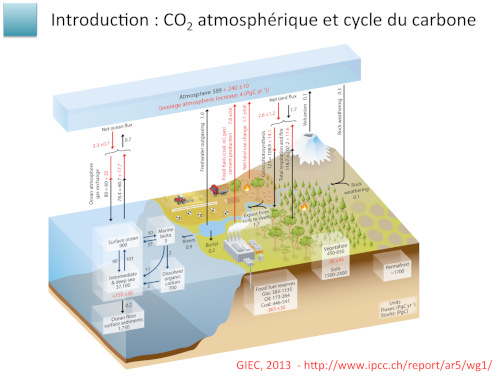
Figure 6.1 de la partie Carbon and Other Biogeochemical Cycles du rapport du GIEC Climate Change 2013: The Physical Science Basis reprise dans le diaporama de Laurent Bopp (2019)
Étape 3 – Le soufre et les interactions entre cycles, pour pimenter
Ressources à (re)découvrir / parcourir et questions
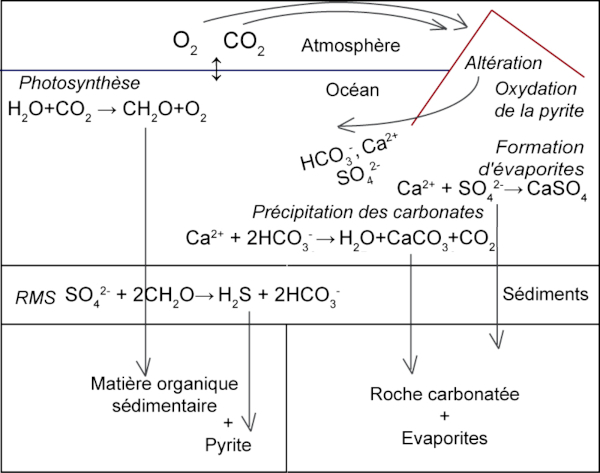
Source - © 2023 Guillaume Paris
- G. Paris, 2023. Le cycle du soufre, un acteur essentiel dans le contrôle de la composition chimique du système océan-atmosphère, Planet-Terre
Après avoir lu l’article ci-dessus, répondez aux questions ci-dessous avec l'aide éventuelle de ressources complémentaires du site Planet-Terre ou d’ailleurs.
- Quels sont les 2 principales formes minérales soufrées, l’une réduite et l’autre oxydée, relativement faciles à trouver et à montrer à des élèves / étudiants ? Dans quelles conditions / quels contexte se forment-elles ?
- Donnez 2 liens directs ou indirects d’action de composés soufrés sur des mécanismes affectant le climat. En quoi le cycle du soufre est-il en lien avec la biomasse ? Quel est le rôle du soufre dans la RMS (réduction microbienne du soufre) : contexte et conséquence sur le cycle du S.
- À partir des cycles étudiés, proposez la conséquence à long terme d’une baisse importante du volcanisme d’origine mantellique sur la composition en O2 et CO2 de l’atmosphère (et de l’océan). Qu’est-ce que cela pourrait donner si on partait d’une atmosphère initiale riche en CO2 et pauvre en O2 … comme il y a 3 Ga ?
- [subsidiaire] D’après vos connaissances, donnez au moins un exemple d’élément “mineur” dont le cycle est très important pour la matière organique et donc la vie.
Éléments de réponse
La forme réduite est la pyrite (FeS2). On trouve de la pyrite dans les roches magmatiques et métamorphiques, mais les gisements les plus fréquents sont sédimentaires (et diagénétiques) et hydrothermaux (hydrothermalisme océanique et continental) (cf. Cube, cubo-octaèdre, octaèdre, dodécaèdre… les différentes formes cristallines de la pyrite (FeS2).
Une forme oxydée classique est le gypse (CaSO4.2H2O) (et sa forme déshydratée, l’anhydrite). Le mode de formation dominant est le contexte évaporitique mais il y a aussi du gypse formé par mobilisation et cristallisation hydrothermales aussi bien en contexte volcanique, plutonique que sédimentaire (cf. par exemple, Soufre natif, gypse et sulfato-réduction et Le gypse triasique de Bidart, Pyrénées Atlantiques).
Le soufre atmosphérique peut former des aérosols augmentant l’albédo (diminution de l’énergie solaire reçue au sol) et contribuant ainsi à un refroidissement… tant que les aérosols sont présents dans l’atmosphère. Par ailleurs, l’acide sulfurique libéré par l’altération peut remplacer le CO2 atmosphérique dans les réactions d’altération des silicates (normalement pompe à CO2) et des carbonates (normalement bilan nul, mais, ici, dégazage de CO2), ce qui contribue à ne pas diminuer voire à augmenter l’effet de serre lié au dioxyde de carbone, donc à ne pas refroidir voire à réchauffer.
La présence de S dans certains acides aminés et dans d’autres molécules soufrées (coenzymes, ponts disulfure dans certaines protéines…) fait de la biomasse un réservoir et un agent du cycle du soufre. La RMS est une respiration anaérobie dans laquelle le soufre oxydé devient soufre réduit , il est accepteur d’électrons, rôle tenu par l’oxygène dans la respiration oxygénée, cette respiration réduit donc le soufre.
On essaie de voir ce à quoi aboutit la variation d’un flux à priori mineur mais sur un temps long. On considère alors les autres flux comme non modifiés. Une baisse du volcanisme d’origine mantellique diminue le flux de CO2 et de soufre vers l’atmosphère (ou le système océan-atmosphère). Remarquons, qu’il diminue aussi le flux de fer réduit présent dans les laves (altérées par la suite).
Si on diminue les apports mantelliques de CO2 vers l’atmosphère en gardant le même flux d’apport vers le manteau (subductions) et la formation de carbonates, on diminue le stock de carbone atmosphérique. Cette diminution est alors facilitée à long terme par la baisse de CO2 dans l’océan (baisse de l’acidité) qui déplace l’équilibre des carbonates vers leur précipitation (attention : la précipitation de carbonates à partir des éléments issus de la dissolution de carbonates a un effet nul sur le stockage du C et donc du CO2, ici, on parle d’une variation des composants de l’équation d’équilibre non liée à une telle dissolution). Ceci mène donc, petit à petit, à une baisse de la teneur en CO2 dans l’atmosphère et donc à un effet de refroidissement sur le climat.
La baisse des émissions de sulfures, et autres éléments réduits (Fe2+), limite la “consommation” de dioxygène engendrée par leur oxydation dans l’atmosphère et l’océan. On peut donc envisager, une fois oxydé le “stock” d’éléments réduits, une augmentation de la teneur en O2 dans les océans et l’atmosphère. Si on partait d’une très faible teneur en oxygène dans l’atmosphère, on peut arriver à des teneurs permettant la formation d’une teneur en ozone facilitant l’implantation de vie hors de l’eau grâce à son effet protecteur contre les rayonnements ultraviolets délétères pour l’ADN (l’eau protégeant la vie marine de ces UV).
On voit ici qu’une perturbation du cycle interne “long” à flux quantitativement faibles par rapport aux réservoirs de surface, peut engendre à long terme, par effet cumulatif, des modifications importantes.
Un élément classiquement étudié est le phosphore (P), élément limitant pour le développement des “plantes” (et de toute la chaine trophique qui suit). Sa principale source (pour la vie) est l’altération de l’apatite (phosphate de calcium). La limitation spatiale d’une forte biomasse marine à la proximité des côtes est liée aux apports de P, entre autres, par les fleuves. Le phénomène d’upwelling près des côtes permet aussi la remobilisation d’éléments nutritifs (dont le P) issus de la sédimentation des restes des êtres vivants de la zone côtière.
On peut aussi s’intéresser aux cycles de l’azote (N) (mais pas très “mineur” dans la composition de la matière organique dont les 4 éléments principaux sont C, H, O et N) et du potassium (K) (autre composant des engrais “NPK”), ou à ceux d’autres éléments mineurs mais nécessaires pour la vie tels que Ca, Fe, I, Ni, Mn… et autres éléments entrants dans la composition de molécules et cofacteurs divers (Se, Si…).
Commentaires
- La pyrite se forme en milieu anoxique en général, pas seulement sur le plancher océanique. Tout bassin sédimentaire peut présenter à un moment ou à un autre des conditions d’anoxie.
- L’évaporation et la formation d’évaporites ne nécessite pas le chaud mais le sec, même si l’évaporation est plus rapide en milieu chaud. Les salars andins montrent que l’évaporation en milieu endoréique fonctionne très bien en altitude (cf. Un exemple de salar : le salar d'Atacama, Chili.
- Dans la RMS (réduction microbienne du soufre), à l’instar du dioxygène dans la respiration aérobie, le sulfate, SO42-, peut jouer le rôle d’accepteur d’électrons. Cela permet d’oxyder le carbone organique contenu dans la biomasse des écosystèmes présents en milieux anaérobie, et donc de reminéraliser ce carbone. Il y a donc ici un lien entre cycle du carbone (minéralisation du C) et cycle du soufre (réduction du S).
Étape 4 – L’océan et l’âge de la Terre, de Joly à la spillitisation
Ressources à (re)découvrir / parcourir et questions
Source - © 2016 Pierre Thomas
- [pour l’aspect historique] J. Joly, 1925. Finding the Age by Solvent Denudation, in The Surface-History of the Earth, Oxfor: the Clarendon press, 155-156
- [pour l’aspect historique] P.N. Wyse Jackson, 2001. John Joly and his determinations of the age of the Earth, in C.L.E. Lewis & S.J. Knell (eds) The Age of the Earth: from 4004BC to AD2002, Geological Society, London, Special Publication, 190, 107-119
- P. Thomas, 2016. Un volcanisme bien méconnu et pourtant si riche d'enseignement : le volcanisme du Crétacé supérieur du Pays Basque, ses pillow-lavas et la salinité de l'eau de mer, Planet-Terre
- Quelques données pour un exercice de quantification.

Après avoir éventuellement pris connaissance des textes concernant les travaux de Joly, et lu l’article de Pierre Thomas, répondez aux questions ci-dessous avec l'aide éventuelle de ressources complémentaires du site Planet-Terre ou d’ailleurs.
- Reprenant une idée d’Edmond Halley vers 1715, John Joly a considéré que les quantités actuelles en certains éléments dans les océans résultaient de leur accumulation au fil des temps par les apports des rivières à partir d’un océan primitif d’eau pas ou très peu minéralisée et en l’absence de processus connu extrayant ces éléments. Dans le cadre d’un cycle équilibré du sodium et en considérant que la formation des océans est précoce dans l’histoire de notre planète, ceci lui permet d’estimer l’âge de la Terre (de l’ordre de 90 Ma). À partir des données actuelles proposées, expliquer le calcul et l’appliquer au Cl et au Na. Commenter.
- L’étude de basaltes “océaniques” (du moins marins) altérés a mis en évidence le phénomène de spillitisation ou albitisation des plagioclases. Rappeler les formules de l’anorthite et de l’albite et ce qu’est la spillitisation. Quel(s) élément(s) est(sont) libéré(s) lors du passage de l’anorthite à l’albite par apport de Na ? Dans le cadre d’un cycle équilibré du sodium et en considérant que l’hydrothermalisme dans la lithosphère océanique est le processus qui permet le maintien d’une teneur constante en Na dans les océans (les apports venant des rivières), calculer le flux d’eau océanique annuel nécessaire sachant que seul 10 % du sodium de l’eau de mer réagit lors de son passage dans la lithosphère. En déduire, en combien de temps “toute l’eau de l’océan passe dans la lithosphère” par ce processus.
- Qu’est-ce qui est en réalité estimé par les calculs de J. Joly, à l’époque, et ceux de la première question, aujourd’hui ?
- [subsidiaire] Donner une conséquence de la circulation d’eau liée à l’albitisation sur l’évolution thermique de la lithosphère océanique.
- [subsidiaire] La lithosphère océanique “apporte” de l’eau “océanique” dans le manteau non lithosphérique (qui en restitue par volcanisme). Rappeler un effet fondamental de ce cycle interne de l’eau sur la dynamique du manteau.
Éléments de réponse
La masse de Cl dans l'océan est de 1,83.107.10−9 × 1,40.1021 soit environ 2,56.1019 kg (ne pas oublier le facteur 10−9 pour passer des μg aux kg). Le flux de Cl des rivières vers les océans est de 7,8.103.10−9 × 3,6.1016 soit environ 2,8.1011 kg.a−1. Pour apporter cette masse de Cl dans les océans avec ce flux annuel, il faut donc une durée égale à 2,56.1019 / 2,8.1011 années soit environ 91,4 Ma. De même, pour apporter une masse d'environ 1,46.1019 de Na avec un flux annuel de 2,16.1011 kg.a−1, il faut environ 67,6 Ma.
On retrouve l'ordre de grandeur de 90 Ma trouvé par Joly pour le Cl, et pas si loin pour le Na. Disons qu'on reste dans des ordres de grandeurs de plusieurs dizaines de millions d'années, ce qui à l'époque de Joly était déjà un résultat important dans la discussion sur une formation de la Terre très récente (quelques milliers d'années) ou beaucoup plus longue pour permettre l'évolution biologique et le déroulement de processus géologiques qu'on commençait à quantifier et à trouver ”lents” à l'échelle humaine. On a tout de même un écart important, l'“âge Na” étant plus court de 25 % par rapport à l'“âge Cl”, ce qui peut laisser entrevoir un souci concernant le principe de calcul (si on exclut à priori des erreurs de mesures, de connaissance des flux et concentrations).
Anorthite : CaAl2Si2O8. Albite : NaAlSi3O8. Lors de la spillitisation, c'est-à-dire de la transformation des plagioclases calciques en plagioclases sodiques par apport de Na, il y a libération de Ca (qui pourra précipiter sous forme de calcite dans des vacuoles…) ainsi que, à Si constant, “libération” d'Al (on passe de 1 Al pour 1 Si à 1 Al pour 3 Si, soit 1/3 d'Al pour 1 Si) qui va s'intégrer dans les minéralisations métamorphiques liées à l'hydrothermalisme.
Pour compenser les apports de 2,16.1011 kg.a−1 de Na (voir question précédente), par un export d'eau concentrée à 1,04.10−3 kg/kg (10 % de la concentration océanique en Na), ce flux d'export doit être égal à 2,16.1011 / 1,04.10−3 soit environ 2,1.1014 kg.a−1. La masse des océans étant de 1,40.1021 kg, une masse d'eau équivalente à la masse des océans passe dans la lithosphère en 1,40.1021 / 2,1.1014 années, soit environ 6,7 Ma. Ceci signifie que l'eau des océans se “renouvelle” dans la lithosphère tous les 7 Ma environ (ce serait un temps de résidence de l'eau dans les océans si on considérait seulement les réservoirs “océan” et “lithosphère océanique” à l'équilibre avec le flux d'échange calculé). C'est très court à l'échelle des temps géologiques mais aussi très long comparé au temps de résidence de l'ordre de 3 200 ans (voir la figure 179 p.199 du Caron et al. de la première étape), ce qui découle du fait que les flux d'eau du cycle externe sont bien plus importants.
- Les calculs de John Joly et ceux de la question 1 ont permis de déterminer, avec les données et estimations disponibles, non pas un âge de la Terre, mais un temps de résidence du Na dans l'océan (si la teneur océanique en Na est considérée stable).
- Le flux d'eau océanique “froide” dans la lithosphère océanique “chaude” exporte de la chaleur de la lithosphère vers l'océan. Ce système de refroidissement (l'hydrothermalisme océanique) explique le refroidissement “accéléré” de la lithosphère de part et d'autre des dorsales par rapport à un modèle de refroidissement par simple conduction thermique.
- Outre le fait que l'introduction d'eau dans le manteau par déshydration “précoce” de la lithosphère océanique entrée en subduction abaisse le solidus du manteau sus-jacent et permet un magmatisme de type calco-alcalin, l'“injection” continue d'eau dans le manteau a un rôle sur les propriétés physique de ce dernier. En effet, cet apport compense sa déshydratation par volcanisme et maintien sa viscosité à des valeurs permettant la convection (cf. Le nombre de Rayleigh : une approche “avec les mains”). Ceci explique, par exemple, la différence entre la Terre et Vénus, planètes telluriques de taille comparable mais l'une avec de l'eau liquide en surface, flux d'eau de la surface vers le manteau et tectonique des plaque en surface, et l'autre (Vénus) sans eau liquide à la surface, sans apport d'eau pour compenser le dégazage mantellique et sans tectonique de type “terrien” du fait d'une dynamique mantellique différente.
Commentaires
- Attention aux formules de l’anorthite (CaAl2Si2O8) et de l’albite (NaAlSi3O8), il n’y a pas le même nombre d’Al3+. Donc passer de l’un a l’autre n’est pas qu’une simple substitution de Ca2+ par Na+.
- Les calculs d’“âges ” / temps de résidence sont de l’ordre du calcul du temps nécessaire pour remplir un seau d’eau de 10 litres sous un robinet présentant un débit de 2 L/min… Il n’y a aucune difficulté conceptuelle. Cependant, il faut bien comprendre les données pour calculer correctement les flux et stocks à prendre en compte (le flux de Na n’est par le flux d’eau mais le produit du flux d’eau par la concentration en Na de cette eau). Il y a eu, en plus de quelques blocages (horreur des maths ! je ne sais sûrement pas faire !) des erreurs explicables par une certaine précipitation (on oublie un terme) ou des soucis de calculette (on est à un facteur 1000 près). Pour finir sur les chiffres, il est bon de rappeler que les calculs donnent plein de chiffres… tous les donner n’est pas utile. Trouver, par le calcul 91 239 316,24 ans est une chose, s’en contenter comme résultat en est une autre. En prenant trois valeurs estimées (flux, stock, concentration), on ne va pouvoir être précis à l’échelle de quelques jours ! De plus, ici, l’exercice consiste à obtenir un ordre de grandeur (estimation de l’âge de la Terre pour Joly, il ne s’attendait pas à trouver le jour d’apparition de la Terre), on pouvait alors donner “91,4 Ma” et même juste “environ 90 Ma” (on pouvait garder “91,4” pour comparer Cl et Na au cas où ils auraient été proches, mais pas descendre en dessous du dixième de million d’années – ce qui n’est déjà très optimiste concernant la précision possible).
- On retrouvera l’importance de la circulation d’eau dans la lithosphère océanique dans l’article de S. Labrosse Géophysique des fonds océaniques (2009).
Figure 5 de la partie Géophysique des fonds océaniques (S. Labrosse, 2009) montrant l’effet de la circulation hydrothermale sur le flux de chaleur mesuré en s’éloignant d’une dorsale.
Étape 5 – Cycles, cyclicité et fractionnement isotopique
Ressources à (re)découvrir / parcourir et questions
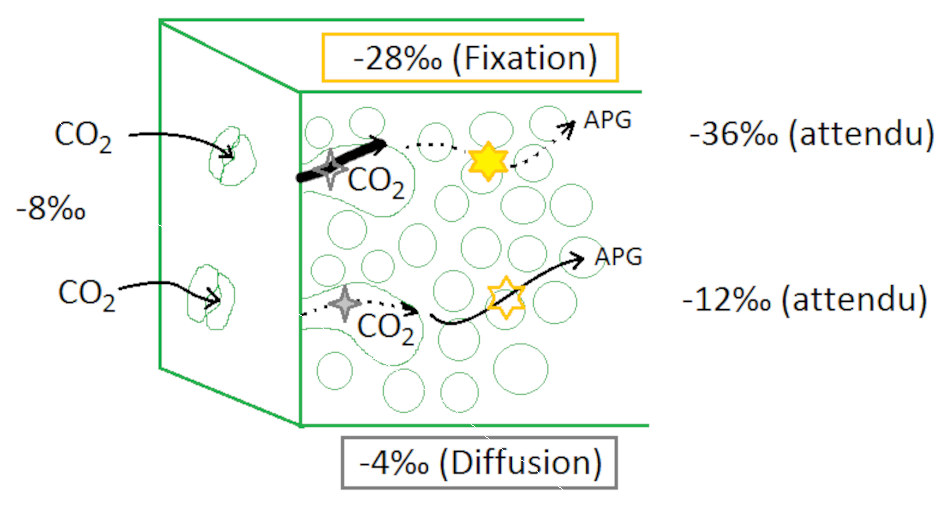
Source - © 2014 Alexandra Touzeau
- G. Delaygue, 2002. Le fractionnement de l'oxygène dans les nuages, Planet-Terre
- A. Touzeau, 2014. Fractionnement isotopique du carbone chez les plantes vasculaires, Planet-Terre
Après avoir lu les articles ci-dessus, répondez aux questions ci-dessous avec l'aide éventuelle de ressources complémentaires du site Planet-Terre ou d’ailleurs.
- Quelle différence isotopique en oxygène (δ18O) peut-on observer entre l'eau de surface océanique et l'eau issue de son évaporation et formant ensuite les nuages ? Qu'est-ce-qui induit une différence encore plus importante entre l'eau océanique et l'eau qui précipite et forme les glaces polaires ou de montagne ? Si on envisage une fonte importante des glaces, quelle variation de δ18O s'attend-on à observer dans les foraminifères marins du fait de la perturbation du cycle de l'eau (taille des réservoirs) ? Quel autre facteur est aussi à prendre en compte pour expliquer l'évolution attendue du δ18O des carbonates de ces foraminifères en un site donné ?
- Quelle est la différence isotopique en carbone (δ13C) entre la matière organique et le CO2 atmosphérique ? Quelle en est la cause ? Expliquer la variation du δ13C atmosphérique attendue du fait de l'activité humaine actuelle ? Quel est l'usage non directement climatique possible des études du δ13C dans les fossiles animaux ou restes humains récents ?
- Quelle différence de sens du mot “cycle” peut-on relever entre les expressions “cycles astronomiques” (cycles de Milankovic) et “cycles biogéochimiques” ? Rappeler comment les études de ces deux types de “cycles” peuvent être reliées.
- [subsidiaire] Discuter, sur la base de ce qui a été fait à la question 1, du caractère intuitif ou non de l'observation suivante : « lors d'une glaciation, le δ18O des glaces polaires diminue ». Expliquer cette observation.
- [subsidiaire] Discuter brièvement de la “validité” de l'expression « cycle des roches ».
Éléments de réponse
Les molécules d'eau plus lourdes s'évaporent un peu moins vite que les molécules plus légères. La vapeur d'eau est donc plus “légère” et présente un δ18O plus faible que l'eau de mer dont elle provient. Par la suite, lors des précipitations progressives, les molécules d'eau les “lourdes” précipitent plus facilement, ce qui abouti à de la vapeur d'eau résiduelle qui s'allège progressivement au fil des pluies. Les eaux qui précipitent sur les inlandsis polaires ou sur les hautes montagnes présentes donc un δ18O bien plus faible que celui de l'eau océanique de surface.
Si les glaces “légères” fondent, c'est de l'eau “légère” préalablement stockée dans ces glaces qui retourne à l'océan. Le δ18O des eaux océaniques va donc baisser (eaux plus “légères” qu'avant) et donc les foraminifères, en contact avec cette eau “allégée” vont aussi voir leur δ18O s'abaisser (mais être plus élevé car lors de phénomènes de précipitation, les isotopes lourds sont préférentiellement incorporés). La température a aussi un rôle. Si les glaces fondent, c'est que la température moyenne augmente, donc la température de l'eau aussi. Or le fractionnement diminue lorsque la température augmente. Les foraminifères seront donc toujours plus “lourds” que l'eau de mer mais dans une moindre mesure du fait de la température plus élevée. On aura donc un δ18O des foraminifères plus faible du fait 1/ de la baisse du δ18O des eaux (plus légères) et 2/ de la température plus élevée qui limitera le fractionnement (qui a tendance à alourdir) par rapport à l'eau.
Remarque : dans l'autre sens, en cas de mise en glace, l'eau des océans s'alourdit du fait de l'extraction préférentielle de vapeur d'eau légère et, la température diminuant et accentuant le fractionnement, le calcaire des foraminifères aura un δ18O encore plus fort.
La matière organique est plus légère (δ13C plus faible) que le CO2 atmosphérique du fait 1/ de la diffusion plus aisée des molécules de CO2 “légères” de l'air dans les tissus végétaux et 2/ d'une fixation préférentielle du CO2 léger par la molécule de rubisco.
L'activité humaine brule de la matière organique fossile à faible δ13C, donc cela alimente l'atmosphère en carbone léger et on doit voir baisser le δ13C du CO2 atmosphérique.
Le δ13C peut aussi être utilisé pour étudier les variations éventuelles de régime alimentaire et, entre autres, l'alimentation plus ou moins riche en plantes en C3 ou en C4, proportion C3/C4 variable selon le climat local et/ou les pratiques agriculturales chez Homo.
Dans les paramètres des cycles de Milankovic, on parle bien de paramètres périodiques dans lesquels on retrouve un état ou une situation identique de manière régulière, cyclique, périodique. On peut définir une période ou une fréquence pour chacun de ces paramètres. Le cycle est “temporel”.
Dans le cas des “cycles” biogéochimiques, on a des échanges entre réservoirs avec la possibilité pour l'élément ou la molécule considérés de revenir à un moment donné dans son réservoir “initial” après avoir fait un plus ou moins long “tour”, ou une “boucle”… d'où l'idée de “cycle”, avec, de plus, une grandeur caractéristique, à l'équilibre, qui est le temps de résidence qui indique une certaine “périodicité” au sein du réservoir faisant partie d’un réseau “spatial”. On a aussi un certain “bouclage” dans le sens où l'on peut réaliser des bilans de masse pour vérifier que rien ne se perd (on n'a oublié ni processus ni réservoir) dans ce cycle-réseau d'échanges.
Les paramètres cycliques peuvent induire des modifications par exemple du climat, ce qui génère des changements de flux et de masse des réservoirs (eau, CO2…). De même, des perturbations courtes ou des évolutions longues de certains flux peuvent accentuer ou atténuer les effets de paramètres cycliques (éruptions volcaniques et climat, par exemple).
[subsidiaire] Dans le cas d'une glaciation, on s'attend, avec un raisonnement similaire à celui mené à la première question, à une augmentation du δ18O des eaux océaniques par évaporation et stockage préférentiels de molécules d'eau légères. Mais l'eau de pluie formant les glaces se forme à partir des eaux océaniques qui deviennent plus lourdes. On pourrait donc avoir des eaux de précipitation plus lourdes en période glaciaire au niveau des glaciers. Or on observe le contraire. Il y a deux effets contraires en parallèles. Tout d'abord, le δ18O des océans augmente en période glaciaire, mais peu car le volume des océans est tel par rapport à celui des glaces que cette variation à la hausse est plus que compensée par la baisse de température qui augmente le fractionnement moyen et par le trajet plus long des eaux qui précipitent au niveau des calottes glaciaires. À température égale, on peut avoir une vapeur d'eau un peu plus lourde du fait de la modification du δ18O des océans, mais les isothermes “chaudes” se rapprochant de l'équateur, ces vapeurs “lourdes” parcourent un chemin plus long pour arriver au niveau des glaciers et donc s'allègent plus, ce qui, au final donne des précipitations plus légères. À distance égale entre le lieu d'évaporation et le lieu de formation des glaces, la température initiale étant plus faible, le fractionnement sera plus fort et on aura dès le début une vapeur d'eau plus légère.
Ainsi l'effet “alourdissant” de l'extraction d'eau légère dans un réservoir immense, l'océan, est bien plus faible que l'effet moyen de la température qui, en s'abaissant, augmente le fractionnement pour donner des eaux de précipitation plus légères au niveau des glaciers.
- On a vu que l'on suit généralement un élément chimique (C, S…) ou une molécule simple (H2O) lorsqu'on étudie un cycle biogéochimique. Une roche pouvant potentiellement contenir tous les éléments chimiques du tableau de Mendeleiev et les comportements de ces éléments étant très différents face aux principaux processus géologiques (incorporation dans les minéraux, lessivage plus ou moins aisé en fonction aussi de l'état d'oxydo-réduction, migration vers la phase résiduelle ou fondue lors de phénomènes de fusion…), on ne peut pas suivre le devenir d'une roche initiale dans son ensemble. Par contre, cette notion de “cycle” des roches veut rappeler que les différents types de roches sont reliés les uns aux autres et que l'on peut passer de l'un à l'autre (ou plutôt d’un type de roche à un autre) par les grands processus que sont la fusion, la cristallisation, l'érosion, le métamorphisme…
Commentaires
Petit rappel. Il n’y a pas de facteur 1000 (“ ×1000”) dans la formule de calcul d’un δ isotopique :
La notation “‰” est l’équivalent de “10−3”, comme “%” l’est de “10−2” (cf. La notation des valeurs isotopiques : une mise au point). Si un calcul donne la valeur “−0,018”, cela équivaut à “−18.10−3” que l’on note alors “−18 ‰”.
- Attention à l’utilisation des termes “appauvrissement” et ”enrichissement”, bien dire de quel élément, ou ici de quel isotope, on parle. En effet un appauvrissement (relatif) en 18O est aussi un enrichissement (relatif) en 16O. On parle alors parfois, pour les isotopes, d’alourdissement ou d’allègement, ce qui peut faciliter le lien “alourdissement = augmentation du rapport δ” (en général, l’isotope lourd est au numérateur). Ne pas oublier non plus que si on “enlève du lourd”, alors on allège de fait le résidu (on ne l’alourdit pas).
- Le δ13C des carbonates peut être relié à la productivité / masse de la biosphère : en cas de crise biologique “reminéralisant” des quantités importantes de C organique enrichi en 12C, le δ13C des carbonates précipitant après cet évènement pourra diminuer.
- Le δ13C n’a rien à voir avec le 14C, donc rien à voir avec la datation absolue.
Et pour aller plus loin en intégrant ce qui a été vu
Après avoir revu certaines notions, on pourra relire ou réécouter les ressources suivantes de Planet-Terre qui seront plus faciles à comprendre et permettront de faire de nouveaux liens entre les cycles biogéochimiques et d’autres processus géologiques.
- P. Thomas, 2020. La biosphère, un agent géologique majeur – biosphère, oxygène, carbone, phosphates, fer.
- P. Thomas, 2015. Effet de serre et cycle du carbone : deux clés indispensables pour bien comprendre les variations climatiques – carbone, climat.
- G. Mahéo, 2021. L'Himalaya et le carbone – Impacts des processus orogéniques sur le cycle du carbone – climat et carbone mais aussi soufre.
- A. Touzeau, 2014. Histoire du climat africain récent d'après des études isotopiques sur des os et dents de momies égyptiennes des musées de Lyon – isotopes, climat, alimentation.
- V. Gardien, G. Mahéo, 2018. Inclusions fluides, isotopes stables et paléo-altimétrie – climat, altitude, précipitations, isotopes.
- G. Mathéo, V. Gardien, 2018. Comment estime-t-on l'altitude des chaines de montagnes anciennes ? – altitude, isotopes.
Et certainement d’autres ressources de Planet-Terre… et d’ailleurs.