Article | 21/09/2023
Le cycle du soufre, un acteur essentiel dans le contrôle de la composition chimique du système océan-atmosphère
21/09/2023
Résumé
Les principaux réservoirs et les principales formes du soufre. Cycle du soufre et interactions avec les cycles du carbone et de l’oxygène, liens avec le climat, la qualité de l’eau et de l’air.
Table des matières
Contrôles sur le long terme de la composition chimique du système océan-atmosphère
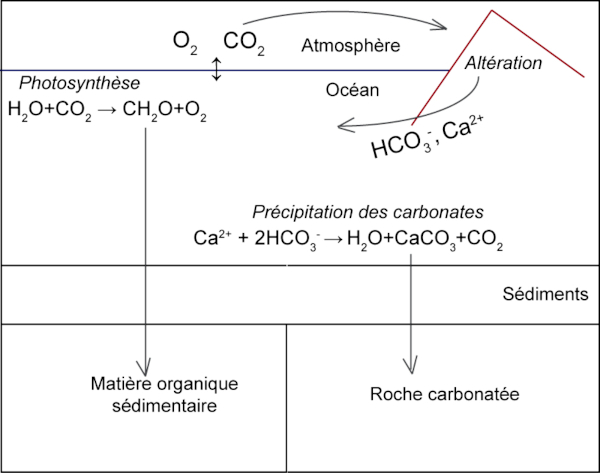
Lorsqu'on s'intéresse à l'évolution de la vie et du climat sur Terre, l'histoire de la composition atmosphérique est primordiale. En effet, les teneurs en CO2 et en O2 ont fortement varié au cours des temps géologiques, comme présenté, par exemple, dans Les cycles du carbone et de l'oxygène : variations et influences sur la composition de l'atmosphère depuis −4,5 Ga jusqu'au début du Quaternaire. À l'échelle des temps géologiques, s'intéresser aux variations de la concentration en CO2 atmosphérique implique de comprendre l'histoire du carbone dans l'ensemble du système océan-atmosphère. En effet, le CO2, comme tout gaz, est échangé entre l'océan et l'atmosphère et ces échanges, très rapides, font que l'on peut considérer le système océan-atmosphère comme un continuum, et, de manière simplifiée, le supposer à l'équilibre. Dans l'océan, le CO2 n'est pas la seule espèce de carbone inorganique. Il est à l'équilibre avec les autres espèces du carbone inorganique dissout : l'acide carbonique (H2CO3), l'ion carbonate (CO32−) et l'ion hydrogénocarbonate (HCO3−), et cet équilibre est régi par le pH et l'alcalinité de l'océan[1] . À l'échelle des temps géologiques, s'intéresser au CO2 atmosphérique implique de comprendre l'histoire du carbone inorganique dissout. Et, au premier ordre, les teneurs en O2 et en CO2 de l'atmosphère sont contrôlées par les cycles biogéochimiques du carbone et de l'oxygène, comme le montre la figure suivante.
En effet, le carbone, présent dans l'atmosphère sous forme de CO2 gazeux, peut être utilisé dans l'océan ou à la surface des continents par les organismes photosynthétiques, notamment dans le cadre de la photosynthèse oxygénique, qui, comme son nom l'indique, libère du dioxygène, O2.
H2O + CO2 → CH2O + O2 (bilan simplifié de la photosynthèse)
Le carbone du CO2 se retrouve ainsi piégé dans la matière organique produite (simplifiée, ici, en CH2O). Si cette matière organique échappe à la respiration aérobie, qui utilise de l'O2 comme accepteur d'électron, alors elle peut se retrouver piégée dans les sédiments, marins ou continentaux.
CH2O + O2 → H2O + CO2 (bilan simplifié de la respiration aérobie)
Ainsi, le couple photosynthèse-respiration participe à contrôler les teneurs en O2 et CO2 de l'océan et de l'atmosphère.
Cependant, aux longues échelles de temps, un autre processus permet de stocker du carbone hors du système océan-atmosphère, dans les sédiments, sous forme de carbonate minéral, comme la calcite ou l'aragonite qui constituent les roches calcaires.
En effet, l'altération continentale, couplée à la précipitation des roches carbonatées dans l'océan, est généralement présentée comme l'un des principaux flux de sortie du CO2 de l'atmosphère à l'échelle des temps géologiques. Cela s'explique par l'altération des silicates calciques (représentés ci-après par la wollastonite, CaSiO3), altération qui favorise la formation d'ions hydrogénocarbonates au détriment du CO2 et la libération d'ions calcium.
H2O + 2 CO2 + CaSiO3 → Ca2+ + 2 HCO3− + SiO2 (altération d'un silicate calcique par le dioxyde de carbone)
Dans l'océan, les ions calcium et hydrogénocarbonates sont utilisés par les organismes calcificateurs pour la synthèse de carbonates de calcium (par exemple les squelettes de coraux, tests de foraminifères, coquille de bivalves, coccolithes).
Ca2+ + 2 HCO3− → CaCO3 + CO2 + H2O (précipitation de carbonate de calcium)
Le couplage des deux réactions, ci-dessous, montre qu'à chaque fois, une molécule de CO2 est fixée / immobilisée.
CO2 + CaSiO3 → CaCO3 + SiO2 (bilan simplifié du couplage altération des silicates calciques + précipitation de carbonate de calcium)
On voit ici que le cycle du carbone est également lié aux cycles du calcium et du silicium.
Un acteur essentiel, le cycle du soufre
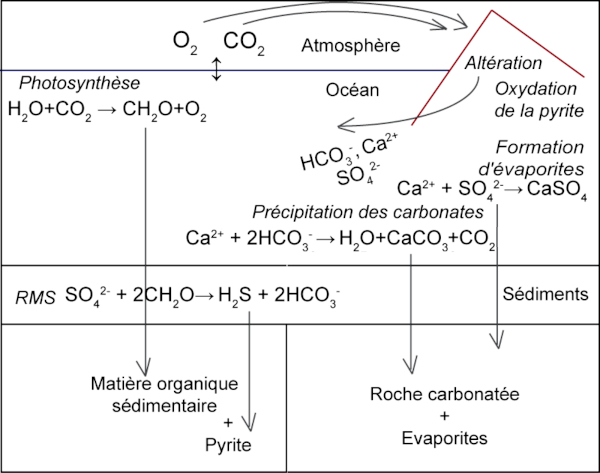
Cependant, un troisième élément est à prendre en compte pour décrire pleinement à la fois le cycle du carbone et celui de l'oxygène, à savoir le soufre. Les interactions entre ces trois éléments sont représentées dans la figure suivante, et nous allons maintenant essayer de décrire les différents processus et mécanismes supplémentaires par rapport à la figure précédente ne présentant que carbone et oxygène.
Figure 2. Principaux couplages entre les cycles du soufre, du carbone et de l'oxygène
RMS = réduction microbienne des sulfates.
Le soufre est un élément présent à la surface de la Terre sous de nombreux états rédox (−II à +VI). Si le soufre est un constituant essentiel de la matière organique[2], son cycle sur le long terme est dominé par les espèces purement minérales.
Le soufre est émis vers la surface de la Terre par les volcans, soit sous forme de sulfure d’hydrogène, H2S, soit sous forme de dioxyde de soufre, SO2. Ce soufre peut, par exemple, précipiter dans les zones volcaniques ou former des aérosols d'acide sulfurique. De manière générale, dans l'atmosphère actuelle, riche en oxygène, le soufre évolue vers sa forme la plus oxydée, le sulfate. L'ion sulfate SO42− est ainsi l'espèce chimique la plus abondante du soufre. Concentré à 28 mmol/L, c'est également l'anion océanique le plus abondant après l'ion Cl−. Il a un temps de résidence extrêmement long dans l'océan moderne, estimé à plus de 10 millions d'années.
L'ion sulfate peut “sortir” de l'océan de deux manières différentes. Il peut être incorporé dans les séquences évaporitiques lors des épisodes de formations de sel. Il y est alors présent sous forme de gypse ou d'anhydrite, minéraux formés de sulfate de calcium plus ou moins hydraté. Il peut également être incorporé dans la pyrite, un sulfure de fer qui se forme en milieu anaérobie. Cette formation est le produit de la réduction microbienne des sulfates (RMS), un processus important du cycle du carbone. Celle-ci est tout simplement une réaction de respiration qui se produit en absence d'oxygène, dans laquelle le sulfate joue le rôle d'accepteur d'électrons. En simplifiant la matière organique sous la forme CH2O, la réduction microbienne des sulfates (RMS) peut s'écrire de la manière suivante.
SO42− + 2 CH2O → H2S + 2 HCO3− (bilan simplifié de la réduction microbienne des sulfates, RMS)
En effet, l'apport d'oxygène aux sédiments marins est généralement limité aux premiers centimètres, où il est rapidement consommé par la respiration aérobie. Cette respiration aérobie a également lieu tout au long de la colonne d'eau, et donc la quantité de matière organique qui arrive aux sédiments n'est que de moins de 1 % de celle qui est produite en surface. Dans les sédiments, lorsque tout l'oxygène est consommé, des mécanismes de respiration anaérobie se mettent en place, comme la réduction des nitrates ou des oxydes de manganèse, de fer… Enfin, lorsque ces réactions ont épuisé les réactifs nécessaires, la réduction microbienne des sulfates prend le relai. Au cours de cette respiration anaérobie qui consomme environ 50 % de la matière organique qui était arrivée jusqu'aux sédiments, le sulfate est réduit en H2S. Celui-ci peut à son tour réagir avec le fer présent dans les sédiments et former de la pyrite (FeS2).
Cette réaction de réduction microbienne couple donc les cycles du carbone et du soufre. En effet, le carbone présent dans la matière organique se trouve reminéralisé. C'est-à-dire qu'au lieu d'être stocké dans les sédiments sous forme de matière organique sédimentaire, il se trouve de nouveau sous forme de carbone inorganique dissout.
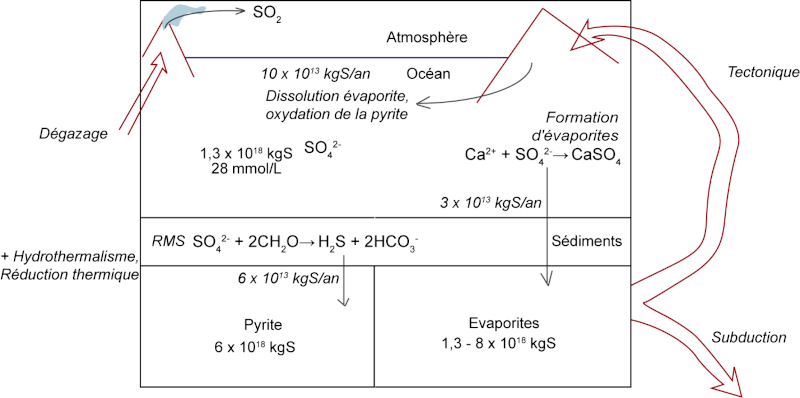
Figure 3. Principaux flux et réservoirs du cycle externe du soufre
Les valeurs des flux et stocks sont issues de Bottrell et Newton (2006)[2].
RMS = réduction microbienne des sulfates.
Avec le jeu de la tectonique des plaques, ce soufre sédimentaire peut ensuite soit se retrouver emporté en subduction et donc renvoyé vers le manteau, soit se retrouver dans les chaines de montagnes qui font émerger des sédiments océaniques.
À la surface des continents, le soufre est donc présent sous ces mêmes deux formes majoritaires[3], à savoir les évaporites de sulfate (gypse, anhydrite) et les pyrites et autres sulfures de fer. On trouve également du soufre réduit, ou du soufre élémentaire, dans les roches basaltiques ou dans les fluides hydrothermaux. Sous l'effet des eaux de surface, les évaporites peuvent se dissoudre, libérant les ions Ca2+ et SO42−. Ces ions sont ensuite transportés par les rivières jusqu'à l'océan. La pyrite, sous l'effet combiné de l'eau et des conditions oxydantes de la surface terrestre, s'oxyde. Cette réaction produit de l'acide sulfurique, H2SO4, qui, lui aussi, se retrouve dans les eaux de surface. Cependant, il ne va pas être transporté tel quel jusqu'à l'océan. Cet acide va ensuite venir perturber le cycle du carbone en s'insérant dans l'altération des roches de surface.
Cycle du soufre et processus de surface
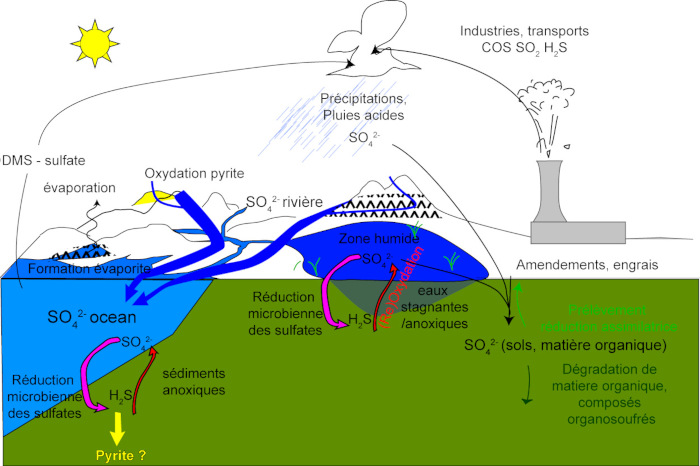
À la surface des continents, que ce soit par les cycles naturels ou l'action de nos sociétés industrielles, le cycle du soufre joue de nombreux rôles. Nous allons en décrire quelques-uns dans la suite.
Altération
La perturbation du cycle du carbone par l'acide sulfurique est double. D'une part, l'acide sulfurique peut remplacer le CO2 pour la dissolution des silicates.
H2SO4 + CaSiO3 → Ca2+ + SO42− + H2O + SiO2 (altération d'un silicate calcique par l'acide sulfurique)
Et, si jamais l'acide sulfurique rentre en contact avec des roches carbonatées, il va entrainer leur dissolution.
CaCO3 + H2SO4 → Ca2+ + CO2 + SO42−+ H2O (dissolution des carbonates par l'acide sulfurique)
Dans ce cas, l'altération peut donc même devenir une source de CO2 vers l'atmosphère, et donc ne plus jouer son rôle de puits de CO2 sur le long terme[4]. On voit donc ici un lien fort entre le cycle du soufre et le cycle du carbone.
Par ailleurs, les sulfates peuvent réagir avec le calcium et ainsi “néoformer” des sels de sulfate de calcium comme le gypse.
Ca2+ + SO42− + 2 H2O → CaSO4·2H2O(gypse) (“néoformation” de gypse)
Cet ensemble de réactions montrent que le cycle du soufre à la surface des continents est complexe et que l'oxydation de la pyrite a de nombreuses conséquences sur les cycles de surface. C'est d'ailleurs l'un des cycles les plus perturbés par les activités humaines, puisqu'il est estimé qu'environ un tiers du sulfate transporté par les rivières aujourd'hui provient de ces activités humaines.
Cycle du soufre et pollution
Les interactions entre les cycles du soufre, du carbone et de l'oxygène, n'ont pas que des implications sur l'étude de l'histoire de notre planète. Elles ont aussi des conséquences très concrètes pour l'environnement.
Ainsi, puisque la pyrite se forme suite à la dégradation de matière organique en conditions anaérobies, les sédiments océaniques riches en matière organique sont également riches en soufre réduit, comme par exemple les sédiments de types marnes noires ou black shales. Or, de tels sédiments sont souvent à l'origine des hydrocarbures exploités par les sociétés thermo-industrielles. C'est également le cas de certaines formations de charbon. Or, en brulant ces énergies fossiles, nous les oxydons. Par conséquent, leur combustion entraine également l'oxydation du soufre réduit, et celui-ci se retrouve émis sous forme soit de particules soufrées, nocives pour la santé, soit sous forme d'aérosols d'acide sulfurique, qui retombent sous forme de pluies acides. C'est en partie pour cela que l'utilisation de filtres à particules a été instauré pour limiter l'impact des émissions de certaines centrales thermiques ou des voitures.
Par ailleurs, l'exploitation de certains gisements, en France ou à l'étranger, peut entrainer le stockage de déchets contenant du soufre réduit, qui, sous l'action de l'atmosphère et des eaux de surface, s'oxyde, formant de l'acide sulfurique et dégradant la qualité des eaux alentours. C'est un problème connu sous le terme de « drainage minier acide » (DMG), et il constitue une menace sérieuse pour l'environnement.
Cycle du soufre et climat
Enfin, il existe de nombreuses interactions entre le cycle du soufre et les paramètres de contrôle du climat sur Terre. En effet, comme nous venons de l'évoquer, le soufre peut, au travers de certaines réactions chimiques, former des aérosols d'acide sulfurique. C'est également ce qui se passe avec les émissions de gaz volcaniques.
Les émissions volcaniques contiennent différents gaz : de la vapeur d'eau, H2O, du dioxyde de carbone, CO2, mais également du dioxyde de soufre, SO2. Or, dans l'atmosphère, ce dernier va subir un certain nombre de réactions chimiques qui entrainent la formation d'aérosols d'acide sulfurique. Et les aérosols ont un impact majeur sur le climat. Cela est dû au fait que les aérosols, avec les cendres et autres poussières présentes dans l'atmosphère, mais également les nuages ou encore les surfaces claires comme les calottes glaciaires, contribuent à augmenter l'albédo de la Terre, c'est-à-dire sa capacité à réfléchir l'énergie solaire reçue par notre planète. Cet albédo est l'un des paramètres de contrôle du bilan radiatif d'une planète, avec l'insolation et l'effet de serre.
En effet, plus la surface d'un corps est réfléchissante, moins sa température d'équilibre est élevée. Ainsi, les aérosols émis par les volcans contribuent de manière négative au bilan radiatif de la Terre, et donc constituent un élément de refroidissement du climat.
Mais ce n'est pas le seul rôle joué par le soufre. En effet, une partie du phytoplancton dont les coccolithophoridés, dont les débris calcaires constituent les roches crayeuses comme celles d'Étretat, génère une molécule spécifique, le diméthylsulfoniopropionate. Celui-ci se dégrade en une autre molécule : le sulfure de diméthyl ou DMS. Lui-même est un précurseur efficace d'aérosols de sulfate, mais également de nuages, qui tout deux contribuent à augmenter l'albédo de notre planète.
Cycle du soufre, dorsales, volcans et minerais
Ainsi, si nous avons décrit le cycle du soufre à la surface de la Terre, nous n'avons fait qu'effleurer les multiples rôles que celui-ci joue dans l'histoire de notre planète. En effet, si du soufre peut être dégazé par les volcans, c'est que celui-ci est présent également dans les profondeurs. En effet, on pense que du soufre est présent dans le noyau, on sait qu'il est présent dans le manteau, et que son dégazage au niveau des volcans et des dorsales est le produit des réactions qui affectent cet élément volatil lors de la remontée de matériel chaud.
Il peut donc quitter le manteau, par dégazage. Au niveau des dorsales océaniques et lors des processus hydrothermaux dans l'océan, il joue un rôle essentiel dans les transferts d'énergie et les réactions rédox au niveau des fumeurs noirs. Le soufre mantellique mais également le sulfate océanique, qui circule au niveau des dorsales et réagit avec les basaltes du plancher océanique et peut-être réduit thermiquement ou par les microbes, entrainent tous les deux la formation de sulfures profonds qui peuvent replonger vers le manteau lors de la subduction ou former des dépôts de sulfures massifs, à l'origine de certains dépôts d'intérêts économiques et industriels que l'on retrouve dans des ophiolites[5].
Par exemple, on peut citer la mine de Kidd en Ontario (Canada) qui s'est formée il y a 2,7 milliards d'années sur d'anciens fonds océaniques et qui constitue un dépôt massif de minerai de soufre, riche en cuivre et en zinc, et associé à la circulation hydrothermale et aux réactions rédox du soufre.
De manière plus générale, de nombreux volcans continentaux sont associés à des émissions de soufre[6], comme, ainsi que leur nom l'indique, la Soufrière de la Guadeloupe, ou la Solftara napolitaine. Dans ces cas, d'ailleurs, l'odeur caractéristique (« œuf pourri ») est due non pas aux émissions de SO2, inodore, mais d'H2S, le sulfure d'hydrogène. Ces odeurs méphitiques, ont d'ailleurs contribué à connecter le sulfureux monde des profondeurs aux représentations infernales de différentes sociétés…
Petit mot de la fin
Ainsi, pour s'intéresser à l'histoire de la Terre, il est toujours nécessaire de considérer les cycles de manière croisée afin d'obtenir l'image la plus complète possible et ainsi de mieux comprendre les différentes interactions et rétroactions qui constituent le système complexe qu'est la surface de la Terre, que ce soit à la surface des continents, dans l'océan ou dans les grands fonds marins.
La versatilité métabolique du soufre liée à ses multiples états rédox en fait un élément central des cycles biogéochimiques en milieu anaérobie, des zones humides aux dorsales océaniques. C'est un élément dont le cycle contribue à façonner les conditions de surface, à la fois en ce qui concerne la composition atmosphérique, mais aussi en agissant directement sur le climat.
Bibliographie
R.A. Berner, 2006. GEOCARBSULF: A combined model for Phanerozoic atmospheric O2 and CO2, Geochimica et Cosmochimica Acta, 70, 23, 5653-5664 [pdf]
S.H. Bottrell, R.J. Newton, 2006. Reconstruction of changes in global sulfur cycling from marine sulfate isotopes, Earth-Science Reviews, 75, 1–4, 59-83
D.E. Canfield, 2004. The evolution of the Earth surface sulfur reservoir, American Journal of Science, 304, 10, 839-861 [pdf]
M. Meybeck, 2003, Global Occurrence of Major Elements in Rivers, in Treatise on Geochemistry, Volume 5, J.I. Drever (ed), H.D. Holland, K.K. Turekian (ed-in-chief), Elsevier, 207-223 [pdf]
[1] Voir aussi G. Michard, 2022. La Fontaine de Réotier (Hautes-Alpes)… et l'acidification des océans.
[2] Cystéine et méthionine contiennent du S, et donc toutes les protéines et molécules complexes qui contiennent ces acides aminés contiennent aussi du S.
[3] Voir, par exemple, P. Thomas, 2001, La géologie du soufre à haute et basse température.
[4] Voir aussi la conférence de G. Mahéo (2021), L'Himalaya et le carbone – Impacts des processus orogéniques sur le cycle du carbone, à 27min41s et dans les questions du public.
[5] Voir, en contexte quasi-ophiolitique, F. Gaudry, P. Thomas, 2019. Les mines de cuivre de Chessy-les-Mines, (Rhône) : des azurites parmi les plus belles du monde formées par interaction de grès carbonatés triasiques avec un amas sulfuré quasi-ophiolitique dévonien – Comparaison avec l'amas sulfuré voisin de Sain-Bel.
[6] Voir, par exemple, P. Thomas (2016), Les dépôts (soufre, sulfates et sublimés divers) des fumeroles et solfatares du Vulcano (Iles Éoliennes, Italie), ou M. Detay, P. Thomas (2013), Hydrovolcanologie appliquée à la phase hydrothermale : fumeroles, solfatares, geysers, lacs acides, mofettes, sources chaudes…, ou encore Y. Formenti, F. Kalfoun, P. Thomas (2004), Le soufre du Kawah Ijen.