Article | 19/09/2000
Cycle du carbone - Le cycle géologique du carbone
19/09/2000
Résumé
TD 2/3 - Les réactions dans l'océan ; l'état de saturation de l'océan vis-à-vis du carbonate de calcium ; les principaux réservoirs de carbone sur Terre ; le cycle global du carbone.
Table des matières
Introduction
Les rivières coulent vers la mer ou de nouvelles réactions chimiques, complémentaires de celle sur se produisent sur les continents se mettent en place et participent au cycle du carbone. C'est ce que nous nous proposons d'explorer avant de replacer ces flux dans un contexte plus global.
Questions
L'océan et les réactions océaniques
En utilisant la composition de l'eau de mer de surface, calculer le degré de saturation de l'eau de mer vis à vis de la calcite. Conclusion ? Écrivez alors la réaction chimique qui devrait se produire dans les estuaires au débouché des fleuves. Quelles sont les conséquences sur le cycle du carbone. réponse.
Le long sommeil du carbone sédimentaire
Connaissant la masse de calcaire sur Terre, déterminer son temps de résidence moyen à la surface de la Terre. réponse.
Inventaire du carbone sur Terre
Faites l'inventaire des principaux réservoirs de carbone sur Terre. Tentez d'estimer la quantité de carbone présente dans chacun d'entre eux. réponse.
L'apprenti sorcier
Calculer la teneur en CO2 de l'atmosphère terrestre si une apprenti sorcier s'avisait de dissoudre complètement les roches calcaires. réponse.
Le cycle géologique du carbone
Réponses
Dans cette partie, on s'exerce à faire des calculs approchés, « à la louche », mais simples et globaux, qui permettent de mieux comprendre le cycle du carbone.
L'océan et les réactions océaniques
La réaction de précipitation de la calcite (c'est la réaction qui cause l'entartrage des tuyauteries en région calcaire) Ca2+ + CO32- ⇄ CaCO3), obéit à la loi suivante (loi de la constante d'équilibre).
[Ca2+] x [CO32-] = KS, où KS s'appelle le produit de solubilité. Cette constante de réaction est fonction de la température.
Attention, pour la simplicité du calcul, on considérera que cette loi fait intervenir des concentrations, mais en toute rigueur, elle n'est vraie que sur des activités chimiques. Le calcul des activités chimiques à partir des concentrations nécessite la connaissance des coefficients d'activités, qui sont calculables, mais sortent du programme des Lycées. Ce qu'il faut bien comprendre, c'est que dès que le produit de solubilité est atteint, la calcite précipite. On dit qu'on a atteint la saturation vis-à-vis de la calcite.
Dans l'eau de mer, on trouve respectivement 10,5.10-3 mol/l de Ca2+ et 30.10-6 mol/l de CO32- dans les eaux de surface. La concentration de l'ion carbonate (CO32-) est calculable à partir de la concentration en HCO3- (2.10-3 M) et du pH (8,3). On trouve donc que le produit de Ca2+ par CO32- donne 0,32.10-6, soit 10-6,5. Pour que la calcite précipite, il faut que ce produit soit au moins de 10-8,4. On voit donc grâce à ce calcul « à la louche » que, dans l'océan, la calcite DOIT précipiter, car ce milieu est sursaturé par rapport à la calcite (à peu près 100 fois dans notre calcul !). Tout ajout supplémentaire de Ca ou de HCO3- (donc CO32-) accentue encore la sursaturation de l'océan vis-à-vis de la calcite.
En particulier, les fleuves qui apportent des ions Ca2+ et des ions HCO3- (donc CO32-) à l'océan doivent entraîner la précipitation de calcite dans l'océan. Cette calcite ne précipite pas de façon « inorganique ». Elle est assurée par les êtres vivants : sur les plates-formes océaniques (coraux, organismes à coquille) et dans l'océan lointain par les organismes planctoniques.
Remarque : le calcul fait ici ne s'applique qu'à l'océan superficiel, l'océan profond (en dessous de 4 000 m) est lui, sous-saturé par rapport à la calcite et toute carapace d'organisme calcaire se dissout à cette profondeur et plus bas.
Nous retiendrons que, globalement, l'océan est sursaturé et reste un lieu de précipitation de calcite. retour.
Le long sommeil du carbone sédimentaire
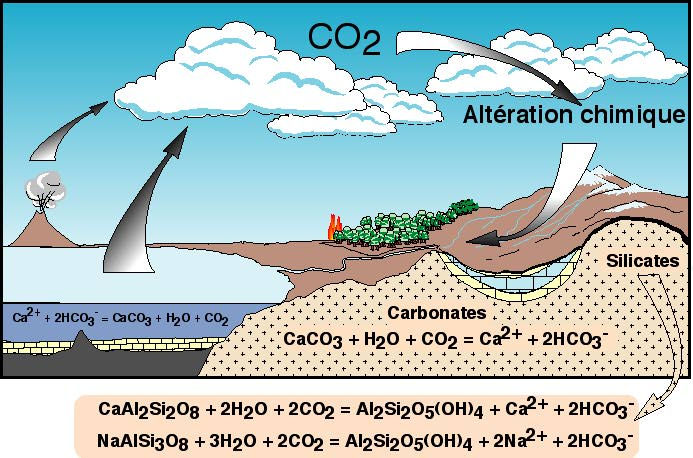
Les études sur la composition chimique des rivières que nous avons abordées dans l'atelier 1 permettent également d'estimer (grâce à des traceurs chimiques ou isotopiques que nous ne pouvons détailler ici) la quantité de C apportée à l'océan provenant de la dissolution des roches calcaires uniquement (c'est-à-dire qu'on soustrait au flux total de C inorganique des rivières, la partie qui vient de l'altération chimique des roches silicatées). La proportion de C provenant de l'altération des calcaires est de 60 %, le reste provenant de l'altération des roches silicatées. Le flux total déterminé dans l'atelier 1 est de 33.1012 molC/an. Donc le flux de C provenant de l'altération des calcaires est d'environ 33.1012 x 0,6 = 20.1012 molC/an. Mais, on se souvient (Figure 1) que l'altération d'une mole de calcite donne deux moles de HCO3-, dont une seulement provient de l'atmosphère, l'autre provenant de la roche calcaire.
Figure 1. Réactions d'altération chimique.
Ce sont donc annuellement environ 10.1012 molC/an qui atteignent l'océan et provenant de la dégradation des roches calcaires affleurant à la surface de notre planète.
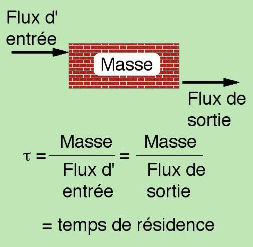
En supposant que le stock de roches calcaires à la surface de la Terre reste à peu près constant (il en disparaît autant par altération chimique qu'il ne s'en forme dans l'océan par unité de temps), alors on peut calculer le temps de résidence moyen d'une roche calcaire à la surface du globe. Le petit schéma simple (Figure 2) montre que, pour un réservoir (un stock, une boîte) constant, ce qui entre est égal à ce qui sort (c'est la définition de l'état stationnaire du réservoir), indépendamment de la masse de ce réservoir. Si on divise la masse du réservoir par le flux entrant (ou sortant, puisque c'est le même), on obtient une grandeur qui a la dimension d'un temps, qu'on appelle le temps de résidence. C'est le temps moyen de séjour d'une particule.
Figure 2. Définition du temps de résidence
Le même formalisme s'applique à la démographie humaine ou encore à des visiteurs dans une salle de musée. La quantité de calcaire estimée sur Terre est de 5.1021 molC. Cette estimation peut varier, mais c'est son ordre de grandeur qui importe. On a déterminé le flux de sortie de la boite « calcaires » par altération chimique (le seul mécanisme qui détruit les calcaires), on possède la masse totale du réservoir, on peut ainsi calculer le temps de résidence moyen d'un atome de carbone piégé dans un calcaire. On trouve qu'un calcaire réside en moyenne à la surface de la Terre 5.1021/10.1012 = 500 millions d'années. Ainsi, la fabrication de calcaires dans l'océan provoque son immobilisation pendant des temps caractéristiques de 500 Ma. La formation des calcaires est bien une forme de stockage du carbone à très long terme. retour.
du carbone sur Terre
Le but de cette question est d'essayer d'énumérer la nature des réservoirs impliqués dans le cycle du carbone ainsi que la quantité de carbone qui y est piégée. On peut à l'occasion mettre en évidence (peut-être de façon quantitative) le carbone dans tout un tas de roches et matériaux naturels par des expériences simples. On peut par exemple, déterminer la teneur en carbone organique d'un sol, la teneur en carbone inorganique d'une roche calcaire, dans l'atmosphère… Une fois les concentrations déterminées, il est intéressant d'essayer de comprendre ce que chaque réservoir représente au niveau global. Par exemple, il ne fait pas de doute que tout être vivant, animal comme végétal est riche en élément carbone. Mais si on multiplie la concentration en C d'un être vivant par la masse totale des êtres vivants, on s'aperçoit que la taille de ce réservoir est ridiculement faible devant certains autres.
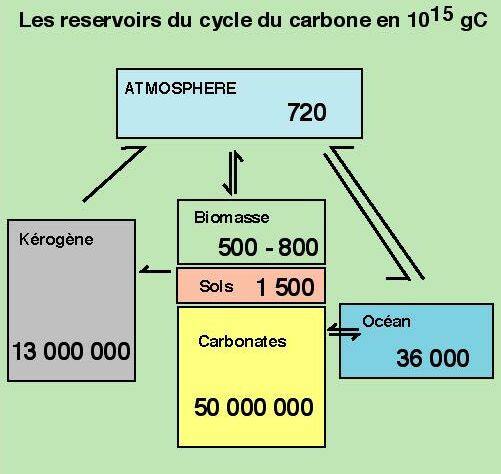
Pour pouvoir faire sentir à des élèves que la répartition du carbone dans les réservoirs superficiels de la Terre est hautement inégale, il est besoin de connaître quelques chiffres, qui, il faut l'avoir en tête, ne sont que des estimations dont seul l'ordre de grandeur est important. Ainsi, les principaux réservoirs de carbone à la surface de la Terre sont donnés dans le schéma de la figure 3.
Figure 3. Les réservoirs du cycle du carbone.
Ce document met en évidence la caractéristique essentielle du cycle du carbone : deux réservoirs dominent nettement les autres : les roches carbonatées et les matières organiques fossiles. Ces dernières comprennent bien sûrs charbons et pétroles, mais également la matière organique disséminée qui est contenue dans toutes les roches sédimentaires. Même si la biomasse et l'océan sont les réservoirs qui jouent un grand rôle dans le cycle du carbone a court terme (à l'échelle humaine), à l'échelle géologique, leur poids est faible.
Remarque : la majorité du carbone sur Terre n'est pas en surface, mais dans les profondeurs. Avec une concentration de 300 ppm et une masse de 4.1027 g, le manteau de la Terre contient quelques 1030g de C, très grand par rapport aux 1023 gC des réservoirs superficiels. L'essentiel du C terrestre est encore dans le manteau. retour.
L'apprenti sorcier
On suppose qu'on dispose pour cela d'une quantité suffisante d'acide chlorhydrique (tout le chlore de l'océan ne suffirait pas à le fabriquer !)… La totalité du réservoir de carbone des calcaires représente 50.1021 gC (Figure 3), soit environ 5.1021 molC. Aujourd'hui, l'atmosphère est constituée de 80 % de N2 et de 20 % d'oxygène. Ces proportions sont des proportions en volume, mais sachant que ces gaz peuvent être considérés comme des gaz parfaits, ce sont également des proportions en nombre de mol. Comme la masse molaire de l'oxygène et de l'azote sont proches (32 et 28 respectivement), ce sont aussi des proportions en masse.
La masse de l'atmosphère est un millionième de la masse de le Terre, soit 5.1021g. Il y a donc aujourd'hui 0,8 x 5.1021 g (4.1021 g) et de diazote et 1021 g d'oxygène O2. En mol, cela correspond à 0,14.1021 mol de N2 et 0,03.1021 mol d'O2. La dissolution de tous les calcaires libérerait 5.1021 molC, et donc la proportion de CO2 dans l'atmosphère serait de 5.1021 / (5.1021 + 0,14.1021 + 0,03.1021), donc 97 %, contre 0,0370 % aujourd'hui.
Ce calcul donne également une idée de la composition de l'atmosphère aux premiers temps de l'histoire terrestre, lorsque les calcaires n'existaient pas. Il conviendrait d'enlever du calcul l'oxygène (qui n'existait pas non plus) et le carbone aujourd'hui stocké dans les matières organiques fossiles. L'estimation de 97 % est donc une valeur minimale pour l'atmosphère terrestre originelle. Ce chiffre est remarquablement proche de la teneur en CO2 de l'atmosphère de Vénus.
La Terre a donc mis en place des mécanismes de séquestration du carbone atmosphérique, dégazé de l'intérieur de la Terre. Ce mécanisme est sans nul doute l'altération chimique suivie de la précipitation du calcaire. La formation des calcaires permet de purifier l'atmosphère en CO2, donc de modérer l'effet de Serre et donc de rendre les températures à la surface de la Terre compatible avec la vie terrestre. retour.
Le cycle géologique du carbone
Le cycle complet est représenté sur les figures 4 et 5. Les flux des rivières découlent du calcul fait dans l'atelier 1, et en plus on a séparé le flux provenant de l'altération des carbonates de celui provenant de l'altération des silicates.
Figure 4. Les réservoirs du cycle du carbone. | Figure 5. Les réservoirs du cycle du carbone. |
Lorsque les rivières emportent à l'océan leurs produits d'altération dissoute, la calcite précipite, principalement grâce aux êtres vivants. La réaction de précipitation du carbonate océanique est exactement l'inverse de celle d'altération des carbonates sur les continents. Si bien, qu'à suffisamment longue échelle de temps, le CO2 atmosphérique qui est prélevé de l'atmosphère par altération des carbonates est libéré dans l'océan par la réaction de précipitation des carbonates. Or l'océan et l'atmosphère, à l'échelle géologique, sont en équilibre. Tout excès de CO2 dans l'océan provoque un flux de CO2 de l'océan vers l'atmosphère et vice-versa. On dit donc qu'à l'échelle géologique (pour des durées de l'ordre de plusieurs centaines de milliers d'années), la réaction d'altération des calcaires ne sert à rien pour la régulation du CO2 atmosphérique. Par contre, certains auteurs pensent que l'altération des carbonates joue un rôle important à plus petite échelle de temps. Pour ceux-là, la teneur faible du CO2 dans l'atmosphère lors du dernier maximum glaciaire serait due pour partie au fait que la baisse du niveau marin a provoqué l'altération chimique des sédiments marins carbonatés, déposés sur les Plates-Formes continentales auparavant.
Par contre, l'altération d'un silicate de calcium (reprenez la réaction d'altération de l'anorthite écrite plus haut) consomme sur le continent 2 mol de CO2, mais une seule est libérée par la précipitation de la calcite dans l'océan. L'altération des silicates de Ca (et aussi de Mg, car on précipite des calcaires magnésiens) est donc un mécanisme capable à long terme de pomper efficacement du CO2 atmosphérique. L'altération des silicates de Na et K est plus délicate à traiter, car on ne sait pas bien ce qui se passe dans l'estuaire. Il est possible que des ions Na de la rivière viennent s'échanger avec des ions Ca ou Mg présents à la surface des particules que la rivière a transporté et impliquer alors la précipitation de calcite.
On retiendra que l'altération des silicates de Ca et Mg est probablement le moyen par lequel la Terre a purifié son atmosphère en CO2 et précipité les calcaires dans les océans. Pour les périodes géologiques postérieures à l'apparition de la vie terrestre, le dépôt dans les mers de carbone sous forme organique est également un moyen de réguler la teneur en CO2 de l'atmosphère, sauf si la quantité de carbone organique incorporée annuellement à des sédiments est du même ordre de grandeur de la quantité de carbone organique fossile oxydé sur les continents. On ignore à ce jour si c'est le cas, c'est-à-dire si le sous-cycle organique est équilibré.
Notons que le cycle du CO2 est alimenté par le dioxyde de carbone d'origine mantellique qui sort au niveau des volcans. Le réservoir de C superficiel semble garder une masse constante car ce qui arrive dans le système par le volcanisme est égal à ce qui replonge dans le manteau dans la subduction.
Comme le montre la figure 5, les flux impliqués dans le cycle géologique du carbone sont très faibles par rapport aux flux d'échange de carbone entre l'atmosphère et la biomasse d'une part et l'atmosphère et l'océan d'autre part (1 000 fois plus grand). Néanmoins, même si ces flux énormes jouent un grand rôle à petite échelle de temps sur la régulation du CO2 atmosphérique, ils ne peuvent pas jouer d'influence à l'échelle géologique. En effet, le flux de photosynthèse est quasi-instantanément compensé par le flux de respiration et l'atmosphère et l'océan sont en équilibre dynamique à l'échelle géologique. retour.
Vers l'Atelier 1 : Comment les continents neutralisent-ils l'acidité atmosphérique ?
Vers l'Atelier 3 : Climat, Tectonique et altération chimique des roches.