Article | 03/12/2014
Fractionnement isotopique du carbone chez les plantes vasculaires
03/12/2014
Résumé
Explication du fractionnement isotopique du carbone (δ13C) lors de l'assimilation du CO2 atmosphérique par les plantes, différences métaboliques à l'origine de la nette distinction isotopique observée entre plante en C3, plante en C4 et plante de type CAM.
Table des matières
Les plantes utilisent l'eau et le dioxyde de carbone pour croître et se renouveler. Le carbone inorganique présent dans la molécule de CO2 est réduit et intégré aux tissus de la plante au cours de la photosynthèse. On obtient alors des molécules organiques contenant du carbone, telles que les sucres, les lipides, les protéines…
Les plantes en C3
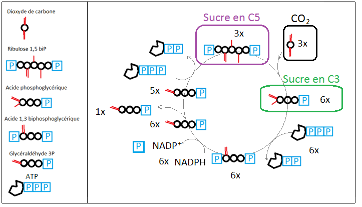
Cycle de Calvin, fabrication de sucres en C3
Pour les plantes dites « en C3 », la première molécule organique produite lors de l'assimilation du CO2 est l'acide phosphoglycérique (APG). Cette molécule possède 3 atomes de carbone, elle porte à une extrémité un groupement phosphate, et à l'autre une fonction acide carboxylique (figure ci-dessous). La présence de ces trois (3) atomes de carbone (C) est à l'origine de la dénomination « en C3 ».
L'acide phosphoglycérique (APG) est fabriqué au cours du Cycle de Calvin (figure ci-dessus) en associant une molécule de CO2 à un sucre à 5 atomes de carbone (le ribulose 1,5-biphosphate). On obtient alors deux molécules d'acide phosphoglycérique. Cependant, il faut bien comprendre ici que seul 1 atome de carbone a été réellement fixé, puisque les deux autres proviennent d'un sucre de la plante. Pour fabriquer une molécule "entière" d'acide phosphoglycérique, il faut faire tourner le cycle 3 fois, et donc intégrer le carbone issu de trois molécules de CO2.
En faisant tourner le cycle de Calvin trois fois, on obtient un bilan de masse équilibré pour le carbone :
- on a initialement 15 atomes de carbone (3 sucres en C5) ;
- on ajoute 3 atomes de carbone (3 molécules de CO2) ;
- obtient 18 atomes de carbone (6 sucres en C3)
- on soustrait 3 atomes de carbone (1 sucre en C3) ;
- on se retrouve avec 15 atomes de carbone (5 sucres en C3) ;
- ceux-ci sont réorganisés pour donner 3 sucres en C5 : quantité initiale.
Les trioses-phosphates (sucres en C3) "extraits" du cycle de Calvin sont à la base de la chaîne de formation du glucose (C6H12O6).
Fractionnement par la rubisco
La fixation du CO2 sur le ribulose 1,5- biphoshate est réalisée par l'enzyme rubisco. Cette enzyme utilise en priorité le dioxyde de carbone ne comportant que des isotopes légers (reconnaissance liée à la forme du substrat). Ceci induit un fractionnement très défavorable aux isotopes lourds pour le carbone organique produit, par rapport au dioxyde de carbone initial (CO2 atmosphérique : δ13C~-8‰). Les plantes en C3 ont donc un ratio 13C/12C très faible, d'où des valeurs de δ13C très négatives (-25 à -30‰).
Fractionnement et
La notation delta (δ) compare le rapport isotopique du carbone dans un échantillon donné au rapport isotopique dans une référence :
, avec et "PDB" pour Pee Dee Belemnite (cf. La notation des valeurs isotopiques : une mise au point).
La référence est la Pee Dee Belemnite (PDB), un carbonate de calcium. De ce fait, les autres carbonates de calcium dont on mesure la composition isotopique ont souvent une valeur de delta proche de zéro (ratio peu différent du ratio de référence). Quant à la matière organique, elle a des valeurs de négatives, ce qui correspond à des ratios 13C/12C nettement plus faibles que dans le carbonate de référence (moins de carbone lourd). Ces ratios plus faibles s’expliquent notamment par l’existence d’un fractionnement "anti-isotopes lourds" (ou "pro-isotopes légers") lorsque le carbone du CO2 atmosphérique est "fixé" par les plantes au cours de la photosynthèse.
Compétition entre diffusion et fixation par la rubisco
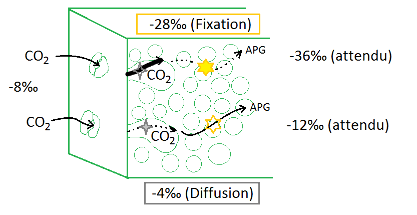
Dans le détail, deux fractionnements sont à prendre en compte :
- un premier fractionnement est possible lors de la diffusion du CO2 à travers les stomates et dans l'air interne jusqu'aux cellules (-4‰) ;
- un deuxième fractionnement existe lors de la fixation du CO2 par la rubisco (-28‰).
Dans les deux cas, le tri est fonction de la quantité de matière disponible et de la "facilité" de la réaction.
- Si la diffusion est facile (sans obstacle, sans ralentissement…), alors il n'y a que peu de tri à cette étape et tout le tri est réalisé par la rubisco : on attend alors un très fort fractionnement de -28‰ (en haut sur la figure ci-dessus).
- Si la diffusion est difficile (lente), cela induit un tri des isotopes du carbone (faible fractionnement de -4‰), et la rubisco est tellement limitée en matériau qu'elle utilise tout ce qui se présente (pas de tri lors de la fixation) (en bas sur la figure ci-dessus).
Si la diffusion est limitante, la valeur attendue pour la matière organique est de -12‰ (carbone atmosphérique à -8‰ et fractionnement de -4‰) ; si la fixation est limitante, la valeur attendue pour la matière organique est alors de -36‰ (carbone atmosphérique à -8‰ et fractionnement de -28‰). Dans les faits la valeur se situe vers -28‰ ce qui est entre ces deux extrêmes. Le tri se fait donc principalement lors de la fixation, mais la diffusion a aussi un faible impact.
Les plantes en C4
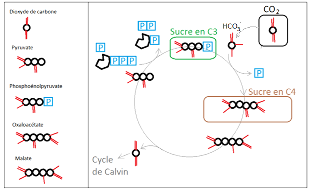
Fixation du CO2, fabrication de sucres en C4
Pour les plantes dites « en C4 », la première molécule produite lors de la fixation du CO2 est un sucre à quatre atomes de carbone (l'oxaloacétate). L'oxaloacétate est ensuite converti en malate, qui est transféré depuis les cellules du mésophylle vers les cellules de la gaine périvasculaire. Une fois à destination, il libère le dioxyde de carbone dont il est porteur, lequel va alors être intégré dans un cycle de Calvin classique. Le squelette de pyruvate restant effectue le trajet retour. En lui associant un groupement phosphate, on obtient une molécule "énergisée" le phopshoénolpyruvate, qui servira d'accepteur pour une nouvelle molécule de CO2.
Les sucres en C4 formés vont migrer, "relarguer" du CO2 afin d'alimenter dans d'autres cellules le cycle de Calvin et donc la formation, secondaire et spatialement décalée, de sucres en C3 puis la formation de glucose.
Fractionnement par la PEP carboxylase
Dans le détail, le CO2 est d'abord converti en HCO3-, et cette dissolution s'accompagne d'un fractionnement positif : le HCO3- produit est enrichi en isotope lourd (13C) par rapport au dioxyde de carbone initial (fractionnement d'environ +9‰). La fixation de l'ion HCO3- sur le phosphoénolpyruvate, réalisé par la PEP-carboxylase, s'accompagne d'un faible fractionnement (préférence pour l'isotope léger) de -2‰. Le fractionnement total pour la fixation du carbone est donc de +7‰.
Compétition entre diffusion, PEP carboxylase et rubisco
Si on considère la fixation du HCO3- par la PEP-carboxylase comme étant l'étape limitante (la plus difficile, la plus lente), alors les étapes suivantes, et notamment le passage par le cycle de Calvin, n'induiront pas de fractionnement. Bien évidemment, il y aussi un fractionnement possible du fait de la diffusion du CO2 depuis l'extérieur jusqu'aux cellules, comme pour les plantes en C3. Il est, comme vu précédemment, de l'ordre de -4‰.
Si c'est la diffusion qui est limitante, la matière organique produite devrait avoir une composition de -12‰ (carbone atmosphérique à -8‰ et fractionnement de -4‰), si c'est la fixation par la PEP-carboxylase qui est limitante, elle devrait avoir une composition de -1‰ (carbone atmosphérique à -8‰ et fractionnement de +9‰), et si c'est la seconde fixation par la rubisco qui est limitante, de -36‰ (carbone atmosphérique à -8‰ et fractionnement de -28‰). Pour les plantes en C4, la valeur observée est de -14‰, donc assez proche de celle obtenue par diffusion, qui semble être ici l'étape limitante. Un faible effet additionnel de tri par la rubisco expliquerait qu'on soit un peu en-dessous de -12‰.
Intérêt du métabolisme en C4 en zone aride
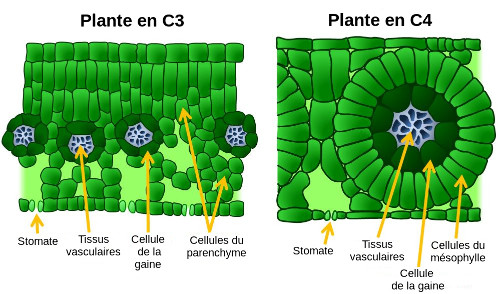
Différences dans l'anatomie de la feuille : C3 vs C4
Source - © 2014 D'après Robert Bear, David Rintoul, modifié
L'organisation générale est la même : les stomates présents sous la feuille permettent l'entrée d'air, et donc de CO2. Celui-ci diffuse sous forme gazeuse, puis sous forme dissoute dans le milieu intérieur jusqu'aux cellules du parenchyme (C3) ou du mésophylle (C4). Là il est transformé par photosynthèse en matière organique (sucres simples) qui sont ensuite exportés vers le reste de la plante via des vaisseaux (tissus vasculaires).
Les différences concernent les proportions des différents tissus : chez les plantes en C3, le parenchyme est très développé, et l'espace vide derrière les stomates est large. Chez les plantes en C4, les cellules de la gaine, autour du vaisseau, sont grandes et entourées de cellules parenchymateuses. En revanche peu d'espace est laissé libre pour stocker de l'air (et donc du CO2).
Accumulation de CO2 par les cellules de la gaine
Alors que pour les plantes en C3 la fixation du CO2 et la fabrication du sucre sont réalisées dans la même cellule de parenchyme, pour les plantes en C4 il s'agit de deux étapes distinctes réalisées dans deux cellules différentes. Dans les cellules du parenchyme, le CO2 est fixé ce qui produit de l'oxaloacétate, qui est converti en malate et exporté. Dans les cellules de la gaine, le malate libère du CO2 qui est utilisé par la rubisco pour fabriquer du sucre en C3. Ceci permet d'accumuler localement du CO2 dans les cellules de la gaine. En théorie, tout le CO2 accumulé est destiné à faire du sucre, il ne devrait donc pas y avoir de fractionnement à cette étape (diffusion retour du CO2 vers le parenchyme quasi-nulle). En pratique, un peu de CO2 arrive à "s'échapper" d'où un léger fractionnement par la rubisco.
Photorespiration et aridité
La rubisco est également capable de fixer du dioxygène sur le ribulose 1,5-biphosphate. Dans ce cas, on obtient du glycolate dont une partie est recyclée par la cellule, et l’autre perdue sous forme de CO2. Cette réaction consomme de l'énergie (de l'ATP) et ne produit pas de sucre. En fait, elle détruit même des sucres initialement présents dans la cellule (les C5). Dans le cadre de la photosynthèse, cette photorespiration apparaît donc contre-productive. Elle pourrait cependant avoir un rôle physiologique important (métabolisme azoté, lutte contre la photoinhibition).
La photorespiration devient particulièrement problématique dans les environnements chauds et secs pour deux raisons :
- d'une part, à haute température (>30°C), l'affinité de la rubisco pour l'oxygène devient supérieure à son affinité pour le CO2 ce qui accroît la photorespiration ;
- d'autre part, en région sèche, les plantes ferment leur stomates en cours de journée de manière à réduire leurs pertes d'eau par évaporation. S'il s'agit de plantes en C3, elles vont consommer pour la photosynthèse le CO2 présent dans l'air qu'elles ont stocké (derrière les stomates) et sa concentration va alors chuter, pendant que la concentration en O2 augmente. Or une augmentation de la concentration en O2 va favoriser son utilisation par la rubisco aux dépens du CO2 et donc accroître la photorespiration.
Les plantes en C4 sont capables de réduire drastiquement les pertes d'énergie par photorespiration. En effet, le CO2 n'est pas stocké dans la chambre stomatique, mais dans les cellules de la gaine, normalement imperméables. Dans ces cellules il s'accumule, et sa forte concentration favorise alors son utilisation par la rubisco. Dans les régions arides, où il est nécessaire de fermer fréquemment les stomates pour éviter les pertes d'eau, les plantes en C4 bénéficient donc d'un avantage net par rapport à leurs consœurs en C3. Ce type de séparation/accumulation a d'ailleurs évolué indépendamment dans plusieurs groupes soumis à des conditions climatiques similaires (stress hydrique).
Conclusion
Pourquoi ces plantes qui ont réussi à se "débarrasser" de la photorespiration ne se sont-elles pas imposées partout ? A priori, cet avantage devrait exister aussi en région humide. Mais il ne faut pas oublier que la double fixation du CO2 (par la PEP-carboxylase, puis par la rubisco) consomme deux fois de l'énergie sous forme d'ATP. C'est donc un mode de fixation énergétiquement coûteux, qui n'est pas privilégié dans les régions humides, pour lesquelles le CO2 est disponible en permanence.
Cas des CAM
Pour les plantes de type CAM (Crassulacean Acid Metabolism) il y a, comme pour les plantes en C4, séparation entre l'accumulation de CO2 et son utilisation dans le cycle de Calvin, mais la séparation est ici temporelle : accumulation de malate la nuit, quand il fait moins chaud et que les stomates sont ouverts, décarboxylation du malate et fonctionnement du cycle de Calvin le jour. Ce fonctionnement est variable selon les plantes et, pour une même plante, selon les conditions environnementales (chaleur, humidité, ouverture des stomates possibles de jour ou pas...). Le δ13C mesuré pour les plantes de type CAM couvre de ce fait une gamme allant de -14 à -33‰.
Outre l'intérêt biologique de l'assimilation du CO2 par des mécanismes de type C3 ou C4, le résultat est important car il marque isotopiquement non seulement les plantes selon le mécanisme mis en jeu (d'où une indication écologique sur le milieu), mais aussi toute la chaîne trophique basée sur ces plantes. Les herbivores et les carnivores qui se nourrissent des ces derniers sont eux aussi plus ou moins "appauvris" en 13C par rapport au CO2 l'atmosphérique selon le type (C3 ou C4) des plantes présentes dans leur environnement. Pour les fossiles, la mesure du δ13C des plantes et animaux, et sa variation éventuelle au cours du temps, est donc un outil indirect pour l'étude des caractéristiques environnementales et des évolutions climatiques (aridité/humidité, température...).
Avec l'aimable relecture de Déborah Prévot (préparation à l'agrégation SV-STU à l'ENS de Lyon).
Bibliographie
R. Bear, D. Rintoul, 2014. Photosynthetic Pathways, OpenStax CNX
M.M. Bender, 1971. Variations in the 13C/12C ratios of plants in relation to the pathway of photosynthetic carbon dioxide fixation, Phytochemistry, 10, 6, 1239-1244
M.M. Bender, 1973. 13C/12C Ratio Changes in Crassulacean Acid Metabolism Plants, Plant Physiology, 52, 5, 427-430
G. Farquhar, K.T. Hubick, A.G. Condon, R.A. Richards, 1989. Carbon isotope fractionation and plant water-use efficiency, Stable isotopes in ecological research, 68, 21-40
M. O'Leary, 1988. Carbon isotopes in photosynthesis, BioScience, 38, 5, 328-336 [pdf]
B.N. Smith, S. Epstein, 1971. Two categories of 13C/12C ratios for higher plants, Plant Physiology, 47, 380-384
Wikipedia, consulté 25 nov. 2014, C4 carbon fixation