Article | 09/05/2001
Cristallisation d'un corps pur : le soufre, aspect cinétique de la cristallisation
09/05/2001
Résumé
Expériences sur la cristallisation du soufre montrant l'influence de la vitesse de refroidissement sur la taille des cristaux.
Table des matières
Introduction
Le soufre est un corps simple, peu onéreux, que l'on peut se procurer facilement. Il permet de nombreuses manipulations sur le thème du magmatisme et du métamorphisme. À la pression atmosphérique, le soufre fond vers 115°C, température aisément accessible avec un bec Bunsen, un camping gaz ou une plaque chauffante. Ce soufre cristallise alors par simple refroidissement et on peut étudier ainsi la cinétique de la cristallisation.
Attention. Cette expérience présente la cristallisation d'un corps pur sous l'aspect cinétique. Ce n'est en aucun cas une analogie de la cristallisation d'un magma. La différence est fondamentale puisque la notion de cristallisation fractionnée et donc de fractionnement chimique entre magma et minéraux cristallisés, base de la diversification des roches magmatiques, n'est pas abordée.
Obtenir de "gros cristaux" en laissant se refroidir lentement
On chauffe et fond dans un creuset du soufre. Le creuset doit être assez profond pour que l'on ait au moins 2 cm d'épaisseur de soufre fondu. Pendant le chauffage, il se peut que le soufre s'enflamme. Ce n'est pas dangereux (les vignerons font cela dans leur tonneaux), mais cela sent mauvais. Prévoir donc un couvercle pour fermer le creuset en cas d'inflammation et priver le soufre de son alimentation en O2 ; la combustion s'arrêtera.
Quand le soufre est bien fondu, laisser refroidir. Au bout de quelques minutes, un voile, puis une croûte solide se forme à la surface du liquide ; on voit que cette croûte consiste en aiguilles, que l'on voit croître à l'œil nu. Quand la croûte est complètement formée, on la brise avec un agitateur, et on verse à l'extérieur, sur un carreau de faïence froid par exemple, le soufre resté liquide sous la croûte. Dans le creuset, on voit alors de superbes aiguilles (jusqu'à 1 cm de long) de soufre partant des parois.
Figure 1. Creuset contenant le soufre cristallisé | |
Figure 3. Gros plan sur ces aiguilles de soufre | |
Le soufre renversé sur le carreau froid cristallise rapidement, beaucoup plus rapidement que dans le creuset. Et il faut une loupe pour voir des petits cristaux formés sur la flaque s'étant rapidement refroidie. On montre ainsi l'influence de la vitesse de refroidissement et de cristallisation sur la taille des cristaux.
Source - © 2001 Pierre Thomas / Planet-Terre - ENS de Lyon
Cristallisation du soufre.
Première expérience du film, de 18s à 2min20s environ.
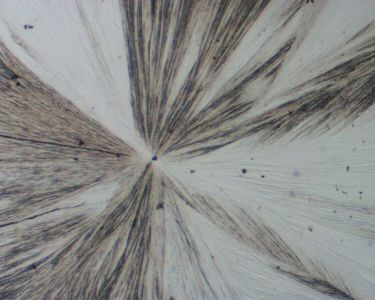
Obtenir et même voir se former des cristaux entre lame et lamelle
Si on dépose entre lame et lamelle (chauffées sur plaque chauffante) une goutte de soufre fondu, et que l'on porte rapidement (sans lui laisser le temps de se refroidir) cette lame sous microscope (polarisant), on voit apparaître de très belles aiguilles de soufre cristallisé. Si au lieu de laisser le soufre refroidir "lentement", on plonge dans l'eau glacée notre lame, les cristaux formés seront plus petits.
Influence de la vitesse de refroidissement
On verse sur un carreau de faïence bien froid une grande quantité de soufre fondu qui s'étale en" flaque", et qui cristallise assez rapidement. Les bords de la flaques solidifiés sont constitués de tout petits cristaux ; le centre de la flaque, refroidi plus lentement à cause de sa position, montre des cristaux beaucoup plus gros. Une observation à la loupe, ou mieux à la loupe binoculaire d'une flaque solidifiée ou d'un fragment de flaque montre magnifiquement cette différence.