Article | 24/01/2011
De l'eau à haute pression dans une presse à enclumes de diamant et de la glace à température ambiante, analogies avec le magmatisme et le métamorphisme
24/01/2011
Résumé
Diagramme de phases de l'eau : changements d'état, métamorphisme, habitabilité et magmatisme.
Table des matières
L'observation de changements d'état à haute pression nécessite l'utilisation de matériel spécifique rare dans les lycées mais présent à l'ENS de Lyon au sein du Laboratoire de Géologie de Lyon - Terre, Planètes, Environnements. À partir d'une séance filmée d'une heure, 3 extraits de séquences démonstratives sont ici présentés.
Diagrammes de phases de l'eau
Le diagramme de phase de l'eau est étudié au lycée, en particulier pour discuter de la présence ou non d'eau liquide sur les différents corps du système solaire. Il montre l'eau liquide, la vapeur d'eau et la glace. On reste dans un domaine restreint de T et P autour des conditions moyennes à la surface de la Terre et des planètes. Le point triple de l'eau y est généralement présenté, parfois aussi le point critique.
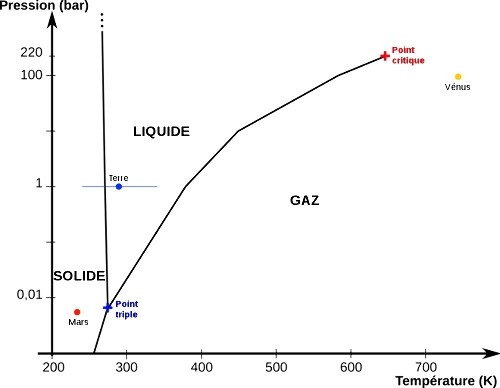
Figure 1. Diagramme de phases de l'eau à (relativement) basse pression
À basse pression (< 250 bar), l'eau existe sous trois états : solide (glace), liquide et gaz (vapeur d'eau).
Le point triple (croix bleue) correspond à la coexistence des 3 états de l'eau, Tt=273,16 K, Pt=611 Pa=0,00611 bar.
Au-delà du point critique (croix rouge), T>647,3 K et P>22,11 MPa (221,1 bar), les états liquide et gaz ne sont pas discernables, on parle de phase fluide ou d'eau supercritique.
Les conditions moyennes de surface de 3 planètes du système solaire sont représentées par des disques de couleur : Vénus (orange), Mars (rouge) et la Terre (bleu). Pour la Terre, la barre horizontale indique une plage de températures extrêmes allant de -50°C à +50°C.
À "pression atmosphérique" (1013 hPa = 1,013 bar ~ 1 bar), l'eau est à l'état liquide entre 0°C et 100°C (définition des deux points de référence de l'échelle Celsius), à l'état solide en deçà, à l'état gazeux au-delà.
On pourrait penser à une erreur puisqu'on remarque que, sur Terre, on n'atteint pas l'état gazeux en surface d'après le diagramme, même à +50°C. En effet, il faut atteindre 100°C, à 1 bar, pour passer à l'état gazeux. Cette température, température d'ébullition, indique en fait la température maximale que peut atteindre l'eau à l'état liquide sous une pression de 1 bar, toute énergie supplémentaire apportée à l'eau liquide est ensuite intégralement utilisée pour le passage à l'état gazeux (chaleur latente de vaporisation). Cependant, chacun a pu constater que le linge mouillé sèche (à l'air ou en machine,) ou que de l'eau laissée dans une coupelle "disparaît", bien en-deçà de 100°C. De même les océans et surfaces d'eau libres, sources de la vapeur d'eau atmosphérique, ne bouillent pas non plus. L'air peut en effet contenir de la vapeur d'eau jusqu'à un seuil appelé pression de vapeur saturante, soit, pour 1 bar, environ 1,2% à 10°C, 2,3% à 20°C et 4,2% à 30°C. D'ailleurs, lorsqu'on annonce une humidité (relative) de l'air de 90%, cela ne signifie pas que l'air est composé à 90% d'eau, mais que l'air contient de la vapeur d'eau à hauteur de 90% de la pression de vapeur saturante.
Grâce à la cellule à enclumes de diamant, on peut explorer aisément le domaine des hautes pressions. Le diagramme de phases de l'eau s'enrichit alors de phases nouvelles car l'état solide de l'eau comprend plusieurs phases cristallines. Parmi les différentes formes de glace, la seule forme présente à la surface de la Terre est appelée glace I.
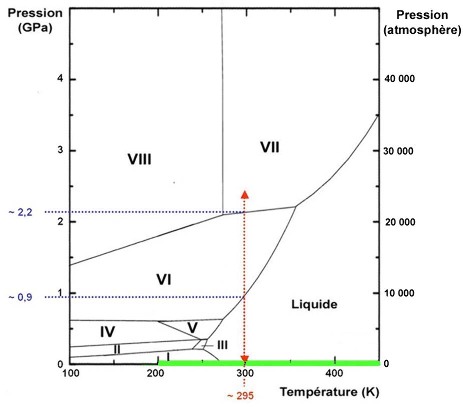
Figure 2. Diagramme de phases de l'eau à haute pression
Du fait du changement d'échelle important, le domaine "basse pression" du diagramme précédent (présent dans les manuels de classe de seconde) est contenu dans la barre verte en bas et à droite de ce diagramme.
Le trait orangé indique l'extension des trajets explorés lors de la séance dont sont tirés les films présentés dans cet article. Deux changements de phase sont "traversés", à 0,9 GPa (liquide - glace VI) et 2,2 GPa (glace VI - glace VII).
Réfléchissez sur des diagrammes de phase "vierges" : l'eau à basse pression - l'eau à haute pression.
Changements d'état de l'eau dans une presse à enclumes de diamants : les films
De l'eau a été placée dans une presse (ou cellule) à enclumes de diamants. Lors de toute la séance, le seul paramètre physique modifié fut la pression exercée sur les diamants, la température étant celle de la pièce, environ 295K (voir diagramme "haute pression" ci-dessus). La chambre d'observation a un diamètre de l'ordre de 150 µm. La caméra filme à travers les diamants selon la direction de compression.
Dans les films ci-dessous, quand des valeurs de P et T sont données, il s'agit des valeurs dans la chambre, utilisables pour se repérér dans les diagrammes de phase.
Par contre les indications "P⇗" ou "P⇘" indiquent que, respectivement, on rapproche ou éloigne les enclumes, en augmentant ou diminuant la pression exercée sur les enclumes.
Il est important de préciser que lors des changements de phase générés par modulation de la pression exercée sur les enclumes, à l'équilibre, sans variation de T, la pression dans la chambre reste constante. En effet, la variation de volume de la chambre s'accompagne d'une variation de la proportion des phases en présence. Ainsi, la diminution de volume de la cellule s'accompagne d'une augmentation de la proportion de la phase la plus compacte, le volume total d'eau est réduit, mais la pression de ces phases reste inchangée. Ceci est à comparer à l'ébullition de l'eau : quand de l'eau bout dans une casserole, l'apport d'énergie thermique supplémentaire ne fait pas augmenter la température de l'eau liquide mais favorise le changement d'état, la vaporisation de l'eau liquide.
Version téléchargeable des 3 films ci-dessous (format ogg lisible par tous les lecteurs "modernes") : fichier eau-glace-pression-ogg.zip à télécharger et décompresser.
Cristallisation - fusion de l'eau : eau liquide - glace VI
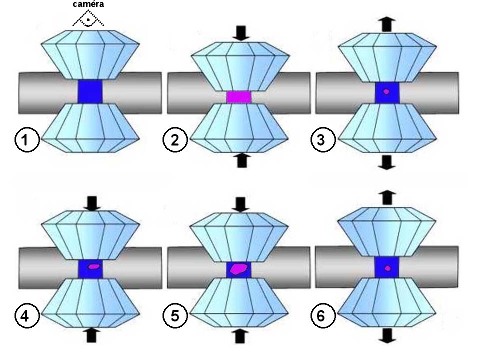
Figure 3. Cristallisation de glace VI à 295K dans une cellule à enclumes de diamant
L'observation et l'enregistrement vidéo se font à travers les diamants, selon la direction de "compression" (1).
La prise en glace initiale de l'eau liquide (en bleu) n'est pas observable du fait de l'existence d'un phénomène de surfusion. L'eau reste liquide au-delà de son domaine de stabilité puis prend en glace (en violet) instantanément (2). Après la prise en glace, on relâche la pression afin de revenir à la coexistence glace-liquide et de garder un petit cristal de glace résiduel (3) pour commencer la séance d'observation (3 à 6...).
Schéma : Pierre Thomas, inspiré de Philippe Gillet
Source - © 2011 ENS de Lyon
Source - © 2011 ENS de Lyon
Version téléchargeable des films (au format ogg) : eau-glace-pression-ogg.zip à décompresser.
Dans ce premier film, à une pression de l'ordre de 0,9 GPa (soit environ 9000 atm), on observe l'alternance croissance - fusion d'un cristal de glace VI dans de l'eau liquide.
On remarque que lors de la cristallisation du cristal de glace dans l'eau, ce cristal est automorphe. Il croît selon les axes de son système cristallin, sa forme macroscopique reflète alors rapidement l'agencement microscopique.
Lors des phases de fusion, un volume de glace fond d'autant plus vite qu'il est au contact d'une plus grande surface d'eau liquide. Les points les plus "exposés" sont donc les "pointes". La fusion entraîne un arrondissement du cristal résiduel, forme pour laquelle les points de surface du cristal "voient" tous la même quantité d'eau liquide.
Ce phénomène peut être rapproché de l'érosion de blocs transportés, par exemple, dans un torrent, blocs dont les points les plus "exposés" aux chocs sont aussi les "pointes", les bordures anguleuses, de telle sorte que l'on passe de blocs initiaux possiblement anguleux à des galets de plus en plus arrondis au fur et à mesure du transport et des chocs associés.
Densité de la glace VI par rapport à l'eau liquide
Source - © 2011 Planet-Terre - ENS de Lyon
Source - © 2011 ENS de Lyon
Version téléchargeable des films (au format ogg) : eau-glace-pression-ogg.zip à décompresser.
Dans ce deuxième film, un cristal de glace VI s'est formé en partie basse de la chambre. On retourne, à la main, la cellule et l'on observe, lorsque le cristal n'adhère plus aux bordures, que le glaçon tombe au fond de la cellule. La glace VI est donc plus dense que l'eau liquide.
Nous sommes habitués à la glace I, moins dense que l'eau liquide et qui flotte. Mais cette glace I est une exception montrant un solide moins dense que sa phase liquide correspondante. Cette propriété n'est partagée que par très pue de corps pur (bismuth) ou mélanges (fonte, magmas acides riches en eau). Cette particularité se lit sur le diagramme de phases de l'eau : la pente de Clapeyron limitant eau liquide et glace I est "inversée" par rapport aux limites entre les autres phases (seule la limite glace IV - glace V montre aussi cette particularité). La thermodynamique impose qu'à température donnée, la phase de plus haute pression est toujours la plus dense. On observe bien, sur le diagramme de phases de l'eau, que l'on passe de la glace I à l'eau liquide en augmentant la pression : l'eau liquide est bien la phase de "haute pression", la plus dense. Le fait que la glace fonde lorsqu'on augmente la pression est souvent rappelé au travers de l'exemple du patineur. Un patineur glisse non pas sur la glace mais sur un fin film d'eau liquide généré par la surpression sous la lame des patins, film liquide qui regèle derrière le patineur.
Cette manipulation a été réalisée par d'autres (service ICAP, Univ. Lyon 1) avec, au départ, de nombreux cristaux de glace. Le mur de glaçons qui s'effondre est très parlant.
Source - © 2011 ICAP / Univ. Lyon 1
Source - © 2011 ICAP / Univ. Lyon 1
Eau liquide, glace VI, glace VII : métamorphisme lié à la pression
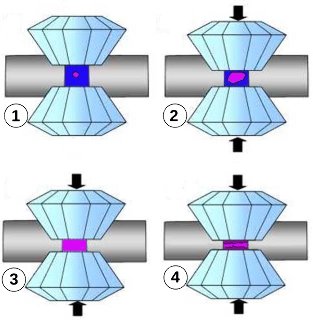
Figure 4. Métamorphisme des glaces de haute pression, à 295K dans une cellule à enclumes de diamant
Partant toujours d'un germe de glace VI (en violet clair) (1), on pousse la manipulation (2) jusqu'à avoir la chambre entièrement remplie de glace VI (3) avant de comprimer cette dernière et d'atteindre la formation de glace VII (en violet foncé) (4), au-delà de 2,2 GPa.
Schéma : Pierre Thomas, inspiré de Philippe Gillet
Source - © 2011 Planet-Terre - ENS de Lyon
Source - © 2011 ENS de Lyon
Version téléchargeable des films (au format ogg) : eau-glace-pression-ogg.zip à décompresser.
Ce troisième film permet d'observer, toujours à T constante, le passage de l'eau liquide à la glace VI à 0,9 GPa avec, ici, la transformation complète de l'eau de la chambre en glace VI. Ensuite, la pression passe de 0,9 à 2,2 GPa. À 2,2 GPa, apparaît de la glace VII qui se développe peu à peu aux dépens de la glace VI lorsqu'on rapproche encore les deux enclumes. La chambre est ensuite complètement à l'état de glace VII. Lors du processus de décompression, on voit la glace VI réapparaître et remplacer la glace VII. La rapidité de la décompression, en fin d'expérimentation explique le passage très rapide de l'état glace VI + glace VII à l'état eau liquide, avec un bref passage glace(s) + eau liquide.
Ce film montre un phénomène dont parlent beaucoup les géologues mais qu'on voit très rarement se développer en vrai, à une vitesse perceptible à l'œil. En effet, on observe la transformation à l'état solide d'une phase cristalline en une autre phase cristalline... soit la définition d'une réaction de métamorphisme, induite ici par la seule variation des conditions de pression.
On remarque que la transformation solide-solide, par exemple glace VI remplaçant la glace VII, ne montre pas la formation de cristaux automorphes, contrairement à la croissance de la glace VI dans l'eau liquide. Ici, le système cristallin n'est plus le guide principal de croissance, nous sommes en présence de deux phases solides aux propriétés physiques proches (viscosité...).
L'initiation de la nouvelle phase se fait par les bordures. Il faut un point d'initiation, les bordures de la chambre présentent des aspérités qui sont autant de points de départ potentiels à la nucléation de la nouvelle phase cristalline. Sans aspérités, "défauts", "impuretés", "chocs" une phase peut rester dans un état de métastabilité, c'est-à-dire perdurer, jusqu'à un certain point, au-delà de ses conditions de stabilité thermodynamiques. Ici les aspérités des bordures assurent le rôle de point de nucléation pour ces phases solides.
On peut aussi rappeler que, lors de la phase de décompression, il y a fusion totale de la glace à température constante, comme dans le premier film.
Les glaces de haute pression dans le système solaire
L'eau est une molécule très présente dans le système solaire. Bien que les phases de haute pression (HP) de la glace d'H2O n'existent pas à l'état naturel sur Terre, ces phases ne sont pas que des curiosités de laboratoire. Les glaces HP sont présentes dans le système solaire en quantité plus importante que la glace dite « normale » (glace I, de basse pression).
La Terre et Mars
À la surface de la Terre, l'eau existe sous forme gazeuse, liquide et solide. L'eau solide n'est présente que sous forme de glace de basse pression (glace I). Pour qu'un océan terrestre gèle à sa base, c'est-à-dire atteigne 0,9GPa à 295K (comme dans l'expérience filmée), il faudrait qu'il ait une profondeur de 90 km, ou de manière plus "réaliste" seulement 60 km et 0,6 GPa pour une eau 0°C en profondeur. On en est encore très loin avec seulement 11 km dans les fosses océaniques les plus profondes. À l'intérieur de la Terre, l'eau existe (dans des interstices, des fractures,…) sous forme liquide et supercritique.
À la surface de Mars, l'eau n'existe que sous forme de glace de BP et de vapeur. En profondeur, elle doit elle exister (dans des interstices, des fractures,…) sous forme liquide et supercritique.
Les planètes géantes
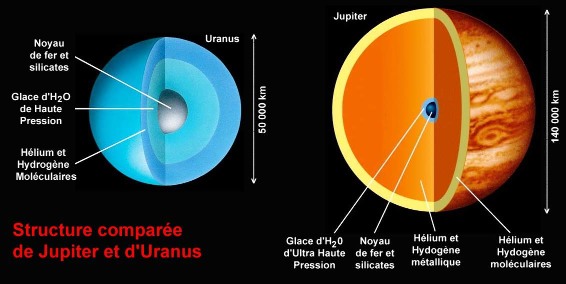
Les quatre planètes géantes du système solaire sont bâties selon le même « modèle » : une importante enveloppe d'hydrogène (H) et d'hélium (He) surmontant un « cœur » solide d'une masse égale à plusieurs fois la masse de la Terre. Hydrogène et hélium représentent plus de 95% de la masse totale de Jupiter et de Saturne, nettement moins dans le cas d'Uranus et de Neptune. Du fait de la très haute pression, l'hydrogène existe sous une phase « métallique » dans les profondeurs de Jupiter et de Saturne. Le cœur interne de ces planètes comprend, de l'extérieur vers l'intérieur, une couche d'H2O, une couche de silicates et enfin un centre de fer. Cette couche d'H2O est soumise à des pressions très élevées et est très vraisemblablement sous forme de glaces de haute pression. Notons qu'au centre de ces planètes, la pression est largement supérieure à ce que peuvent atteindre les cellules à enclumes de diamant et les propriétés physiques de l'eau sous ces conditions extrêmes ne sont pas encore connues expérimentalement.
Figure 5. Modèles de structure interne de Jupiter et d'Uranus (échelles différentes)
De grandes quantités de glaces HP (plusieurs fois la masse de la Terre) doivent exister au cœur de ces planètes. La structure interne de Saturne est voisine de cette de Jupiter, celle de Neptune est voisine de celle d'Uranus.
Modifications d'après : Northern Arizona Astrobiology Club , cours 16 et 17 de Dave Koerner
Les « gros » satellites de glace des planètes géantes
Autour des planètes géantes (Jupiter, Saturne, Uranus et Neptune) il existe quatre « gros » satellites (diamètre > 3000 km) constitués de plus de 50% d'H2O : Callisto, Ganymède, Titan et Triton. Cette eau constitue vraisemblablement une couche externe de plusieurs centaines de kilomètres d'épaisseur, reposant sur un noyau central de silicates et de fer. L'eau de surface est en glace de BP, vu la température extérieure inférieure à -150°C. Mais la production de chaleur interne (par la radioactivité naturelle et par les marées) induit un degré géothermique, et les modèles thermiques montrent que la température de fusion est sans doute atteinte vers 100 à 200 km de profondeur. De plus, ces satellites ont une masse et une gravité non négligeables. Cette gravité entraîne une augmentation de pression avec la profondeur, et l'eau devient glace de HP vers 400 km de profondeur. Il doit donc exister dans ces quatre satellites un océan d'eau liquide pris en sandwich entre une couche de glace de BP et une couche de glace(s) de HP.
Source - © 2010 NASA / JPL - NASA / Michael Carroll
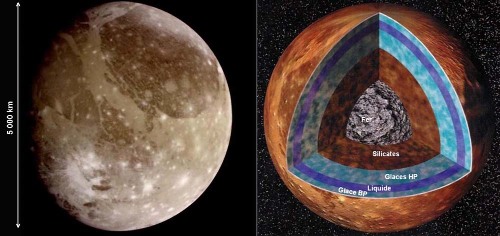
Callisto, Titan et Triton auraient des structures internes voisines de celle de Ganymède dans leurs grandes lignes, bien qu'en différant par certains aspects. Ces satellites seraient constitués d'un noyau rocheux et ferreux, surmonté d'un manteau d'eau. Les modélisations thermiques et les observations suggèrent qu'il existe une couche d'eau liquide (d'une centaine de km d'épaisseur) prise en sandwich entre 2 couches de glaces, glace de BP en haut et glace(s) de HP en bas.
Les « petits » satellites de glace des planètes géantes et les comètes
Autour des planètes géantes, il existe 10 satellites de taille moyenne (entre 400 et 1500 km de diamètre) principalement constitués de glace, et un nombre indéterminé de « petits » satellites (diamètre < 200 km), tous trop petits et trop froids pour contenir de l'eau liquide. Ils ne sont constitués que de glace de BP, avec un peu de glace de HP tout au centre des deux plus gros d'entre eux (Japet et Rhéa). Les comètes ne sont constituées que de glace de basse pression.
Europe et Encelade
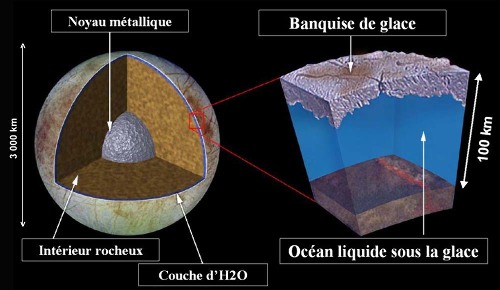
Jupiter possède un gros satellite, Europe, d'un diamètre de 3126 km, principalement constitué de fer et de silicates, mais recouvert d'une couche d'eau d'une centaine de kilomètres d'épaisseur. Cette eau est bien sûr sous forme de glace de BP en surface (la température externe est inférieure à -150°C), mais tout laisse à penser que cette glace forme une banquise assez mince, d'environ 10 km d'épaisseur, surmontant un océan d'eau liquide. La gravité d'Europe est voisine de celle de Ganymède, Callisto, Titan et Triton, et l'eau devrait être sous forme de glace de HP vers 300-400 km de profondeur. Mais l'océan d'Europe n'atteint pas cette profondeur, la transition de phase eau liquide - glace(s) de HP n'est donc pas atteinte. L'océan reste donc liquide jusqu'à sa base, au contact des silicates.
Source - © 1999 NASA / JPL
Figure 7. Vue externe et structure interne probable d'Europe, un des quatre « gros » satellites de Jupiter
Sur ce schéma proposé par la NASA (et aux légendes traduites), on voit l'importance de l'océan liquide, au contact du manteau silicaté et recouvert d'une « mince » banquise de glace. Les dessinateurs de la NASA ont même figuré une zone allongée rouge à l'interface manteau/océan, indiquant par là l'existence probable d'un intense volcanisme sous-marin. L'océan a une profondeur trop faible pour que la pression à sa base permette l'existence de glaces de haute pression.
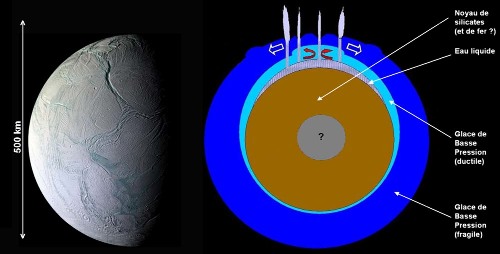
Il existe aussi un « petit » satellite de Saturne, Encelade, d'un diamètre de 500 km, composé de plus de 50% d'eau, mais avec une importante production d'énergie interne (marées). Cette production de chaleur entraîne la fusion de la base de la couche de glace. La gravité de ce petit satellite est très largement insuffisante pour entraîner de fortes pressions internes, il n'existe donc pas de couche de glaces de haute pression à la base de la couche d'eau liquide, qui est donc en contact avec les silicates.
Source - © 1999 NASA / JPL/Space Science Institute - Pierre Thomas
Figure 8. Vue externe et structure interne probable d'Encelade, le plus actif des satellites de Saturne
La très faible gravité de ce satellite (due à sa petite masse) ne permet pas l'existence de glaces de haute pression.
L'eau liquide, les glaces de haute pression et la vie
La vie, pour exister, a besoin d'eau liquide et d'énergie, cette énergie pouvant provenir de la lumière solaire ou de réactions chimiques entre eau liquide et silicates. Il existe vraisemblablement 8 corps dans le système solaire avec de l'eau liquide en surface (Terre) ou en profondeur (Mars, Ganymède, Callisto, Europe, Titan, Encelade et Triton). Pour quatre de ces huit corps (Ganymède, Callisto, Titan et Triton) la présence d'une couche de glace de haute pression sépare l'eau liquide des silicates. Les phases HP de la glace, en interdisant les contacts et les réactions eau liquide - silicates, ont ainsi peut-être diminué de moitié les possibilités de vie dans le système solaire, l'énergie lumineuse ne pouvant atteindre ces océans des profondeurs !
Changements d'état dus aux variations de pression : retour à la géologie terrestre
Dans la nature, les variations de pression sont presque exclusivement liées à des variations de la profondeur (les "pressions" tectoniques parfois évoquées sont négligeables par rapport à la pression lithostatique). Quatre transformations ont été observées pour l'eau dans une cellule à enclumes de diamant : deux concernent le magmatisme (fusion par décompression, cristallisation par compression) et deux concernent le métamorphisme (prograde et rétrograde). Parmi elles, 3 ont des analogies terrestres et sont exploitables avec des élèves.
Analogie avec le magmatisme
La cristallisation par compression n'a pas d'analogue en magmatisme. En effet, on ne connaît quasiment pas de contexte de cristallisation d'un magma par enfouissement. Il faudrait imaginer, par exemple, un réservoir magmatique interne à une lithosphère subductante, ce qui n'est pas un cas fréquent. Cependant, cette transformation liquide --> solide est importante car elle rappelle le rôle important de la pression pour maintenir un corps à l'état solide, même à haute température. Ceci explique, par exemple, que le manteau silicaté terrestre mais aussi la graine, partie centrale du noyau, sont solides, malgré les conditions de haute température qui y règnent.
La formation de magma par fusion partielle de matériel silicaté a « intellectuellement » trois causes principales.
- La fusion par apport de chaleur et augmentation de température est la première cause de fusion qui vient à l'esprit. Cela existe dans la nature, mais c'est un cas somme toute assez rare. Cette origine de la fusion existe par exemple dans le cas d'empilements de croûtes continentales riches en éléments radio-actifs (U, Th, K) dont la désintégration apporte de la chaleur qui peut s'accumuler avec le temps, ou bien lors de l'advection de matériel chaud, comme l'arrivée d'un magma basaltique dans un granite (ou une croûte continentale).
- La fusion d'un matériau terrestre peut découler de l'ajout d'un fondant, à conditions de P et T stables, qui modifie chimiquement le système et décale les courbes de liquidus et solidus. Par exemple, la déshydratation de la plaque plongeante en contexte de subdcution apporte de l'eau, ou plutôt une solution aqueuse, qui hydrate le matériel mantellique sus-jacent. Cette hydratation est à l'origine du magmatisme d'arc volcanique.
- La fusion par décompression est, de loin, la plus importante en terme de quantité de magma engendré. En effet, la fusion par décompression explique la fusion partielle du manteau remontant à l'axe des dorsales ou à l'aplomb des points chauds. C'est aussi le cas du magmatisme (granitique) lié à la fusion partielle de la croûte continentale où la migmatitisation-fusion partielle est liée à l'amincissement crustal continental lors de la relaxation des chaînes de montagnes.
Analogie avec le métamorphisme
Les réactions de métamorphisme sont liées à des variations de P et T, mais les différentes réactions sont gouvernées tantôt par la pression, tantôt par la T ou nécessitent une variation conjointe des 2 paramètres. Par exemple, la passage d'une amphibolite à une éclogite, et vice-versa, ne peut pas se faire par la seule variation de la température, alors que l'enfouissement (augmentation de pression) d'une amphibolite l'entraîne dans le domaine des éclogites et que l'exhumation d'une éclogite (diminution de pression) peut l'entraîner, selon sa température, dans le domaine des amphibolites. De nombreuses réactions métamorphiques très baro-dépendantes (dépendante de la pression) n'impliquent que 2 phases, et la transition glace VI - glace VII en est un bon analogue. Citons les transitions andalousite - disthène, quartz - coesite, graphite - diamant...