Article | 01/04/2011
De l'eau en ébullition dans une bouteille à basse température et basse pression : manipulation simple, geysers et autres analogies géologiques
01/04/2011
Résumé
Diagramme de phases de l'eau : changements d'état, ébullition, geysers, magmatisme explosif.
Table des matières
On peut observer des changements de phase de l'eau autour de nous : solidification de l'eau dans un congélateur ou prise en glace d'une flaque d'eau l'hiver, vaporisation dans une casserole ; ainsi que les changements inverses : fusion d'un glaçon sorti du congélateur ou d'une plaque de glace suite à un radoucissement, condensation de la vapeur d'eau sur un support froid tenu au-dessus d'une casserole d'eau en ébullition. L'observation de changements d'état de l'eau à haute pression, moins classiques, nécessite l'utilisation de matériel spécifique comme une cellule à enclumes de diamant. Cependant, d'autres changements d'état de l'eau, bien que peu classiquement abordés, sont observables et reproductibles sur un coin de table avec du matériel facile à trouver : c'est le cas de la vaporisation de l'eau à basse pression et relativement basse température. À partir du film d'une séance de manipulation d'un quart d'heure, un montage de 3 minutes 30 secondes est présenté.
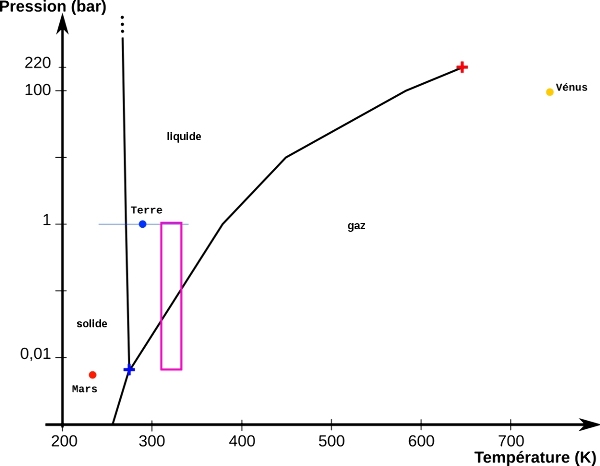
Rappel : diagramme de phases de l'eau à (relativement) basse pression
Le diagramme de phases de l'eau est étudié au lycée, en particulier pour discuter de la présence ou non d'eau liquide sur les différents corps du système solaire. Il montre l'eau liquide, la vapeur d'eau et la glace. On reste dans le domaine de T et P englobant les conditions moyennes à la surface de la Terre et des planètes du système solaire. Le point triple de l'eau et le point critique y sont visibles.
Figure 1. Diagramme de phases de l'eau à (relativement) basse pression
À basse pression (< 250 bar), l'eau existe sous trois états : solide (glace), liquide et gaz (vapeur d'eau).
Le point triple (croix bleue) correspond à la coexistence des 3 états de l'eau, Tt=273,16 K, Pt=611 Pa=0,00611 bar.
Au-delà du point critique (croix rouge), T>647,3 K et P>22,11 MPa (221,1 bar), les états liquide et gaz ne sont pas discernables, on parle de phase fluide ou d'eau supercritique.
Les conditions moyennes de surface de 3 planètes du système solaire sont représentées par des disques de couleur : Vénus (orange), Mars (rouge) et la Terre (bleu). Pour la Terre, la barre horizontale indique une plage de températures extrêmes allant de -50°C à +50°C.
À "pression atmosphérique" (1013 hPa = 1,013 bar ~ 1 bar), l'eau est à l'état liquide entre 0°C et 100°C (définition des deux points de référence de l'échelle Celsius), à l'état solide en deçà, à l'état gazeux au-delà.
On pourrait penser à une erreur puisqu'on remarque que, sur Terre, on n'atteint pas l'état gazeux en surface d'après le diagramme, même à +50°C. En effet, il faut atteindre 100°C, à 1 bar, pour passer à l'état gazeux. Cette température, température d'ébullition, indique en fait la température maximale que peut atteindre l'eau à l'état liquide sous une pression de 1 bar, toute énergie supplémentaire apportée à l'eau liquide est ensuite intégralement utilisée pour le passage à l'état gazeux (chaleur latente de vaporisation). Cependant, chacun a pu constater que le linge mouillé sèche (à l'air ou en machine,) ou que de l'eau laissée dans une coupelle "disparaît", bien en-deçà de 100°C. De même les océans et surfaces d'eau libres, sources de la vapeur d'eau atmosphérique, ne bouillent pas non plus. L'air peut en effet contenir de la vapeur d'eau jusqu'à un seuil appelé pression de vapeur saturante, soit, pour 1 bar, environ 1,2% à 10°C, 2,3% à 20°C et 4,2% à 30°C. D'ailleurs, lorsqu'on annonce une humidité (relative) de l'air de 90%, cela ne signifie pas que l'air est composé à 90% d'eau, mais que l'air contient de la vapeur d'eau à hauteur de 90% de la pression de vapeur saturante.
Le cadre violet indique le domaine "parcouru" lors de l'expérience présentée ci-après.
Réfléchissez sur un diagramme de phase "vierge" : l'eau à (relativement) basse pression.
Vaporisation de l'eau dans une bouteille, à basse pression, basse température
Le film
Source - © 2011 Pierre Thomas, Olivier Dequincey / Planet-Terre - ENS de Lyon
En cas de besoin, version téléchargeable (format ogg lisible par tous les lecteurs "modernes") : fichier eau-vapeur-pression-ogg.zip à décompresser.
L'expérience
De l'eau chaude mais non bouillante (~55°C) est versée dans une bouteille rigide et transparente, ici en verre. Un thermomètre y est glissé afin de pouvoir suivre l'évolution de la température. La bouteille est refermée à l'aide du bouchon d'un système de pompe à vide utilisé pour la conservation du vin dans sa bouteille d'origine. Ce système pompe + bouchon se trouve facilement dans le commerce à partir de 15 euros.
La première manipulation consiste à actionner la pompe à vide. L'air de la bouteille est chassé... et l'eau, toujours à ~55°C, se met à bouillir ! L'opération peut être répétée plusieurs fois.
Une fois la pompe à vide actionnée plusieurs fois, la seconde manipulation consiste à refroidir la bouteille sous l'eau froide d'un robinet. On refroidit la bouteille... et l'eau se remet à bouillir !
Les explications
Lors de la première manipulation, on fait baisser la pression dans la bouteille. Si l'on se réfère au diagramme de phases, on remarque qu'en abaissant la pression à environ 0,1bar (1/10 d'atmosphère), on passe à la phase gazeuse vers 330K (57°C). La pompe à vide à usage oenologique permet donc de créer un vide partiel de l'ordre de 0,1bar, permettant l'ébullition de l'eau aux alentours de 50°C (mais, heureusement, pas du vin à température ambiante).
À la fin de la première manipulation, plusieurs pompages ont évacué l'air initial et la phase gazeuse est de la vapeur d'eau quasiment pure, l'eau de la bouteille est aux alentours de 50°C sous une pression légèrement inférieure à 0,1bar, proche de la courbe de changement d'état. D'après le diagramme de phases, on s'éloigne de la courbe de changement d'état en abaissant la température de l'eau liquide. Or, ici, en refroidissant la bouteille, l'eau se remet à bouillir. Sous le filet d'eau froide, l'eau liquide de la bouteille se refroidit peu (forte capacité calorifique). Par contre, la vapeur d'eau qui exerce sa pression sur l'eau liquide se refroidit plus vite. Ce refroidissement de la phase gazeuse entraîne une diminution de la pression de la phase gazeuse (PV=nRT, P baisse quand T baisse) et une condensation partielle. Ces deux phénomènes baissent la pression exercée sur la phase liquide. C'est donc le refroidissement et la baisse de pression de la phase gazeuse qui explique la reprise de l'ébullition suite au refroidissement de la bouteille.
Changements d'état dus aux variations de pression : retour à la géologie terrestre
Faire bouillir de l'eau en altitude
L'ébullition de l'eau à moins de 100°C est observable si l'on mesure la température de l'eau bouillante à différentes altitudes. Un alpiniste atteignant le sommet du Mont Blanc verra son eau bouillir à environ 85°C, mais seulement 72°C s'il est au sommet de l'Everest. Il faudrait monter à environ 12km pour voir l'eau bouillir à 55°C. Sans être alpiniste chevronné, un séjour en moyenne ou haute montagne permet déjà d'observer le phénomène en se préparant une infusion ou en se faisant cuire un oeuf... En effet, le temps de cuisson pour obtenir un oeuf coque, ou plus encore un oeuf dur, doit être prolongé par rapport au temps de cuisson habituel à basse altitude puisque la température de cuisson (ébullition de l'eau) est inférieure.
Une autre "expérience" moins quotidienne. On voit sur le diagramme de phases que pour une pression légèrement supérieure à 611 Pa (pression du point triple), l'eau entre en ébullition à une température à peine supérieure 273,16 K (0,01°C, température du point triple). Un spationaute à la surface de Mars, à une pression souvent inférieure à 611 Pa et à une température moyenne de 218 K, avec une thermos d'eau à 20°C pressurisée à 1 atm, pourrait observer un phénomène étrange en ouvrant et versant l'eau. En effet, cette eau se refroidirait et gèlerait en atteignant 0,01°C (à 611 Pa), mais entre sa température initiale et sa température de solidification, à si basse pression, elle entrerait en ébullition ! Ce spationaute verrait alors l'eau versée bouillir et geler à la fois.
Changement d'état de l'eau et fonctionnement d'un geyser périodique chaud
La variation de la température d'ébullition avec la pression explique aussi le fonctionnement des geysers périodiques d'eau chaude. Imaginons une fracture ou un conduit rempli d'eau de pluie dans une région à très fort degré géothermique. À 100 m de profondeur, la pression due au poids de l'eau est de l'ordre de 10 atmosphères (P=ρgh, soit 1000 kg.m-3 x 10 m.s-2 x 100 m = 1 000 000 Pa = 10 bars ~ 10 atmosphères), soit une pression totale de 11 atmosphères avec la pression atmosphérique. À 11 atm, la température d'ébullition est d'environ 450 K (approximativement 180°C). Si la géométrie du conduit d'eau empêche une convection efficace et un refroidissement de l'eau, l'eau de la base du conduit peut se réchauffer, atteindre une température de 180°C, et se mettre à bouillir, alors qu'elle ne bout pas plus haut dans la colonne d'eau. Il se crée ainsi une première bulle de vapeur d'eau, qui va remonter, en entraînant avec elle un peu d'eau liquide à 180°C. Cette eau liquide à 180°C entraînée vers le haut voit sa pression diminuer, va se mettre à bouillir, ce qui va faire deux bulles de vapeur d'eau, qui vont entraîner vers le haut de l'eau liquide, et ainsi de suite. Une ébullition « explosive » va ainsi créer un grand volume de vapeur d'eau, qui va en remontant chasser vers le haut toute la colonne d'eau. Le geyser est ainsi entré en éruption. L'eau liquide expulsée se refroidit en surface et, en général, retourne dans le conduit et le re-remplit. La base de la colonne se réchauffe, atteint 180°C, et ainsi de suite...
On explique ainsi les jaillissements périodiques de nombreux geysers, comme ceux d'Islande ou de Yellowstone. En collectant photos personnelles de vacances, celles de ses amis, et surtout en triant parmi les centaines d'images disponibles sur le web, on arrive à reconstituer une séquence du déroulement complet d'un cycle éruptif, dans le cas du Strokkur, le plus célèbre geyser d'Islande. Voici le déroulement d'un cycle en 8 images, prises par 8 photographes différents, 8 jours différents, de 8 emplacements différents, avec 8 conditions d'éclairage et d'ensoleillement différentes, ce qui explique une certaine inhomogénéité des images.
Source - © 2011 JosipZg-CRO sur panoramio.com Figure 2. Le Strokkur (Islande) entre deux éruptions Entre 2 éruptions, le Strokkur se présente comme un bassin rempli d'eau « bleutée » du fait de sa forte concentration en silice colloïdale (cf Geysérite et eaux siliceuses, Champ hydrothermal du Tatio, Andes chiliennes, Le Lagon Bleu, Islande). L'eau est à une température élevée, mais largement inférieure à 100°C. Elle ne bout pas. | Figure 3. Le Strokkur (Islande), remontée d'une bulle bleutée La vapeur « qui monte » dans le conduit soulève l'eau liquide située au-dessus, ce qui engendre une superbe « bulle bleutée ». |
Source - © 2011 Marek Koszorek sur panoramio.com Figure 4. Le Strokkur (Islande), une bulle d'eau pleine de vapeur La vapeur arrive presque en surface mais n'a pas encore crevé la bulle. On voit néanmoins la vapeur à travers la surface de l'eau liquide. La bulle d'eau a une forme parfaite. | Source - © 2011 csgb sur panoramio.com Figure 5. Le Strokkur (Islande), la vapeur crève la bulle d'eau La vapeur crève la surface de la bulle. Il s'en échappe alors un panache de gouttelettes d'eau liquide. |
Source - © 2011 Ryan Duffy sur panoramio.com Figure 6. Le Strokkur (Islande), la vapeur crève la bulle d'eau La sortie de la vapeur pulvérise complètement la surface de la bulle d'eau en un panache de gouttelettes d'eau liquide. | Source - © 2011 Kal.R sur panoramio.com Figure 7. Le Strokkur (Islande), la vapeur monte Un panache de gouttelettes d'eau liquide s'élève. |
Source - © 2011 wombatter sur panoramio.com Figure 8. Le Strokkur (Islande), le geyser en éruption Le geyser est ici au maximum de sa hauteur de jaillissement. | Figure 9. Le Strokkur (Islande), juste après une éruption Après l'éruption, le panache s'effondre, l'eau liquide refroidie re-rentre dans le trou et un nouveau cycle va recommencer. Prochain jaillissement dans environ 8 minutes. |
Changement d'état d'une phase minoritaire : volcanisme explosif et dégazage du magma
On a déjà vu que la décompression d'un solide peut aboutir à sa fusion. Cette possible fusion par décompression explique la formation de magma lors de la remontée de matériel mantellique solide chaud. Ce magma liquide, issu de la fusion partielle du manteau, peut contenir des éléments tels que CO2, H2O (ou groupements hydroxyles). De même que la décompression du manteau permet sa fusion partielle, la décompression d'un magma permet à certains composants minoritaires d'exprimer leur affinité gazeuse. La formation de bulles de gaz (CO2, H2O, ...) n'est pas, à proprement parler une ébullition comme dans l'expérience avec l'eau (on n'a pas de vapeur de magma), on parle de dégazage du magma par diminution de la solubilité de ces composés les plus volatils. Les bulles peuvent se regrouper et remonter plus vite que le magma vers la surface. Selon la viscosité du magma, 1) ce dégazage facile entraîne en surface des éjections de lave fluide, ou alors, 2) il entraîne dans sa remontée du magma ce qui forme une "mousse" de magma pouvant former des panaches explosifs (comme l'éruption du Lascar en 1993), ou encore, 3) ne pouvant s'échapper facilement, l'accumulation de gaz provoque une (des) explosion(s) lorsque de fortes pressions sont atteintes.
Ce dégazage ne se fait qu'à basse pression, c'est-à-dire à très faible profondeur. Sous un volcan, le magma peut commencer à dégazer lorsqu'il n'est plus qu'à quelques kilomètres de la surface. Cependant, le processus n'est suffisamment développé pour permettre l'exsolution d'une quantité de gaz importante de gaz et l'accélèration (parfois forte) du transfert de magma que dans les dernières centaines de mètres de la remontée vers la surface. En effet, ce dégazage n'est en aucun cas la cause de l'ascension du magma depuis sa zone de production, à plusieurs dizaines de kilomètres de profondeur en général, jusqu'à la faible profondeur à laquelle a éventuellement lieu un dégazage.
Changement d'état d'une phase dissoute : les geysers froids
Il existe des geysers d'eau froide (ou du moins non bouillante) à activité périodique. Pour ces derniers, le mécanisme moteur n'est pas l'ébullition de l'eau mais, comme pour certains cas de volcanisme explosif, le dégazage par saturation et décompression d'une phase dissoute, le CO2. Rappelons que le CO2 est beaucoup plus soluble dans l'eau à haute pression qu'à basse pression. Replaçons nous, comme pour les geysers chauds, dans une fracture ou un conduit rempli d'eau avec une géométrie empêchant une convection efficace. Imaginons cette fois, en gardant un gradient géothermique normal, un apport en CO2 (volcanisme, échanges chimiques, dissolutions) à la base du système. L'eau va se saturer en dioxyde de carbone : tout apport supplémentaire entraîne un dégazage. Une bulle de CO2 va se former, remonter dans le conduit en entraînant dans sa remontée de l'eau saturée en CO2, eau qui en remontant voit diminuer sa pression et baisser la solubilité du CO2 et qui va donc à son tour libérer une bulle de gaz, qui repoussera l'eau sus-jacente dont la solubilité en CO2 va diminuer... jusqu'à jaillissement à la surface des bulles de gaz et d'un panache d'eau entraînée par le gaz. L'apport continu de CO2 à la base du système réalimente l'eau et le cycle recommence.
Source - © 2011 Jack Carré sur panoramio.com
Figure 10. Le geyser froid de Vals-Bains (Ardèche)
L'eau qui jaillit n'est pas bouillante, c'est tout simplement de « l'eau de Vals ». Elle jaillit dans un parc et a été aménagée pour sembler sortir d'une « mini-chaussée des géants », orgues basaltiques très fréquents dans la région.
D'autres sources du même type sont visibles en France, toujours dans le Massif Central, à Bellerive-sur-Allier (Allier) ou vers Lignat (Puy de Dôme).