Article | 18/02/2014
Vapeur d'eau à la surface de la Terre et des planètes : distinction entre ébullition et évaporation
18/02/2014
Résumé
Les changements d'état de l'eau à la surface de la Terre, vapeur d'eau dans l'atmosphère et cycle de l'eau sans ébullition.
Table des matières
- Les états de l'eau à la surface de la Terre et dans les programmes de lycée
- Diagramme de phase de l'eau et conditions terrestres de surface
- Diagramme de Clapeyron et pression de vapeur saturante
- Lien entre diagramme de Clapeyron et diagramme de phase
- Atmosphère, pression partielle et évaporation
- Informations contenues dans le diagramme de phase
- Retour sur Terre
- Références
Les états de l'eau à la surface de la Terre et dans les programmes de lycée
Les états de l'eau sont mentionnés dans le programme de SVT de la classe de seconde. L'état liquide est retenu comme critère d'habitabilité de la Terre : « Les conditions physico-chimiques qui y règnent permettent l'existence d'eau liquide... », puis l'état gazeux, comme étape du cycle de l'eau, est évoqué lors de l'étude de l'énergie solaire dont une partie « chauffe l'air [...] et l'eau [...] et évapore l'eau (ce qui permet le cycle de l'eau) ». Les manuels scolaires reprennent ce programme et proposent des activités et des documents utiles à la présentation et à l'appropriation par les élèves des connaissances exigibles. Très classiquement, et à juste titre, le diagramme de phase de l'eau est présenté pour illustrer l'existence de l'eau sur Terre sous ses 3 états classiques : solide (glace), liquide, gaz (vapeur d'eau). Cependant, en reportant dans ce diagramme les conditions P-T à la surface de la Terre, seuls les états liquide et solide sont rencontrés, il faudrait monter à 100°C, à pression atmosphérique standard pour atteindre l'état gazeux.
N'y a-t-il donc pas de vapeur d'eau à la surface de la Terre ? La buée sur les vitres ou sur les lunettes froides n'est-elle pas liée à la condensation de vapeur d'eau ? Et la pluie, ne provient-elle pas de la condensation de vapeur d'eau... à des températures bien inférieures à 100°C ?
Figure 1. Nuages au-dessus de l'océan
Les nuages sont composés de micro-gouttelettes d'eau (ou de micro-cristaux de glace dans le cas de nuage de type cirrus) formées par condensation de vapeur d'eau, elle-même issue de l'évaporation de l'eau (essentiellement) océanique. Tout ceci se passe à moins de 100°C, sans eau bouillante.
Dans les nuages, ce n'est pas la vapeur d'eau que l'on voit, mais les gouttelettes d'eau liquide (ou les cristaux de glace) car chacune d'elle diffuse la lumière (blanche) du soleil et devient alors une (micro-)source lumineuse. C'est la diffusion de la lumière par toutes ses gouttelettes qui rend visible un nuage.
Une réponse rapide, très incomplète, permet de trouver des conditions "terrestres" avec de la vapeur d'eau : vapeur d'eau émise par dégazage de magmas lors des éruptions volcaniques (on est alors à plus de 800°C) ou vaporisation de l'eau d'une nappe phréatique lors de la remontée d'un magma "chaud" (phréatomagmatisme)...
Nous allons, ici, revoir ce qu'est le diagramme de phase de l'eau et ce qu'il apporte comme enseignements. Ensuite, nous évoquerons les équilibre entre phases, puis les notions de pression de vapeur saturante et de pression partielle afin de comprendre la distinction entre ébullition et évaporation.
Diagramme de phase de l'eau et conditions terrestres de surface
Reprenons le diagramme de phase de l'eau déjà utilisé lors de l'étude de changements de phase, à basse pression (cf. De l'eau en ébullition dans une bouteille à basse température et basse pression...) et à haute pression (cf. De l'eau à haute pression dans une presse à enclumes de diamant et de la glace à température ambiante...). Voyons comment il est construit et ce que représente un point dans ce diagramme.
Dans une enceinte fermée, on place une quantité d'eau dont on peut modifier et mesurer température et pression. Le volume de l'enceinte s'adapte aux conditions voulues. Ainsi, lors d'un changement de phase, le volume de l'enceinte s'adapte, à T et P constants, aux dilatations / contractions du système (solidification de l'eau, condensation de la vapeur...). Pour tout couple (P,T), à l'équilibre, on note quel est l'état physique stable de l'eau : glace (solide), liquide ou vapeur (gaz). On s'intéresse donc, ici, à l'état physique de l'eau contenue dans un système isolé auquel on applique des contraintes de T et P.
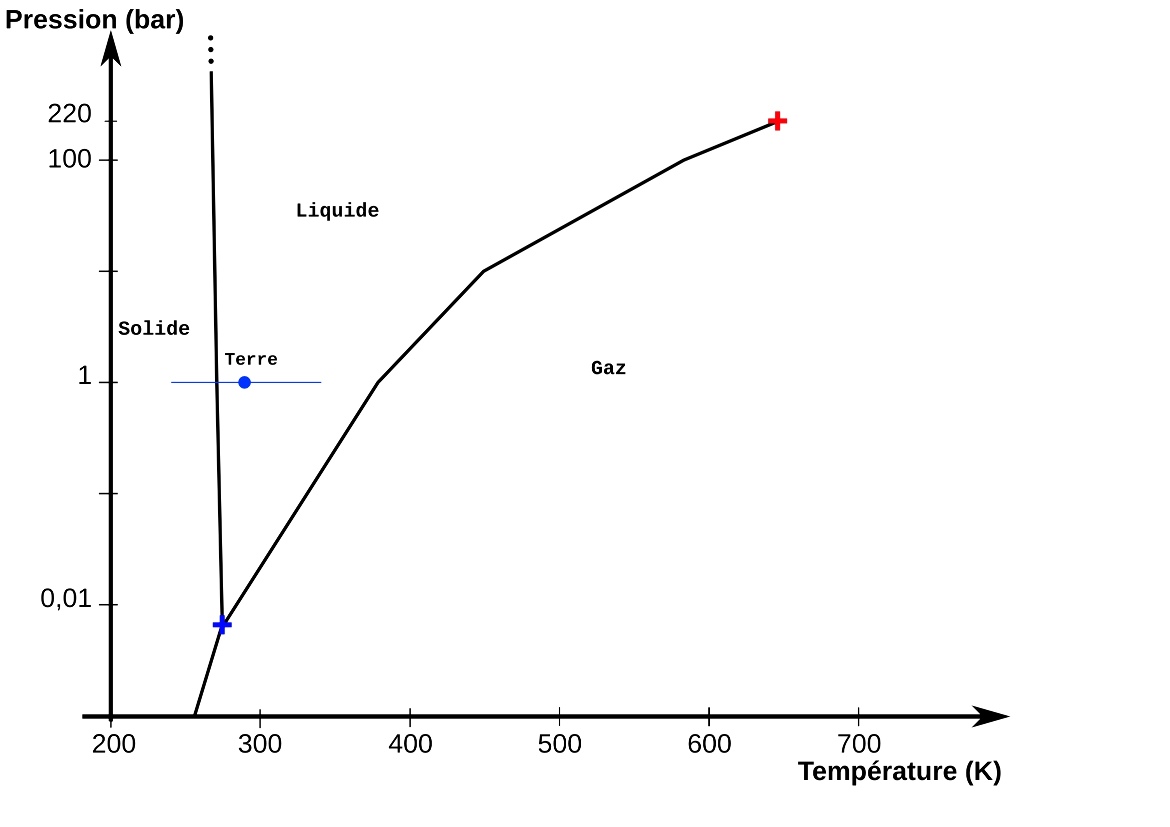
Figure 2. Diagramme de phase de l'eau à "basse pression" et conditions terrestres de surface
1 bar = 105 Pa (~1 atm).
À "basse" pression (< 220 bar), l'eau existe sous trois états classiques : solide (glace), liquide et gaz (vapeur d'eau). Le point triple (croix bleue) correspond à la coexistence des 3 états de l'eau, TTr=273,16 K (0,01°C), PTr=611 Pa (0,00611 bar). Le point critique (croix rouge) correspond au point,TC>647,3 K (3745°C) et PC>22,11 MPa (221,1 bar), au-delà duquel les états liquide et gazeux ne sont pas discernables, on parle alors de phase fluide ou supercritique (un état de la matière rarement évoqué).
À "pression ambiante" (1013 hPa = 1,013 bar ~ 1 bar), l'eau est à l'état liquide entre 273,15 K et 373,15 K (températures définissant des deux points de référence de l'échelle Celsius : 0°C et 100°C), à l'état solide en deçà de 273,15 K, à l'état gazeux au-delà de 373,15 K.
Les conditions moyennes à la surface de la Terre sont représentées par le point bleu, la ligne horizontale bleue indique une plage de températures extrêmes allant de -50°C à +50°C. Si l'on considère la troposphère (couche basse de l'atmosphère), la pression diminuant de façon exponentielle avec l'altitude, la pression chute environ de moitié à 5 km et encore de moitié lorsqu'on atteint la tropopause (vers 10-12 km d'altitude)... mais on est alors à -50/-60°C (gradient de température de l'ordre de -6°C/km)... loin de l'ébullition.
Diagramme de phase de l'eau "vierge" (sans report des conditions terrestres de surface).
L'eau est stable dans l'un des trois états solide, liquide ou gazeux selon les conditions appliquées. Deux ou 3 états peuvent coexister en des points particuliers.
Les courbes séparant les domaines de stabilité entre phases rejoignent les points pour lesquels l'eau peut exister sous deux états. Par exemple, à 0°C et 1 atm (~273 K et 1013 hPa), l'eau peut être sous forme liquide et/ou solide. La glace ne fond pas, ou le liquide ne gèle pas, si l'on se contente de maintenir P et T. À pression constante, si on continue à apporter de l'énergie (on chauffe), cette énergie est alors "consommée" à température constante par le passage solide → liquide, ensuite seulement, cet apport d'énergie élève la température de la phase liquide lorsqu'il n'y a plus de glace. De même, à pression constante, si on continue à exporter de l'énergie (on refroidit), cet export évacue, à température constante, l'énergie libérée par le passage liquide → solide, ensuite seulement, cet export abaisse la température de la phase solide lorsqu'il n'y a plus d'eau liquide.
Le point triple (T=273,16 K, P=611 Pa) est le point de coexistence possible de l'eau sous ses 3 états.
Revenons à la surface de la Terre, sous une pression "ambiante" de 1013 hPa (~1 bar). Dans la gamme des températures observables (environ de -50 à +50°C), l'eau est stable à l'état solide à 0°C et en dessous, et à l'état liquide à 0°C et au-dessus. L'état gazeux n'est donc jamais l'état stable de l'eau à la surface de la Terre d'après ce diagramme. Ceci signifie (seulement) qu'un système isolé constitué d'eau seule n'est pas stable sous forme de vapeur d'eau si on lui applique les conditions de pression et de température rencontrées à la surface de la Terre.
On peut toutefois trouver des situations "terrestres" de surface dans lesquelles l'existence d'eau sous forme de vapeur est possible d'après le diagramme de phase. Par exemple, l'eau "magmatique" qui dégaze lors d'éruptions volcaniques ou encore l'eau vaporisée lors des phénomènes de phréatomagmatisme (remontée de magma rencontrant une nappe phréatique) est sous forme de vapeur d'eau. En effet, on a bien de l'eau à 1 bar et à une température supérieure à 800°C (1073 K), donc stable à l'état gazeux. Cependant, dispersée dans l'atmosphère environnante, cette vapeur d'eau se refroidit... et retourne à l'état stable liquide d'après le diagramme de phase. Avec cette explication, l'eau à l'état gazeux existe mais ne serait qu'un état transitoire dans l'atmosphère terrestre... entre un cratère volcanique actif et les nuages ou la pluie.
Figure 3. Conduit d'évacuation d'une chaudière et vapeur d'eau à haute température
La présence d'eau dans les gaz de combustion chauds est visible sur la paroi interne du conduit sur laquelle la vapeur d'eau se condense par contact avec cette surface froide. Les gaz évacués dans l'atmosphère se refroidissent en sortant du conduit et la vapeur d'eau se condense alors progressivement en formant des micro-gouttelettes d'eau liquide. L'eau, d'abord sous forme de vapeur d'eau transparente devient visible, comme pour les nuages, lors de sa condensation : quasi-transparence des gaz évacués près de la bouche du conduit et visibilité de l'eau lors de la formation du "nuage" d'eau liquide quelques centimètres plus loin.
Cette image illustre l'existence de vapeur d'eau sous pression ambiante formant des "nuages"... mais, ici, à haute température. Seul équivalent terrestre envisageable, la formation de nuages par condensation de vapeur d'eau émise par des volcans actifs.
Stabilité thermodynamique / cinétique
À la surface de Mars (très faible pression), l'eau n'est pas stable à l'état liquide mais à l'état solide, à température moyenne, mais aussi à l'état gazeux si l'on prend en compte la gamme des températures possibles (cf. diagramme de phase et conditions de surface sur Mars dans De l'eau en ébullition dans une bouteille à basse température et basse pression...). Dans le sous-sol martien l'eau existe aussi sous forme de glace. En cas de "chauffage" de ce sous-sol superficiel englacé (été, en plein soleil, sur une pente bien exposée), il peut y avoir fusion et libération d'eau liquide (ou plutôt de saumure liquide) en profondeur du fait de la pression lithostatique. Cette saumure liquide devrait "immédiatement" se vaporiser à son arrivée en surface du fait de la chute de pression. Cependant, ce changement de phase n'est pas instantané, il faut, comme pour « refroidir le fût du canon », « un certain temps », temps suffisant pour que cette eau liquide s'écoule et forme des ravines d'extension limitée (cf. De l'eau coule-t-elle chaque été sur les pentes ensoleillées de l'hémisphère Sud de Mars ?).
La réalité sur Terre est un peu différente de la manipulation permettant de tracer le diagramme de phase. Une eau océanique de surface à 18°C (~291 K) est certes à l'état liquide, soumise à une pression d'environ 1 bar à sa surface mais elle n'est pas seulement soumise au "poids" de l'atmosphère, mais elle est aussi à son contact. L'eau n'est pas "comprimée" par un piston solide inerte mais par un mélange gazeux avec lequel des échanges / équilibres sont possibles, et au sein duquel la notion de pression est à envisager de manière particulière.
Diagramme de Clapeyron et pression de vapeur saturante
Parcourons encore les domaines de pression et de température mais cette fois-ci en changeant les paramètres de contrôle et le diagramme de représentation, tout en restant dans les domaines de stabilité des états liquide et gazeux.
On prend une enceinte fermée ne contenant que de l'eau en quantité d'eau connue. On peut modifier, mesurer et contrôler la température (système thermostaté ou manipulation "lente" permettant un rééquilibrage avec la température ambiante de la pièce) de cette enceinte. On peut aussi faire varier et mesurer le volume de l'enceinte. Dans cette manipulation, on contrôle température et volume, on mesure la pression et on observe les phases en présence. À une température donnée (modulable) et pour un volume donné, à l'équilibre, on note quel est l'état physique stable de l'eau : liquide et/ou vapeur (gaz) et quelle pression règne dans l'enceinte. On s'intéresse donc ici à l'état physique et à la pression de l'eau contenue dans un système isolé auquel on applique des contraintes de T et de volume.
L'évolution du système est représenté dans un diagramme de Clapeyron dont les coordonnées sont la pression mesurée, en ordonnées, et le volume molaire, c'est-à-dire le volume de l'enceinte divisé par le nombre de moles d'eau présentes (on pourrait aussi utiliser le volume massique), noté "u" en abscisses. On utilise, ici, non pas le volume de l'enceinte, mais le volume molaire du système afin d'utiliser une variable de volume intensive (dont la valeur ne dépend pas de la quantité de matière en jeu) permettant une comparaison directe de plusieurs manipulations.
Variable intensive, variable extensive
Dans des conditions données de pression et température, le volume dépend de la quantité de matière, c'est une variable extensive. De même, très directement, masse et nombre de moles sont des variables extensives. Par contre, pression et température sont des variables intensives : si on compare deux expériences avec de l'eau aux mêmes conditions de pression et température, cette eau sera dans le même "état" (si le volume est 2 fois plus important dans l'une d'elles c'est que l'expérience a été menée avec 2 fois plus d'eau).
Afin de pouvoir comparer directement des manipulations menées à partir de quantités différentes de matière, le volume mesuré peut être rapporté à une unité de quantité de matière. Ainsi l'évolution du volume massique (volume mesuré divisé par la masse connue d'eau) ou du volume molaire (volume mesuré rapporté au nombre de moles d'eau) ne dépend-t-elle plus de la quantité de matière totale et peut être directement comparée d'une expérience à l'autre : volume massique et volume molaire sont donc des variables intensives.
On se place dans des conditions de température et de pression pour lesquelles on peut distinguer les états liquide et gazeux, c'est-à dire, ici, entre les conditions du point triple et celles du point critique.
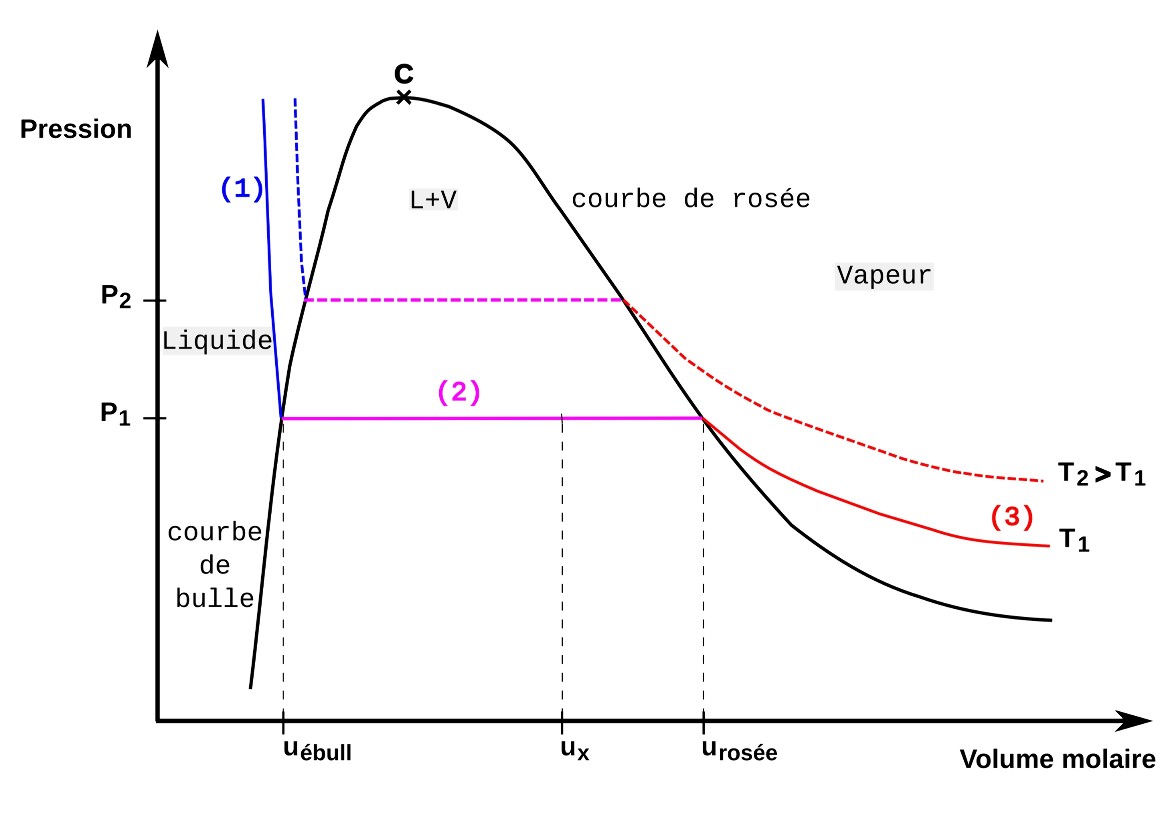
Figure 4. Parcours isotherme théorique et équilibre liquide-vapeur dans un diagramme de Clapeyron
À température constante, on augmente progressivement le volume molaire du système initialement à l'état liquide. Un parcours isotherme est constitué de 3 étapes successives.
(1) Le système liquide voit d'abord sa pression diminuer "rapidement" lors de l'augmentation de volume (étape bleue sur le diagramme).
(2) À partir d'une pression appelée pression de vapeur saturante, le système évolue un temps à pression constante entre deux points nommés point de bulle (ou d'ébullition) et point de rosée. Eau liquide et vapeur d'eau coexistent, l'eau liquide fait progressivement place à la vapeur d'eau lorsque le volume augmente (étape violette sur le diagramme).
(3) le système est à l'état gazeux et l'augmentation de volume entraîne une "lente" diminution de la pression (étape rouge sur le diagramme).
Pour une expérience menée à une température différente, on obtient une courbe "parallèle" : pour une température plus élevée, les pressions, et donc en particulier la pression de vapeur saturante, sont plus élevées à chaque étape (parcours en pointillés sur la figure). Les points de bulle forment une courbe dite d'ébullition, les points de rosée forment une courbe dite de rosée. Ces deux courbes se rejoignent au point critique C (à pression critique). Cette réunion délimite les domaines "liquide" (à gauche), "vapeur" (à droite), et "liquide + vapeur" ("sous" la courbe en "cloche").
Détermination graphique de la fraction gazeuse / liquide à pression de vapeur saturante
Lorsque liquide et vapeur coexistent, le diagramme de Clapeyron permet de déterminer les fractions de vapeur d'eau et d'eau liquide. À pression de vapeur saturante, en notant urosée et uébull les volumes molaires, respectivement, des points de rosée et de bulle, un système de volume molaire ux contient une fraction molaire gazeuse égale à (ux - uébull) / (urosée - uébull), et donc une fraction molaire liquide égale à (urosée - ux) / (urosée - uébull). On retrouve bien 100% de gaz quand ux = urosée, et 100% de liquide quand ux = uébullition.
Suivons un système maintenu à température constante (parcours isotherme) dont on fait varier le volume. En partant d'un volume faible, à l'état liquide, la courbe d'évolution suit trois étapes successives.
- Tout d'abord le système est entièrement à l'état liquide et toute augmentation du volume molaire entraîne une "forte" diminution de la pression du liquide ("incompressibilité", ou plutôt très faible compressibilité, des liquides) (étape (1), en bleu sur la figure).
- Ensuite, à partir d'un point appelé point de bulle (apparition de bulles dans le liquide) ou point d'ébullition, il y a coexistence des états liquide et gazeux à pression constante, appelée pression de vapeur saturante, alors qu'on augmente toujours le volume molaire, et ce jusqu'à un point nommé point de rosée (étape (2), en violet sur la figure). Pendant cette étape, l'augmentation de volume n'engendre plus de diminution de la pression de la phase liquide, compacte, mais une augmentation de la fraction d'eau sous forme gazeuse, moins compacte.
- Enfin, à partir du point de rosée, le système est entièrement à l'état gazeux et toute augmentation du volume molaire entraîne une "faible" diminution de la pression de la vapeur d'eau (forte compressibilité des gaz) (étape (3), en rouge sur la figure). Ce point est appelé point de rosée car, en opérant de manière inverse à partir d'un gaz dont on diminue le volume disponible, c'est le point à partir duquel les premières gouttes de liquide (de rosée) apparaissent.
Si on recommence à une température plus élevée, le système décrit alors un parcours similaire mais à pression plus élevée pour chacune des trois étapes. En particulier, donc, la pression de vapeur saturante augmente avec la température.
Si l'on relie les points d'ébullition observés aux différentes températures, on construit une courbe appelée courbe d'ébullition (ou courbe de bulle) séparant les domaines "liquide" et "liquide + gaz". De même, avec les points de rosée, on construit une courbe appelée courbe de rosée, séparant les domaines "gaz" et "liquide + gaz". Ces deux courbes se rejoignent au point critique (à pression critique) et délimitent alors un domaine "liquide" à gauche, "liquide + gaz" sous la courbe, et "gaz" à droite.
Pour un système constitué d'eau seule, à une température T1 donnée, il existe une pression P1 appelée pression de vapeur saturante pour laquelle eau liquide et vapeur d'eau coexistent à l'équilibre.
Cette pression de vapeur saturante, P1, correspond à la pression maximale d'existence d'eau sous forme vapeur à la température T1, c'est aussi la pression minimale d'existence d'eau sous forme liquide à la température T1. Autrement exprimé, P1 est la pression d'ébullition / condensation à T1, de même que T1 est la température d'ébullition / condensation à P1. Le point de coordonnées (P1, T1) est donc un point de transition de phase liquide - vapeur dans le diagramme de phase de l'eau.
Une approche visuelle pour le lycée... d'antan
La notion de pression de vapeur saturante était abordée en classe de seconde jusqu'au début des années 1970 par une expérience utilisant des tubes de Torricelli (tubes retournés sur une cuve de mercure, liquide dans les conditions ambiantes, permettant, entre autres, la mesure de la pression atmosphérique). Changements de programmes et conditions de manipulations plus drastiques ont fait disparaître cette expérience des lycées, reportée à plus tard avec des systèmes moins "ouverts" et renfermant de plus faibles quantités de mercure.
Dans un tube renversé dépassant d'environ 1 mètre de la cuve de mercure, la partie supérieure est "sous vide". On introduit dans le tube de l'éther liquide. Il "monte dans le mercure et, arrivé dans la partie supérieur sous vide poussé, il "bout", se vaporise. La pression de vapeur d'éther dans la partie supérieure du tube est "visible" par la descente du niveau de mercure (la pression totale mercure + éther étant égale à la pression atmosphérique). Dans un premier temps, l'ajout d'éther fait chuter le niveau de mercure : l'éther se vaporise et la pression de vapeur d'éther augmente de manière proportionnelle à la quantité d'éther introduite. À partir d'une certaine pression de vapeur d'éther, l'éther ajouté ne se vaporise plus, la partie supérieure du tube contient alors de la vapeur d'éther à son sommet et de l'éther liquide au-dessus du mercure. La pression d'éther est alors stable : l'éther ajouté n'engendre pas de pression supplémentaire du fait d'un équilibre en tre la phase liquide, plus compacte, et la phase gazeuse. Cette valeur "maximale" de vapeur d'éther, aboutissant à un état de "saturation" et à l'apparition d'une phase liquide est la pression de vapeur saturante de l'éther. Cette pression se mesure (en mmHg) par simple différence entre la hauteur initiale de mercure et la hauteur à pression saturante.
Le film Phases et changement de phase, de J. Treiner, montre cette expérience (à partir de 12min23s).
Replaçons maintenant, dans le diagramme de phase de l'eau, un parcours isotherme décrit dans le diagramme de Clapeyron.
Lien entre diagramme de Clapeyron et diagramme de phase
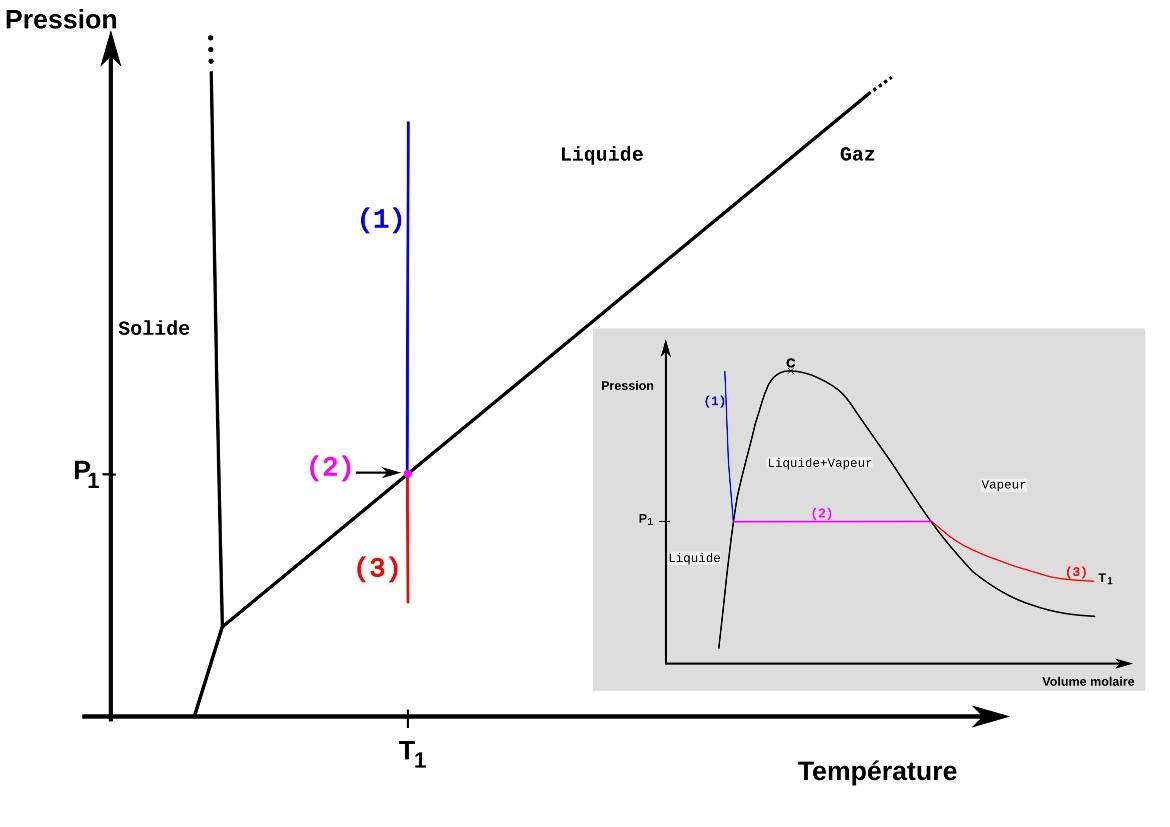
Le parcours décrit précédemment dans le diagramme de Clapeyron est un parcours isotherme à pression décroissante. Replacé dans le diagramme de phase, ce parcours isotherme est donc un segment de droite vertical, à température fixe T1, limité par les points de pression Pi et Pf, pressions initiale et finale du parcours. La première étape (liquide seul) correspond à la partie supérieure avec P > P1=Pvsat(T1) (domaine de stabilité de l'eau liquide), la troisième étape (vapeur seule) correspond à la partie inférieure avec P < P1=Pvsat(T1) (domaine de stabilité de la vapeur d'eau), la deuxième étape est concentrée dans le point (P1,T1) sur la frontière liquide-vapeur (coexistence des phases liquide et gazeuse lors du changement de phase).
Figure 5. Parcours isotherme replacé dans un diagramme de phase
Un parcours isotherme est un segment de droite vertical dans le diagramme de phase. L'étape (2), "liquide + vapeur", du diagramme de Clapeyron correspond au point (P1,T1) situé sur la limite des domaines "liquide" et "gaz".
L'ensemble des points de coordonnées (Pvsat(Tx), Tx) forme la limite entre les domaines de stabilité de l'eau liquide et de la vapeur d'eau, ces points correspondent aussi aux valeurs caractérisant les courbes de rosée et d'ébullition dans le diagramme de Clapeyron. On peut donc considérer que la courbe d'ébullition et la courbe de rosée sont confondues dans le diagramme de phase et forment la limite séparant les domaines liquide / gaz entre le point triple et le point critique.
Atmosphère, pression partielle et évaporation
Passons maintenant à une manipulation permettant de simuler une atmosphère, c'est-à-dire, ici, une phase gazeuse non uniquement constituée de vapeur d'eau. Replaçons-nous à 18°C à pression de vapeur saturante avec coexistence d'eau liquide et de vapeur d'eau et figeons le volume de l'enceinte. D'après les tables thermodynamiques (tableau 0-100°C), la pression de vapeur saturante à 18°C est de 20,6 hPa. Ce système est relié à une seconde enceinte de volume égal au volume de vapeur d'eau de la première enceinte et contenant du diazote (N2) à une pression de 180 hPa. Transférons le diazote dans la première enceinte et observons le système.
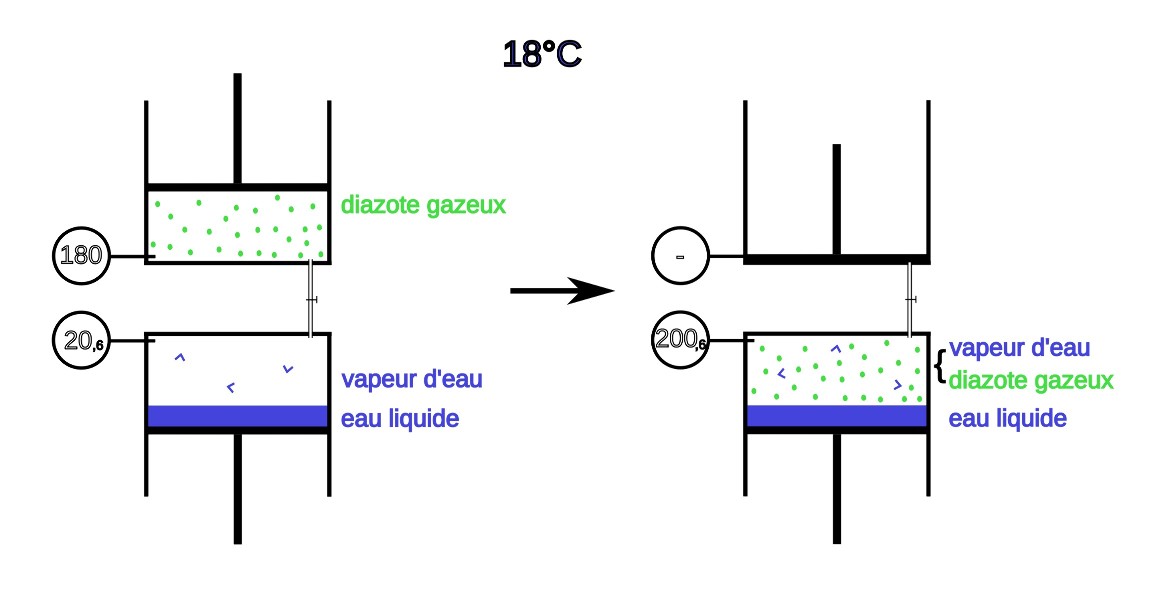
Figure 6. Pression gazeuse et pression partielle
À 18°C, mettons en contact un système dans lequel eau liquide et vapeur d'eau coexistent (volume V de vapeur d'eau à la pression de 20,6 hPa), avec un système de diazote gazeux de même volume V avec une pression mesurée de 180 hPa. Après transfert du diazote gazeux dans le système formé d'eau de volume V inchangé, on observe un volume d'eau liquide inchangé ainsi qu'une phase gazeuse de volume inchangé mais de pression égale à 200,6 hPa. La vapeur d'eau n'a pas été "condensée" par la pression exercée par le diazote gazeux. La phase gazeuse en présence est un mélange dans lequel la vapeur d'eau contribue à hauteur de 20,6 hPa à la pression totale mesurée, le reste étant dû au diazote gazeux. On dit qu'on a une pression partielle de 20,6 hPa de vapeur d'eau dans le mélange gazeux.
Dans l'enceinte initiale, coexistent, à 18°C, de l'eau liquide et de la vapeur d'eau à une pression de 20,6 hPa. Après introduction de diazote, initialement à une pression de 180 hPa pour un volume égal au volume initial de vapeur d'eau, on observe toujours une phase liquide et une phase gazeuse, et le "nouveau" système, de volume inchangé, est alors à une pression de 200,6 hPa. Reprenons une à une ces observations.
L'eau liquide initiale était, dans le diagramme de phase, à la limite liquide / vapeur et on lui applique désormais une pression plus élevée : on entre donc franchement dans le domaine de stabilité de l'eau liquide. L'eau liquide reste donc liquide.
Dans la phase gazeuse, si l'ajout de diazote avait "comprimé" la vapeur d'eau, cette dernière serait passée à l'état liquide, ce qui n'est pas le cas puisque le volume d'eau liquide est inchangé. La pression mesurée indique que la phase gazeuse n'est pas constituée que de diazote gazeux, car sinon la pression serait de 180 hPa. La pression d'un gaz, à température et volume constants, étant fonction du nombre de moles de gaz, la pression mesurée indique que la phase gazeuse en présence est un mélange de diazote et de vapeur dont les molécules, et donc les pressions, se sont "ajoutées". La vapeur d'eau est restée vapeur d'eau... alors que la pression a augmenté. Expliquons de manière imagée ce phénomène.
L'état solide de l'eau correspond à des molécules dans des positions figées et faiblement mobiles. L'état liquide de l'eau correspond à des molécules au contact les unes des autres mais mobiles les unes par rapport aux autres. L'état gazeux correspond à des molécules d'eau "indépendantes" (pas forcément au contact les unes des autres) et "agitées".
La condensation de la vapeur d'eau signifie que les molécules d'eau "entrent en contact", "restent en contact" tout en restant mobiles les unes par rapport aux autres (état liquide). La probabilité de "contact" augmente lorsqu'il y a de plus en plus de molécules dans un volume donné. La probabilité de "contact durable" augmente lorsque l'agitation des molécules diminue (moins d'énergie pour rebondir et se "séparer"). C'est la pression gazeuse, à température et volume constants, qui reflète la concentration en molécules. La température, à pression et volume constants, reflète, elle, l'agitation des molécules. Ainsi, à température constante, la condensation est atteinte par augmentation de pression (augmentation de la concentration et des "contacts"), alors qu'à pression constante la condensation est favorisée par une baisse de température (baisse de l'agitation thermique et des possibilités de "séparation").
Pour un mélange gazeux, comme le mélange vapeur d'eau - diazote envisagé ci-dessus, ce n'est pas la pression totale du mélange qui est à prendre en compte pour déterminer l'état de stabilité de chaque composante gazeuse, mais la pression partielle de chaque composante (la "concentration" de chaque type de molécule). Dans notre exemple, la pression gazeuse totale est de 200,6 hPa, mais pour rendre compte de l'état de l'eau, c'est la pression partielle, la "concentration", en eau qui importe . En l'absence d'ajout et d'export de vapeur d'eau dans notre expérience ("concentration" en eau constante), cette pression partielle en vapeur d'eau reste égale à 20,6 hPa , ce qui, à 18°C, correspond à un état stable sous forme de vapeur d'eau. La vapeur d'eau initiale reste donc stable sous forme de vapeur d'eau, quelle que soit la pression totale due à d'autres gaz : l'augmentation de pression totale augmente la probabilité de "contacts" avec d'autres molécules, mais l'état de l'eau ne dépend, lui, que des "contacts" entre molécules d'eau.
La pression de vapeur saturante de l'eau correspond donc à la pression partielle maximale de vapeur d'eau dans un mélange gazeux (l'atmosphère, par exemple) à température donnée.
Ainsi, à 18°C, à pression ambiante, l'atmosphère peut être constituée en partie de vapeur d'eau, à une hauteur maximale d'environ 20 hPa (sur les 1013 hPa de pression "totale" de l'atmosphère).
Particularité du passage liquide - solide pour l'eau
On devrait pouvoir appliquer le même raisonnement pour la limite liquide- solide et s'attendre à ce qu'une augmentation de pression à température constante favorise la solidification, ce qui est le cas de la quasi-totalité des corps. Mais les propriétés "électriques" particulières de la molécule d'eau font que des forces de répulsion à courte distance sont sensibles lorsqu'on "rapproche" les molécules les unes des autres. Ainsi, lorsqu'on comprime de la glace, on augmente ces forces de répulsion qui peuvent alors redonner une mobilité relative aux molécules d'eau d'où un passage de l'état solide vers l'état liquide (la glace fond sous la pression de la lame du patin à glace, ce qui forme une fine couche d'eau liquide sur laquelle cette dernière peut glisser). Ceci explique que la limite solide - liquide dans le diagramme de phase a une pente inverse par rapport à la limite liquide - vapeur, du moins à "faible" pression. À plus forte pression, l'eau retrouve un comportement "classique" et une augmentation de pression entraîne alors le passage de l'état liquide à l'état solide (cf. le diagramme de phase pour les glaces d'eau de haute pression).
Lorsqu'on s'intéresse à un système complexe dans lequel de l'eau liquide et une phase gazeuse sont en contact, la phase gazeuse exerce une pression sur le liquide, mais de plus, la limite liquide - gaz n'est pas "infranchissable" : des échanges sont possibles. Si la température baisse dans la phase gazeuse et que de la vapeur d'eau se condense, l'eau liquide formée s'ajoute à la phase liquide. Dans le sens inverse, si la phase gazeuse n'est pas saturée en vapeur d'eau, alors de l'eau de la phase liquide peut passer à l'état de vapeur d'eau et venir augmenter la pression partielle en vapeur d'eau du mélange gazeux, à hauteur maximale de la pression de vapeur saturante de l'eau. Ces "échanges" sont à la base du cycle de l'eau à la surface de la Terre.
Ébullition - Évaporation
L'eau peut passer de l'état liquide à l'état gazeux lors de deux processus distincts.
Il y a ébullition lorsque de l'eau liquide passe à l'état gazeux du fait de changements de conditions de pression et/ou de température amenant le système du domaine de stabilité de l'eau liquide dans le domaine de stabilité de la vapeur d'eau. C'est de l'eau liquide devenue instable qui se vaporise.
À pression donnée, la température d'ébullition correspond à la température pour laquelle la pression du système est égale à la pression de vapeur saturante de l'eau.
Il y a évaporation lorsque de l'eau liquide passe à l'état de vapeur d'eau alors que l'on est dans le domaine de stabilité de l'eau liquide mais que cette dernière est en contact / échange avec un milieu gazeux non saturé en vapeur d'eau. C'est de l'eau liquide stable qui se vaporise et forme de la vapeur d'eau, elle aussi stable dans la phase gazeuse.
À température donnée, l'évaporation est possible jusqu'à avoir, au maximum, une fraction de vapeur d'eau égale à la pression de vapeur saturante de l'eau dans le milieu gazeux.
Informations contenues dans le diagramme de phase
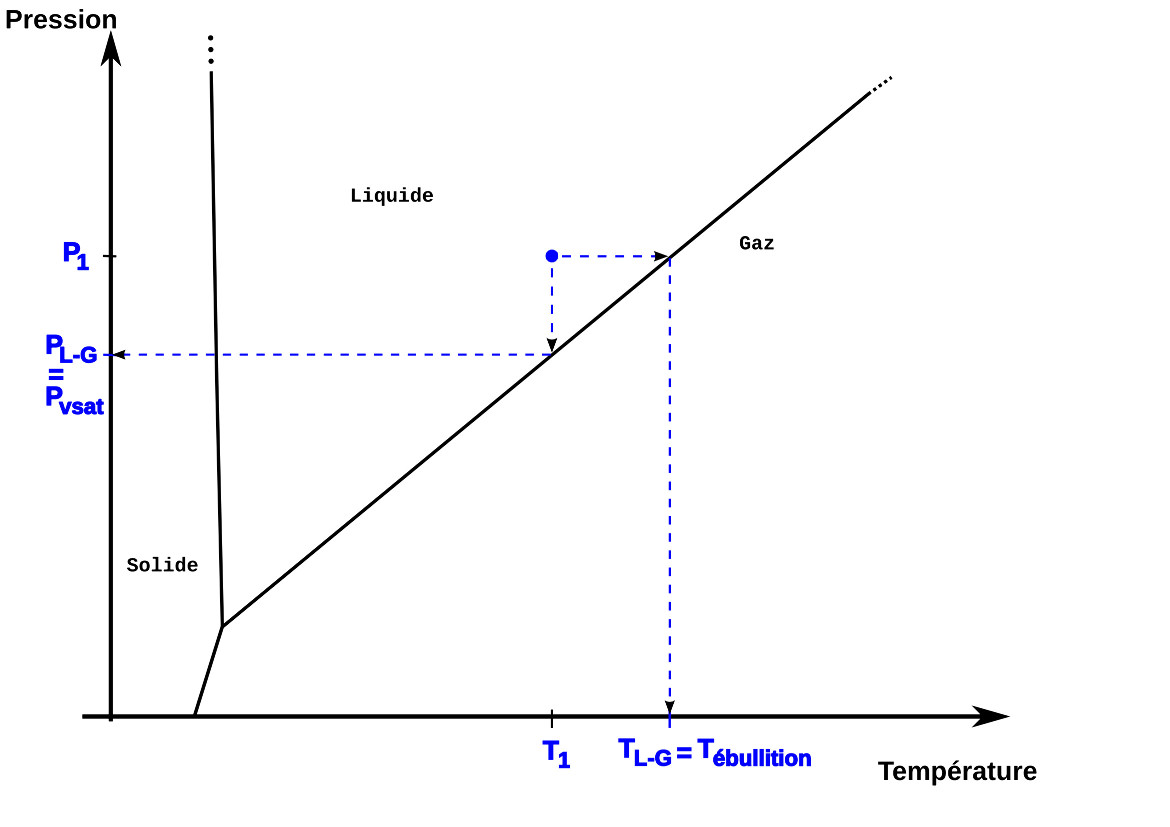
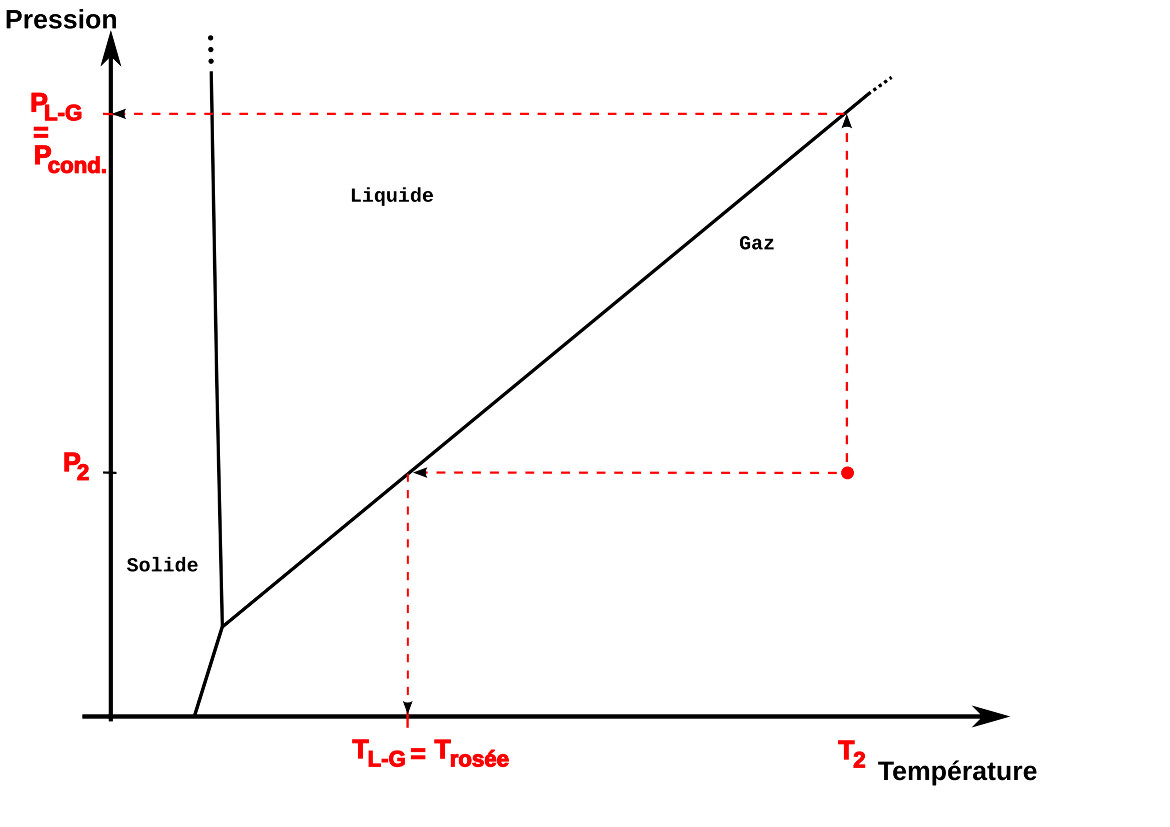
Figure 7. Informations contenues dans un diagramme de phase pour un liquide Pour un point situé dans le domaine "liquide" (P1,T1), on détermine la température d'ébullition du système (Tébullition) et la pression de vapeur saturante (Pvsat), pression partielle maximale d'eau dans une phase gazeuse à température T1. | Figure 8. Informations contenues dans un diagramme de phase pour un gaz Pour un point situé dans le domaine "gaz" (P2,T2), on détermine la pression de condensation (Pcond.) et la température de rosée (Trosée), température à laquelle une masse d'air de pression partielle en eau P2 sera saturée... et formera donc des gouttelettes liquides. |
Le diagramme de phase permet d'extraire plusieurs informations sur un système soumis à des conditions de température et de pression connues (P, T).
- La position du point (P,T) dans le diagramme de phase permet de déterminer quel est l'état physique stable de l'eau : solide, liquide ou gazeux.
- À la température T, on peut déterminer, à la limite liquide/gaz, la pression PL-G. De même, à la pression P, on peut déterminer, à la limite liquide/gaz, la température TL-G. On peut interpréter ces deux points en fonction de l'état de stabilité du système.
- Pour un système liquide (point bleu (P1,T1) dans la figure ci-dessus), TL-G est la température d'ébullition du système (Tébullition) et PL-G la pression de vapeur saturante (Pvsat) dans une phase gazeuse de même température.
- Pour un système liquide (point rouge (P2,T2) dans la figure ci-dessus), PL-G est la pression de condensation du système (Pcond.) et TL-G est la température de rosée (Trosée), température à laquelle une phase gazeuse de pression partielle P2 en vapeur d'eau devient saturée... et commence à former des gouttelettes d'eau liquide.
Construire son diagramme de phase
Pour construire un diagramme de phase limité à un domaine (P,T), il faut construire les limites entre les domaines de stabilité en se reportant à des tables thermodynamiques. Avec les données contenues dans cet article, il est possible de tracer les limites liquide-vapeur de 0 à 100°C (cf. tableau de données liquide-vapeur), solide-vapeur de 0 à -29°C (cf. tableau de données solide-vapeur) et de tracer la limite solide-liquide à partir de 2 points : le point triple et le point de congélation à pression ambiante (on a quasiment une verticale).
Retour sur Terre
Revenons sur Terre et plaçons-nous dans des conditions de surface à 291 K (18°C ) et 1013 hPa. Reprenons une à une les informations contenues dans le diagramme de phase de l'eau (point bleu sur le premier diagramme de phase) pour ces conditions de pression et de température.
- À 291 K (~18°C) et 1013 hPa, on est dans le domaine de stabilité de l'eau liquide.
- À 1013 hPa, l'eau se solidifie à ~273 K (0°C) et entre en ébullition à ~373 K (100°C).
- À 291 K (~18°C), la pression de vapeur saturante est de 20,6 hPa.
De ces éléments on déduit donc respectivement :
- L'état stable de l'eau de surface à 18°C est l'état liquide.
- À pression ambiante, il est possible de passer dans le domaine de stabilité de la glace (en deçà de 0°C) mais on n'atteint jamais le point d'ébullition dans les conditions classiques de température de surface terrestre (de -50°C à +50°C).
- La pression de vapeur saturante nous indique que l'atmosphère à 18°C peut contenir une pression partielle maximale de vapeur d'eau de 20,6 hPa, soit environ 2% de son volume, le "reste" étant composé d'"air sec" (N2 et O2 principalement).
Il est donc possible de trouver de l'eau stable à l'état solide, liquide ou gazeux à la surface de la Terre. La quantité maximale de vapeur d'eau dans l'atmosphère dépend fortement de la température de cette dernière (cf. tables thermodynamiques ci-dessous).
La pression de vapeur saturante est une donnée importante lorsqu'on parle du taux d'humidité de l'air, ou humidité relative. En effet, un taux d'humidité de 100% signifie que l'air est saturé en vapeur d'eau, c'est-à-dire que la vapeur d'eau y est à sa pression partielle maximale, Pvsat. Ainsi, à 18°C, un air saturé en humidité contient, en volume, environ 2% de vapeur d'eau et 98% d'"air sec" (diazote, oxygène...).
Un taux d'humidité de 60% signifie donc que la masse d'air en question ne contient que 60% de sa capacité maximale en vapeur d'eau. La pression de vapeur saturante étant une fonction croissante de la température, de l'air "chaud" à 60% d'humidité relative contient plus de vapeur d'eau que de l'air "froid" à 60% d'humidité relative.
Si une flaque d'eau peut "totalement" s'assécher (ou si le linge peut sécher), ce n'est pas par ébullition de l'eau mais par évaporation de cette eau dans une atmosphère non saturée et de volume important : l'atmosphère peut donc "incorporer" la petite quantité d'eau initialement liquide sous forme de vapeur sans se saturer en vapeur d'eau. La flaque ne s'assèche pas (le linge ne sèche pas) lorsque le taux d'humidité relative de l'air est de 100%.
La construction précise du diagramme de phase nécessite des calculs thermodynamiques complexes ou l'utilisation d'équations approchées valables chacune dans une certaine gamme de températures. On trouve aussi des « tables thermodynamiques » listant les propriétés désirées. Ci-dessous quelques valeurs indiquant la pression de vapeur saturante en fonction de la température pour une gamme usuelle de températures.
Tableau 1. Pression de vapeur saturante de l'eau pour des températures allant de 0°C (273 K) à 100°C (373 K)
t°C | 0 | 1 | 2 | 3 | 4 | 5 | 7 | 9 | 10 | 12 | 14 |
Pvsat (Pa) | 611 | 657 | 705 | 757 | 813 | 872 | 1001 | 1147 | 1227 | 1402 | 1597 |
t°C | 15 | 17 | 18 | 19 | 20 | 22 | 24 | 25 | 27 | 29 | 30 |
Pvsat (Pa) | 1704 | 1936 | 2063 | 2196 | 2337 | 2642 | 2982 | 3166 | 3564 | 4004 | 4242 |
t°C | 32 | 34 | 35 | 40 | 45 | 50 | 60 | 70 | 80 | 90 | 100 |
Pvsat (Pa) | 4754 | 5318 | 5622 | 7375 | 9582 | 12335 | 19919 | 31161 | 47359 | 70108 | 101325 |
On note qu'on trouve à 100°C une pression de vapeur saturante d'eau de 101325 Pa, soit 1013, 25 hPa, la pression "ambiante". La température d'ébullition de l'eau à pression ambiante correspond donc bien à la température à laquelle la pression de vapeur saturante est égale à la pression totale extérieure.
Valeurs extraites de thermexcel.com.
On remarque que de l'air à 0°C peut contenir deux fois moins de vapeur d'eau que de l'air à 10°C, qui lui-même ne peut en contenir que deux fois moins que de l'air à environ 21°C... On comprend l'intérêt d'avoir de l'air renouvelé (pour éviter la saturation) et chaud (pour augmenter la pression de vapeur saturante) pour sécher du linge. On comprend aussi pourquoi une masse d'air chaud et humide libère de la pluie en se refroidissant (la pression partielle de vapeur d'eau initiale, même inchangée par le refroidissement, va atteindre la valeur de la pression de vapeur saturante qui, elle, diminue lors du refroidissement).
Sublimation de la glace
La notion de pression de vapeur saturante est aussi valable pour des masses d'air froides et/ou à basse pression au contact du domaine de stabilité de la glace. Les pressions de vapeur saturante sont très faibles mais expliquent la sublimation possible de glace au contact d'air froid et très sec.
Cette sublimation partielle de glace en altitude ou dans le vide aboutit à des formes "d'érosion" de la glace appelées pénitents (cf. comparaison entre la surface de la comète Wild 2 et les pénitents du Kilimandjaro).
À l'inverse, la condensation de vapeur d'eau dans une atmosphère froide forme du givre (eau sous forme de glace).
Tableau. Pression de vapeur saturante de l'eau pour des températures allant de 0°C (273 K) à -29°C (244 K)
t°C | 0 | -1 | -2 | -3 | -4 | -5 | -7 | -9 | -10 | -12 | -14 | -15 | -20 | -25 | -29 |
Pvsat (Pa) | 611 | 611 | 563 | 476 | 437 | 401 | 338 | 284 | 260 | 217 | 181 | 165 | 103 | 63 | 42 |
Valeurs extraites de Steam97Web (traduction française).
De l'air à -20°C a une pression de vapeur saturante 6 fois moindre que de l'air à 0°C. Ceci explique, par exemple, les faibles capacités de précipitations neigeuses lorsque l'air est "très froid".
Tout va donc pour le mieux, le programme de SVT de seconde ne ment pas ! On trouve de l'eau stable sous les états liquide, solide et gazeux à la surface de la Terre et l'énergie solaire engendre, pour partie, une évaporation de l'eau liquide ce qui aboutit à la présence de vapeur d'eau dans l'atmosphère.
Cette vapeur d'eau, au gré des mouvements atmosphériques et des variations de pression et de température, peut se condenser et donner de la pluie (ou de la neige) : c'est la base du cycle externe de l'eau... qui explique aussi en partie la redistribution latitudinale de l'énergie solaire à la surface de la Terre puisque l'évaporation "capte" de l'énergie solaire et que la condensation "libère" cette énergie, parfois à plusieurs milliers de kilomètres du lieu d'évaporation.
Références
J. Schwartzentruber, Les Bases de la Thermodynamique : les principes fondamentaux et leurs applications directes. Module de cours de l'École des Mines d'Albi-Carmaux
V. Bourges, Changements d'état. Site personnel
J. Treiner, 1997, Phases et changement de phase, Canal U. À 12min23s, expérience filmée visualisant ce qu'est la pression de vapeur saturante dans un tube de Torricelli.
WebBook de Chimie, site du NIST (National Institute of Standards and Technology). Site de données thermodynamiques très complet mais assez difficile d'accès.