Article | 15/06/2000
Quelles sont les propriétés communes des gaz à effet de serre ?
15/06/2000
Résumé
Les gaz a effet de serre : propriétés d'absorption découlant de la structure moléculaire.
Question
« Tous les gaz engendrent-ils un effet de serre, même minime ? Pour les principaux gaz à effet de serre couramment cités, connaît-on leurs propriétés physico-chimiques communes faisant qu'ils ont la capacité de « piéger » et réémettre le rayonnement infrarouge ? »
Question provenant du Lycée J.Monod posée par courrier électronique le 9 mai 2000.
Réponse
En résumé :
L'effet de serre est une analogie qui traduit en réalité une propriété physique : l'absorption du rayonnement infrarouge (IR) par un corps. Tous les gaz (ou autres corps) qui sont transparents au rayonnement visible et qui absorbent partiellement le rayonnement infrarouge tellurique participent à l'effet de serre de l'atmosphère. L'absorption du rayonnement infrarouge dépend de la structure de la molécule. Les molécules bi-atomiques et symétriques (O2, N2, H2...) sont très peu absorbantes dans le domaine infrarouge lointain (4 à 40 μm, domaine du spectre IR terrestre). Les molécules triatomiques ou non symétriques (H2O, CO2, CH4, CO...) sont beaucoup plus absorbantes. Par ailleurs, certaines piègent ce rayonnement IR plus que d'autres, comme le CO2 (qui est relativement abondant et qui a une bande d'absorption pratiquement là où la Terre émet le plus : 15 μm). Parmi les principaux contributeurs à l'effet de serre, on comptera le méthane, les CFC (chlorofluorocarbures), l'ozone. Il ne faut pas oublier que le gaz qui contribue le plus à l'effet de serre reste H2O dont la concentration varie énormément en fonction des facteurs météorologiques.
Réponse plus détaillée :
Pour qu'un gaz puisse jouer un rôle dans l'effet de serre (naturel ou additionnel), il faut qu'il ait des propriétés d'absorption (et donc de réémission) dans le domaine d'émission du système Terre-atmosphère considéré comme un corps noir autour de 260 à 280K. Ce domaine spectral correspond à l'infrarouge thermique entre 4 μm et 40 μm. Dans ce domaine, les molécules considérées absorbent un photon et passent d'un état fondamental à un état excité de vibration.
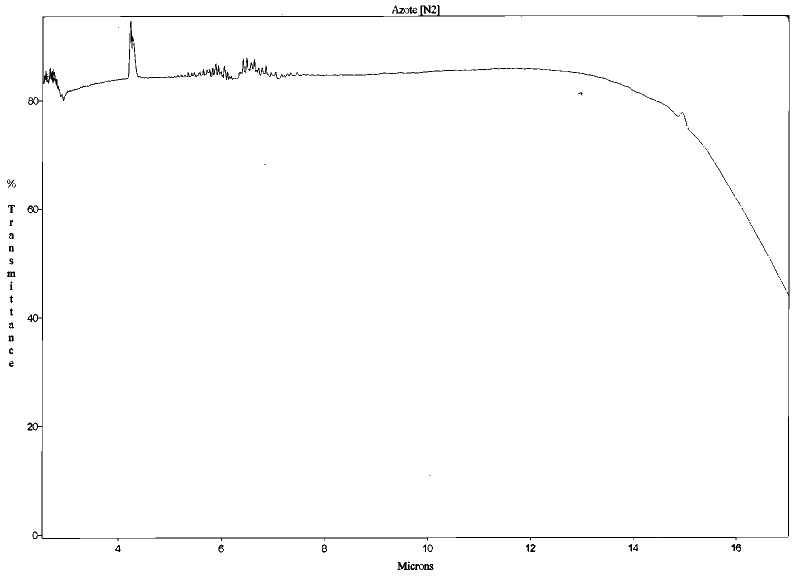
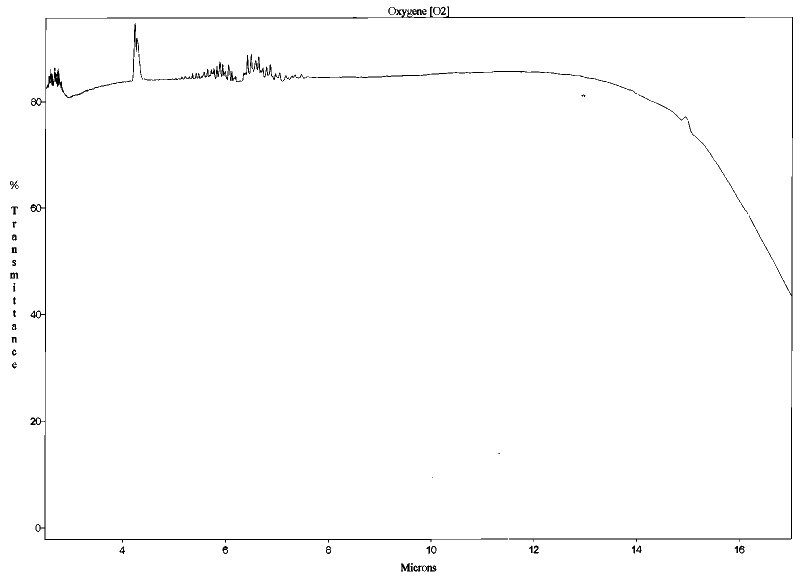
Cette capacité d'absorption est directement liée aux propriétés spectroscopiques des molécules et donc à leur structure (leur capacité à « vibrer »). Les molécules diatomiques comme le diazote N2 et le dioxygène O2 n'ont pas cette capacité de vibration et donc n'absorbent pas le rayonnement dans le domaine des longueurs d'onde infrarouge. Elles ne jouent donc pas de rôle dans l'effet de serre.
Figure 1. Spectre d'absorption du diazote (N2) entre 2 et 17 μm Mesures effectuées au Laboratoire de Sciences de la Matière, ENS de Lyon. | Figure 2. Spectre d'absorption du dioxygène (O2) entre 2 et 17 μm Mesures effectuées au Laboratoire de Sciences de la Matière, ENS de Lyon. |
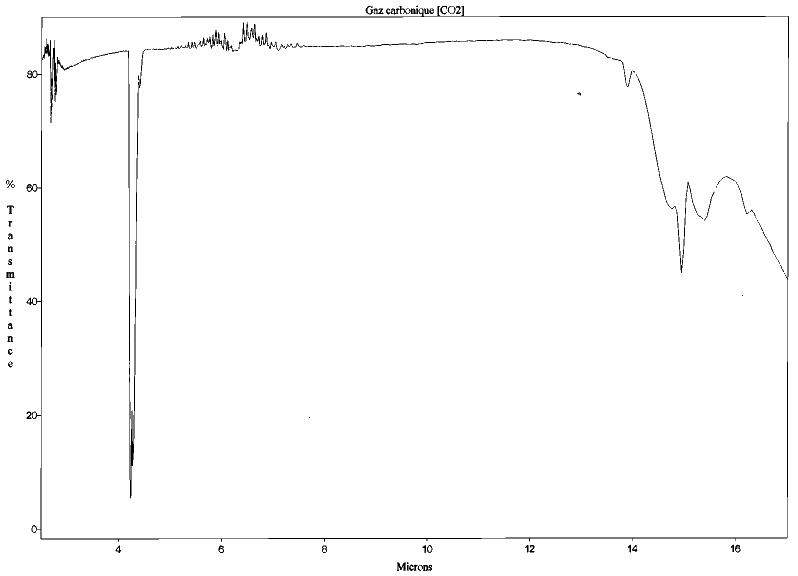
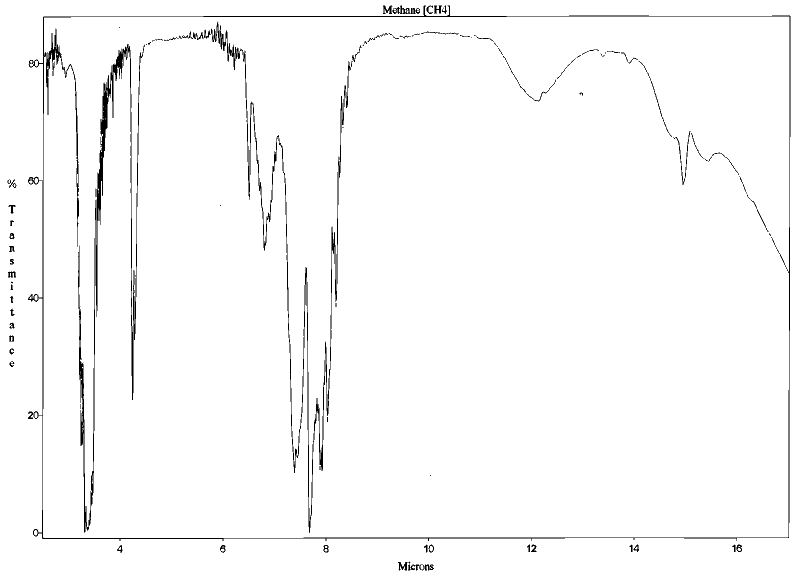
Les molécules triatomiques et polyatomiques, qu'elles aient une structure linéaire (comme le gaz carbonique CO2 et l'hémioxyde d'azote N2O), tétraédrique (comme le méthane CH4) ou sans symétrie d'ordre supérieur (comme la vapeur d'eau H2O, l'ozone O3 ou les CFC) possèdent des bandes d'absorption dans le domaine infrarouge et peuvent donc jouer un rôle dans l'effet de serre.
Figure 3. Spectre d'absorption du dioxyde de carbone (CO2) entre 2 et 17 μm (structure linéaire) Mesures effectuées au Laboratoire de Sciences de la Matière, ENS de Lyon. | Figure 4. Spectre d'absorption du méthane (CH4) entre 2 et 17 μm (structure tétraédrique) Mesures effectuées au Laboratoire de Sciences de la Matière, ENS de Lyon. |
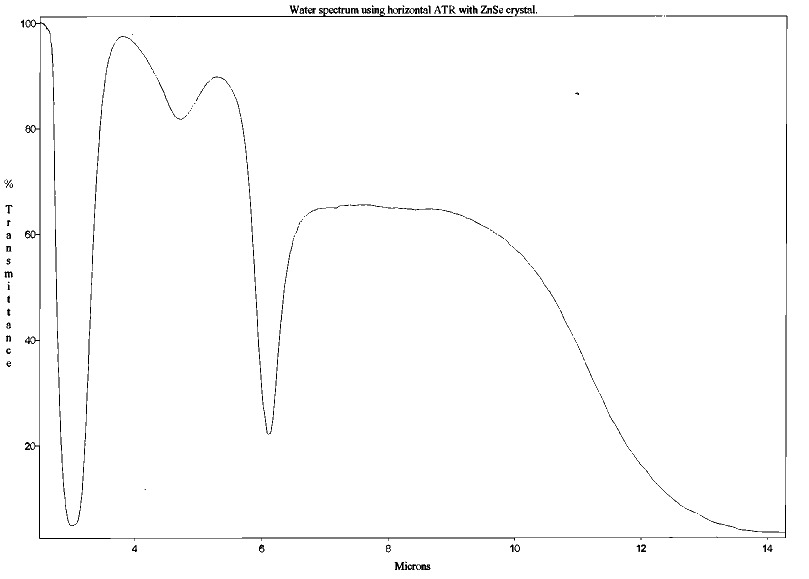
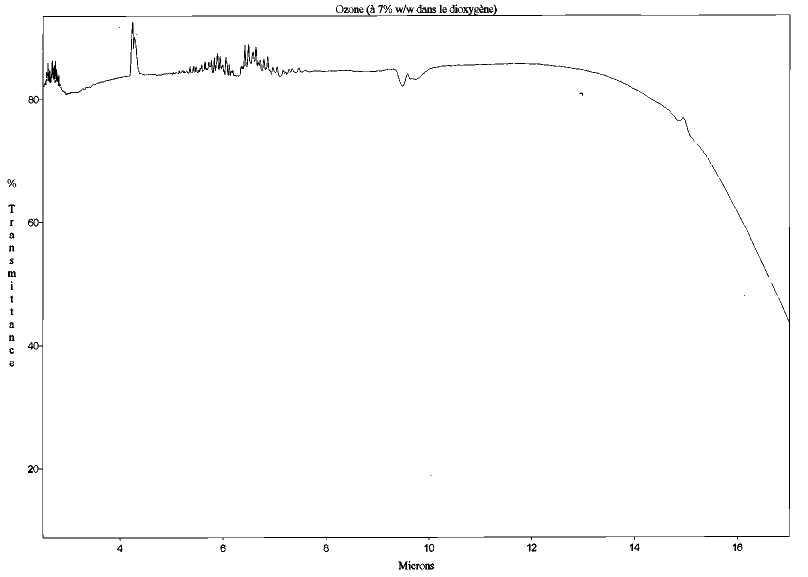
Figure 5. Spectre d'absorption de l'eau (H2O) entre 2 et 15 μm (structure sans symétrie d'ordre supérieur) Mesures effectuées au Laboratoire de Sciences de la Matière, ENS de Lyon. | Figure 6. Spectre d'absorption l'ozone (O3) entre 2 et 17 μm (structure sans symétrie d'ordre supérieur) Mesures effectuées au Laboratoire de Sciences de la Matière, ENS de Lyon. |
Attention : Il y a une petite différence entre les spectres de l'ozone et de l'azote. En relation avec sa configuration spatiale, l'ozone absorbe légèrement vers 10 μm. Malheureusement, notre appareil "ozonair" ne permet de dégager que 7% d'ozone dans l'oxygène pur !! La concentration en ozone est donc très faible dans l'appareillage, ce qui n'a pas permis de faire des mesures précises...
La capacité des constituants atmosphériques à piéger le rayonnement infrarouge est donc liée à leurs propriétés de structure moléculaire. Leur rôle relatif dans l'effet de serre est alors fonction de leur concentration dans l'atmosphère et du degré de saturation des transitions, lié précisément à cette concentration relative.
Ainsi, l'effet de serre naturel est principalement dû à H2O et CO2. Compte tenu des concentrations actuelles de ces gaz dans l'atmosphère, aux longueurs d'onde considérées, l'absorption du rayonnement est totale. Une augmentation de concentration de ces gaz ne conduit pas alors à une augmentation proportionnelle de l'absorption (la relation n'est pas linéaire). Ceci explique que le doublement du gaz carbonique de 350 ppmv (parties par million en volume) à 700 ppmv ne conduise qu'à un apport d'énergie supplémentaire de 4 W/m2 alors que l'effet actuel (qui correspond à un passage de 0 ppmv à 350 ppmv) est d'environ 50 W/m2.
Ceci explique aussi que des constituants moins abondants comme le méthane (1,8 ppmv), l'ozone (0,04 ppmv) ou les CFC (0,003 ppmv) puissent in fine jouer un rôle relatif important dans l'effet de serre additionnel dans la mesure où leurs bandes d'absorption sont situées à des longueurs d'onde différentes de celles de H2O et CO2.
Ainsi, à masse égale relâchée aujourd'hui dans l'atmosphère, le méthane a un pouvoir de piégeage du rayonnement 56 fois supérieur à celui du CO2, l'ozone 1 200 fois et les CFC entre 4 000 et 8 000 fois.
Voir également l'effet de serre, pour plus d'informations.