Article | 10/03/2008
Les sources thermominérales d'Auvergne : chimiolithotrophie et photosynthèse
10/03/2008
Résumé
La chimiolithotrophie dans les écosystèmes bactériens des sources thermales minéralisées.
Table des matières
- Rappel sur la diversité des types trophiques des êtres vivants
- Grotte du Cornadore (Station 1)
- Paroi éclairée par la lumière naturelle (Station 2)
- Bassin d'eau (Station 3)
- Captage d'eau à l'abri de la lumière (Station 4)
- Zonation des algues le long d'un ruisseau (Station 5)
- Source la Tête de Lion (Station 6)
- Conclusions
- Localisation des lieux étudiés
Cet article est issu d'un consortium symbiotique entre trois auteurs. Marc-André Selosse a créé la sortie de terrain et une première version des schémas, David Busti s'est occupé de la rédaction, de la mise en forme des schémas et du choix des extraits vidéos. Pierre Thomas a assisté à cette sortie, et a relu et complété l'ensemble. Merci de leur aide à Anne-Marie Mollet et Olivier Dequincey (vidéos). Nous remercions M. Gérard, propriétaire de la grotte du Cornadore à Saint Nectaire (renseignements : 04 73 88 57 97), pour nous avoir permis de filmer et photographier à l'intérieur de la grotte.
L'Auvergne appartient, avec les Pyrénées, aux régions les plus riches en sources thermales de France. Ses sources d'eaux minérales sont assez souvent chaudes (le record est de 82°C à Chaudes-Aigues dans le Cantal) et très souvent chargées en CO2 (c'est pourquoi on les qualifie de carbo-gazeuses). La majorité des eaux gazeuses françaises du commerce viennent d'ailleurs du Massif Central ou de sa périphérie immédiate : Badoit, Perrier, Quézac, Saint-Yorre, Salvetat, Vals… (voir Les sources minérales oubliées du Massif Central de F. Surmély, Éd. de la Montmarie, 2004). Bien qu'en majorité localisées dans des régions non calcaires (régions granitiques ou volcaniques), ces sources plus ou moins chaudes sont aussi très souvent chargées en carbonates et cations dissous : c'est pourquoi on les qualifie de thermominérales. Elles déposent des concrétions de carbonate de calcium (CaCO3). Celui-ci précipite continuellement sous forme de dépôts, qui emprisonnent parfois des débris végétaux, et édifient des roches appelées travertins.
Les dépôts des sources thermominérales d'Auvergne sont le plus souvent jaune clair. Ils sont alors constitués de CaCO3 relativement pur. Parfois, ils sont totalement blancs, car additionnés de gypse (CaSO4, 2H2O), ou de couleur rouille, car riches en hydroxydes ferriques (Fe2O3, nH2O - ils contiennent donc du Fe3+). Ces dépôts de gypse et d'oxydes ferriques sont directement liés à l'action de bactéries : ils correspondent plus précisément aux produits d'un métabolisme bactérien appelé chimiolithotrophie. Enfin, il arrive que la surface de ces dépôts soit plus diaprée, teintée de vert, bleu-vert, bronze, … car ils sont directement recouverts de biofilms de bactéries ou d'algues photosynthétiques.
Ainsi, au niveau de ces sources et de leurs minéralisations, se développent des écosystèmes microbiens assez originaux, aux métabolismes très variés. C'est ce que nous nous proposons d'étudier dans cet article. Dans un autre article, nous étudierons la géologie de ces sources et de leurs dépôts.
La chimiolithotrophie est un métabolisme répandu chez les bactéries. Bien que passant souvent inaperçu dans les sols et les eaux, il s'observe facilement en domaine terrestre au niveau des sources thermominérales. Parmi les nombreux sites naturels ou aménagés d'Auvergne, nous présentons ici deux sites faciles d'accès et très représentatifs. Ce sont, d'une part, les grottes du Cornadore et un petit ruisseau voisin situés sous le Mont Cornadore, à Saint-Nectaire (stations 1 à 5) et, d'autre part, la source de la Tête de Lion (ou de la Tour Rambaud), une source pétrifiante naturelle dont la forme rappelle celle d'une tête de lion (station 6). Deux cartes présentées en annexe permettent de les localiser précisément.
Rappel sur la diversité des types trophiques des êtres vivants
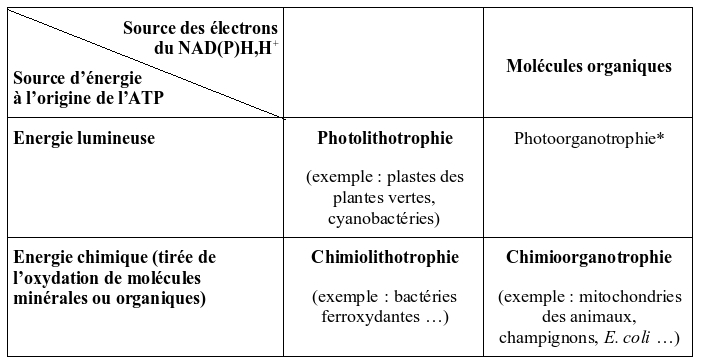
Les êtres vivants présentent une grande diversité de métabolismes assurant leurs synthèses organiques (réactions d'anabolisme) et leurs besoins énergétiques (réactions de catabolisme). En fonction de la source d'énergie et d'électrons (pouvoir réducteur), il est possible de les classer en quatre types (Fig. 1)
Figure 1. Principaux types de métabolisme chez les êtres vivants
* il n'existe pas d'organismes strictement photo-organotrophes : la photo-organotrophie est pratiquée de manière transitoire par des organismes vivant essentiellement selon un autre type trophique.
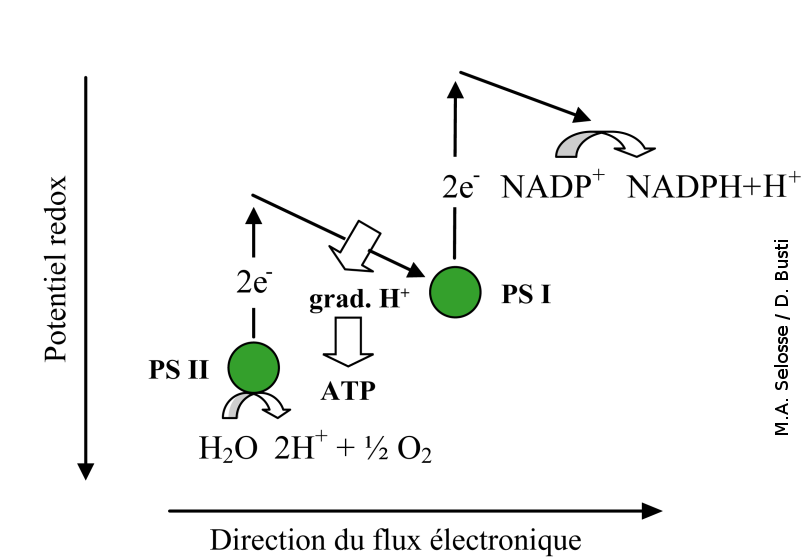
Les végétaux et les cyanobactéries photosynthétiques sont des organismes photolithotrophes qui tirent leur énergie de l' énergie lumineuse et utilisent comme source d'électrons des molécules minérales (H2O chez les plantes terrestres, les algues et les cyanobactéries ; H2S chez les bactéries sulfureuses et certaines cyanobactéries – voir ci-dessous). Les électrons issus de la dissociation de ces dernières molécules (photolyse) sont portés à un haut potentiel énergétique par l'intermédiaire d'un ou deux photosystème(s), au niveau desquels l'énergie lumineuse est convertie en énergie chimique. Après avoir traversé une chaîne de transporteurs, ces électrons permettront de réduire le NADP+ en NADPH+H+, tandis que l'énergie récupérée lors de ce transfert (sous forme de gradient de proton) permet de produire de l'ATP au niveau des ATP synthases (Fig. 2). ATP et NADPH+H+ sont ensuite utilisés pour fixer le CO2 et produire des molécules organiques au niveau du cycle de Calvin.
PS I, photosystème 1 ; PS II, photosystème II.
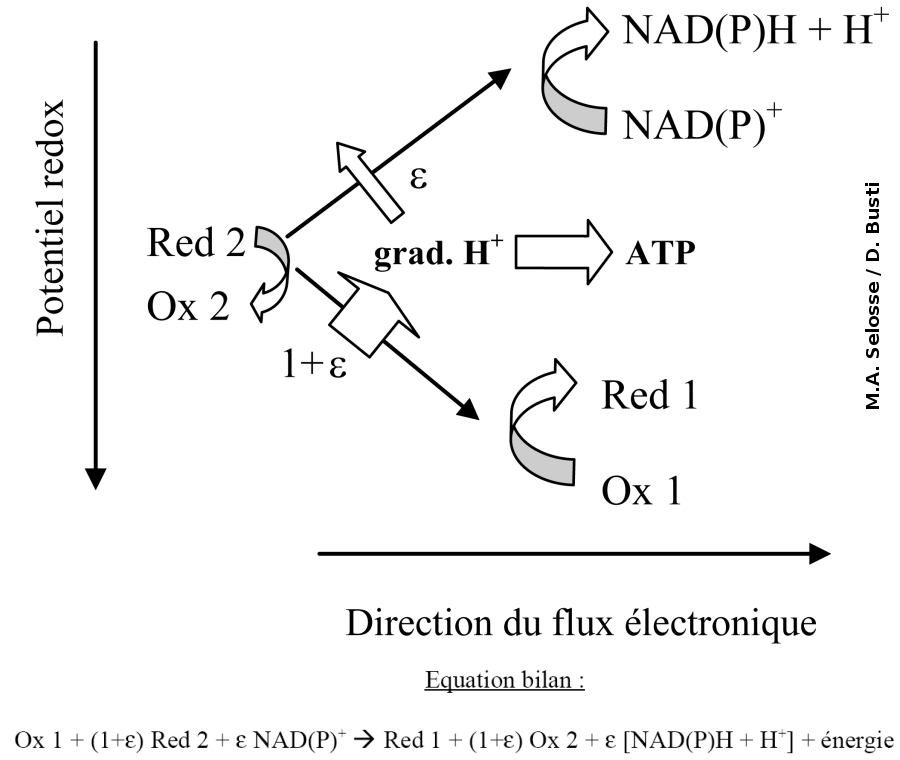
Les chimiolithotrophes tirent leur énergie et leurs électrons de l'oxydation de molécules minérales telles que H2S et le soufre (bactéries sulfoxydantes), le Fe2+ (bactéries ferroxydantes), le NH4+ ou le NO2- (bactéries de la nitrification), voire de molécules organiques simples comme le méthane CH4 (bactéries méthanotrophes). Chez ces organismes, le donneur d'électrons a un potentiel généralement insuffisant pour réduire directement le NAD(P)+. Une chaîne de transport inverse est donc nécessaire pour former le NAD(P)H+H+ (Fig. 3). Au cours de ce processus, de l'énergie est consommée pour faire fonctionner cette chaîne de transporteurs. Alors que dans les mitochondries ou dans la branche descendante du diagramme en Z (Fig. 2), des oxydo-réductions thermodynamiquement autorisées servent, par couplage, à transférer des protons contre leur gradient, la chaîne de transport inverse couple un transfert de protons selon son gradient à des oxydo-réductions thermodynamiquement interdites. Dans tous les cas, il s'agit de couplages énergétiques entre réactions. Chez les chimiolithotrophes, le gradient de protons ne sert pas seulement à faire de l'ATP, mais aussi en partie à la chaîne de transport inverse. De même, les électrons ont deux devenirs possibles : soit ils vont au NAD(P)+, soit ils entrent dans une voie qu'on peut qualifier de respiratoire (vers un accepteur, Ox 1, en créant du gradient de H+). C'est pourquoi les bactéries chimiolithotrophes ont de nombreux replis membranaires ou des saccules (Fig. 4), au sein desquels se disposent (1) les transporteurs d'électrons décrits et (2) un gradient de protons.
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Bonus : 8 minutes pour parler de gradient d'électrons et de protons et de cycle de Calvin.
Figure 3. Variation du potentiel redox chez les bactéries chimiolithotrophes et équation bilan de la réaction
Ces organismes utilisent NAD+ ou NADP+ selon les cas ; ε varie couramment entre 0,1 et 10, selon les positions des couples redox dans le diagramme.
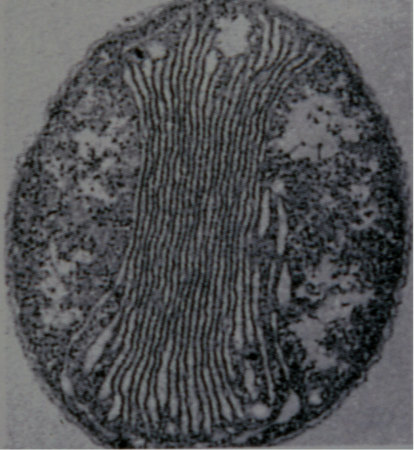
Figure 4. Vue en microscopie électronique à transmission d'une bactérie chimiolithotrophe exploitant le NH4+
Ici, une bactérie de la nitrification, Nitrobacter winogradskyi ; diamètre : 5 µm. Noter les saccules membranaires internes, semblables à des thylakoïdes, où s'accumulent des protons. Les chaînes de transfert d'électrons sont situées dans leurs membranes.
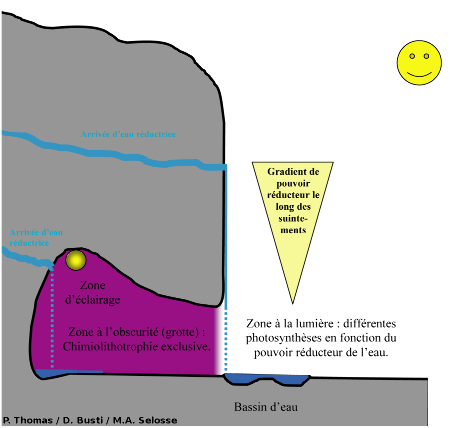
La chimiolithotrophie est donc possible à chaque fois qu'il y a une interface entre un milieu réducteur et un milieu oxydant. À Saint-Nectaire, comme à la source de la Tête de Lion, des remontées d'eaux chaudes chargées en molécules et ions réducteurs (H2S, Fe2+, Cr3+) entrent en contact avec l'oxygène de l'air. Cette interface constitue une niche écologique potentielle pour l'installation de bactéries chimiolithotrophes (Fig. 5). De plus, dans les zones éclairées, divers organismes photosynthétiques peuvent s'installer.
Notez qu'un gradient de pouvoir réducteur se met en place le long des zones de suintements.
Grotte du Cornadore (Station 1)
En entrant dans la grotte par le haut, on aboutit à une salle obscure où on observe les premiers suintements d'eau. L'eau qui coule le long des parois est fortement minéralisée (elle est riche en ions Ca2+, HCO3-, Fe2+, avec des traces de Cr3+), gazeuse (beaucoup de CO2, un peu de H2S), tiède (température moyenne de 22°C) et légèrement acide (pH = 6,6). Si on la goûte, elle est d'abord piquante (à cause du soufre) et pétillante (à cause du CO2 dissous), puis elle laisse un goût de fer au fond de la bouche. Le H2S donne à cette eau une odeur d'œuf pourri très caractéristique.
Outre les concrétions de carbonate de calcium (stalactites, stalagmites, gours…), de nombreux autres dépôts sont visibles :
- Dépôts d'oxydes ferriques (fer III, Fe2O3), de couleur jaune-orange (lorsqu'il est présent en faible quantité) à rouille (lorsqu'il est présent en forte quantité, au niveau des écoulements d'eaux réductrices), provenant de l'oxydation des ions Fe2+ en Fe3+ qui, plus insolubles, précipitent (Fig. 6 et 7) ;
- Dépôts jaunes riches en oxyde chromique (CrO3) provenant de l'oxydation des ions Cr3+ en Cr6+ (Fig. 6) ;
- Précipités blancs de sulfate de calcium (CaSO4, nH2O), provenant de l'oxydation du soufre (S ou H2S) en ions sulfates SO42-, puis de leur précipitation en présence de Ca2+ (Fig. 7 et Vidéo 1).
La couleur jaune-orange le long des zones d'écoulement résulte du dépôt de petites quantités d'oxyde de fer dans les précipités de carbonate de calcium par des biofilms bactériens.
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Vidéo 1. Précipités digités de sulfate de calcium.
Ces dépôts résultent de l'activité de bactéries chimiolithotrophes qui oxydent les substances réductrices (H2S, S, ions ferreux ou « chromeux »), en utilisant l'oxygène atmosphérique, puis s'encroûtent et meurent. Les bactéries vivantes forment en effet une mince pellicule (biofilm) à la surface des concrétions, au contact direct avec les substances nutritives sans cesse renouvelées par l'afflux d'eau. Dans cette mince couche, leur métabolisme libère des ions qui précipitent sous forme de dépôts d'oxyde de fer III, d'oxydes de chrome ou de sulfate de calcium, qui les emprisonnent progressivement. De plus, l'utilisation de CO2 par le cycle de Calvin entraîne une précipitation de CaCO3 : il s'agit d'un fonctionnement en stromatolithes, rappelant celles à cyanobactéries (Vidéo 2). Les bactéries ainsi piégées dans ces dépôts n'ont plus accès aux substances réductrices puis meurent. Celles qui restent en surface poursuivent le processus d'accrétion et il se construit dans la roche des lamines successives. On note au passage que les stromatolithes ne se forment pas qu'à la lumière : ce sont seulement des indicateurs de consommation de CO2, donc d'une autotrophie au carbone, qui a lieu à l'ombre ici.
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Vidéo 2. Stromatolithe à bactéries chimiolithotrophes.
Enfin, dans les rares parties de la grotte éclairées par des ampoules, un film vert-bleu est présent. Ce film est dû à la présence de Cyanobactéries dont les pigments (phycobilines et chlorophylle a) donnent cette couleur caractéristique (la chlorophylle donne la couleur verte, la phycocyanine une couleur bleue). (Vidéo 3)
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Vidéo 3. Film cyanobactérien à proximité d'une source de lumière artificielle.
Paroi éclairée par la lumière naturelle (Station 2)
En poursuivant la visite, on longe une paroi éclairée par la lumière naturelle (Fig. 8 pour une vue d'ensemble). Une zonation par couleur peut s'observer le long de certains suintements (Vidéo 4) :
- À proximité des points d'émergence de l'eau réductrice (qui arrive par le haut de la paroi), où la concentration en substance réductrice est donc forte, on retrouve les précipités de sulfate de calcium liés à l'activité de bactéries chimiolithotrophes qui oxydent le soufre (Fig. 9 et 10), voire des précipités de fer oxydés ;
- Dans des zones éloignées de ces points d'émergence, avec une concentration en substances réductrices faible, une ceinture de couleur bronze à brune plus ou moins large apparaît. Cette ceinture correspond au développement de Diatomées (ou Diatomophytes, un groupe d'Hétérocontes proches des algues brunes possédant des plastes riches en caroténoïdes, dont la fucoxanthine qui explique la couleur bronze observée). (Fig. 8-10) ;
- Entre ces deux dernières zones, pour des concentrations en substances réductrices intermédiaires mais encore assez fortes, un liséré vert-bleu est systématiquement observé. Il correspond à l'installation de Cyanobactéries (Fig. 9 et 10) ;
- Enfin, dans les zones les plus en aval dans le sens de l'écoulement, et plus à l'extérieur, on voit apparaître majoritairement des algues vertes. Elles se développent dans les zones où les concentrations en ions sont les plus faibles.
Il est à noter que les divers groupes d'algues cités sont présents un peu partout, mais que, dans chaque zone, un groupe domine et confère la couleur.
Figure 8. Paroi éclairée par la lumière naturelle | Figure 9. Zonation des communautés Bactéries sulfoxydantes (en haut, au niveau du surplomb), cyanobactéries (liseré bleu-vert) et diatomées (en bas) |
Figure 10. Zonation des communautés : détail Zone à bactéries sulfoxydantes (couleur blanche, en haut), à cyanobactéries (liseré bleu-vert) et à diatomées (couleur brun-bronze). | |
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Vidéo 4. Ceintures colorées observées le long d'une paroi éclairée par la lumière naturelle.
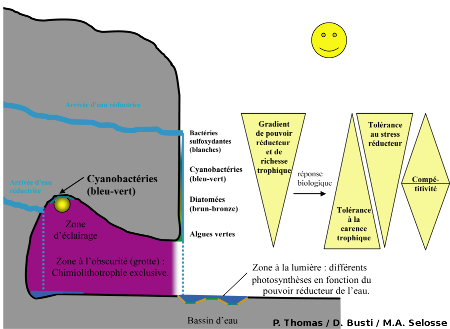
La zonation qui vient d'être caractérisée peut s'interpréter comme suit :
- Dans les points d'émergence de l'eau réductrice, la très forte concentration en substances réductrices rend la chimilitotrophie plus efficace que la photosynthèse. La chimiolithotrophie y est donc prépondérante ,
- Dans les zones dont les eaux ont déjà été partiellement oxydées (donc moins riches en éléments réducteurs), la photosynthèse cyanobactérienne devient prépondérante. Cela peut s'expliquer par le fait que les substances réductrices détruisent le complexe à manganèse du photosystème II (PS II), si bien que la photosynthèse oxygénique ne peut avoir lieu. Ceci se produit sporadiquement, lorsqu'à la suite d'une hausse du débit le pouvoir redox change transitoirement. Seules les Cyanobactéries peuvent s'installer car elles sont capables de réaliser la photosynthèse anoxygénique grâce à une enzyme équivalente de la plastoquinone végétale, la sulfure quinone réductase (Fig. 11). Cette enzyme réduit H2S en soufre (S) et alimente la chaîne de transporteurs cyclique des électrons ;
- Dans les zones d'émersion, encore moins riches en éléments réducteurs, la photosynthèse oxygénique peut s'installer (le photosystème II est fonctionnel). C'est la concentration en substances nutritives qui déterminera le type d'organismes photosynthétiques rencontré : diatomées dans les milieux riches (compétitives dans les milieux eutrophes, en amont du flux d'eau) et algues vertes, moins exigeantes, dans les milieux plus pauvres (survivent en l'absence de compétition des Diatomées dans les milieux oligotrophes, en aval du flux d'eau).
PS I, photosystème 1 ; PS II, photosystème II.
Bassin d'eau (Station 3)
Un peu plus loin, un bassin d'eau récupérant les suintements s'écoulant le long de la paroi a été aménagé (Fig. 12). On observe dans le sens d'écoulement de l'eau, une zonation semblable à celle observée le long de la paroi éclairée (Fig. 13 et Vidéo 5) :
- Dans les zones d'écoulement fort et au fond du bassin, on note la présence de bactéries chimiolithotrophes ou d'une couverture bleu-vert liée à la présence de Cyanobactéries. Ici, l'abondance de H2S ne permet pas la photosynthèse oxygénique.
- Dans les zones d'écoulement faible et dans les zones plus élevées, prédominent les Diatomées. La plus faible concentration en réducteurs permet alors la photosynthèse.
Dans les zones où l'eau est stagnante (par exemple au niveau d'un gour), les algues vertes prolifèrent, le milieu étant moins riche.
De même que précédemment, la photolithotrophie prédomine en présence de lumière, mais à conditions que la concentration en réducteurs ne soit pas trop forte. Quand la concentration en réducteurs est trop forte, la chimiolithotrophie est prépondérante.
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Vidéo 5. Zonation au niveau d'un bassin d'eau.
Figure 13. Zonation dans un petit chenal d'écoulement Dans le sens d'écoulement de l'eau, on observe des précipités de sulfates et de fer (à l'exutoire, vers le haut de la photo), puis une zone à cyanobactéries d'un vert bleuté, avec des Diatomées autour et vers l'aval (vers le bas de la photo). |
Captage d'eau à l'abri de la lumière (Station 4)
En terminant la visite de la grotte, approchons-nous d'une canalisation qui filtre l'eau ravitaillant les cascades utilisées pour la pétrification d'objets. En ouvrant la canalisation, on observe sur la sciure de bois assurant le filtrage de l'eau afin que les objets pétrifiés soient seulement calcifiés. On observe ici une zonation des dépôts liés à l'activité de bactéries chimiolithotrophes (Fig. 14 et Vidéo 6) :
Des encroûtements de couleur rouille prédominent dans le haut de la canalisation : il s'agit de dépôts d'oxyde de fer liés à la présence de bactéries ferroxydantes qui oxydent le Fe2+ en Fe3+ (Fig. 15). La réaction d'oxydation peut être représentée comme suit (avec no = nombre d'oxydation) :
Des encroûtements blancs dus à l'activité de bactéries sulfoxydantes sont également visibles. En amont de la canalisation, on observe parmi les ferroxydantes des filaments blancs très discrets d'une bactérie qui oxyde le H2S en soufre S (Fig. 16). Plus en aval, on retrouve des précipités blancs de sulfate de calcium dus à la présence de bactéries qui oxydent le soufre S en SO42- (sulfates, Fig. 17). Les deux réactions d'oxydation peuvent être représentées comme suit (avec no = nombre d'oxydation) :
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Vidéo 6. Dépôts liés à l'activité de bactéries chimiolithotrophes le long d'une canalisation.
Nous constatons une fois de plus que la chimiolithotrophie prédomine en absence de lumière (que la canalisation permet d'assurer tout en permettant l'observation). Nous pouvons proposer que la zonation des dépôts résulte de la mise en place de gradients de concentration en composés réducteurs liés au métabolisme bactérien, et de la compétition entre bactéries. L'eau réductrice qui arrive, riche en Fe2+ et H2S, permet d'abord l'installation de bactéries ferroxydantes et de bactéries oxydant le H2S dans le haut de la canalisation. En aval de la canalisation, l'eau s'appauvrit donc progressivement en Fe2+ et H2S mais s'enrichit parallèlement en Fe3+ et S. D'où les dépôts moins importants d'oxyde de fer et l'installation de bactéries sulfoxydantes utilisant le soufre S, seules à pouvoir se développer à présent, dans le bas de la canalisation.
La zonation observée et les gradients physico-chimiques mis en place dépendent du rendement du type de métabolisme chimiolithotrophe. Ainsi, le fait que les bactéries ferroxydantes bénéficient d'une chute de potentiel plus importante que les bactéries oxydant le soufre atomique pourrait expliquer la prédominance des bactéries ferroxydantes et oxydant H2S dans le haut de la canalisation. L'intensité du gradient de proton produit dépend en effet de cette chute de potentiel redox (Fig. 3) : ces bactéries, au métabolisme énergétique plus rentable, élimineraient les bactéries oxydant le soufre S par compétition. Lorsque la concentration en Fe2+ devient moins importante (dans le bas de la canalisation), les bactéries ferroxydantes ne peuvent plus se développer et laissent la place aux bactéries sulfoxydantes oxydant S et qui se développent à la faveur de concentrations en soufre atomique restées élevées (Vidéo 7).
Source - © 2007 Marc-André Selosse / O. Dequincey pour Planet-Terre - ENS de Lyon
Vidéo 7. Compétition entre bactéries ferroxydantes et bactéries sulfoxydantes.
Pour ceux qui voyagent, cette zonation (dépôts rougeâtres puis blanchâtres) se retrouve sur les rochers des rivières drainant des volcans actifs (à la Guadeloupe par exemple) et résultent du même phénomène.
Zonation des algues le long d'un ruisseau (Station 5)
À l'extérieur de la grotte, le long d'un ruisselet bordant une petite route (Fig. 19), des eaux fortement minéralisées semblables à celles de la grotte, permettent encore d'observer une zonation, mais cette fois-ci à la lumière. Dans les zones où les fortes concentrations (au moins temporaires) en substances réductrices ne permettent pas toujours la photosynthèse oxygénique (en haut du ruisseau), les Cyanobactéries s'installent (Fig. 18). Au fur et à mesure que l'on descend, la communauté s'enrichit en diatomées puis en algues vertes qui deviennent progressivement dominantes (Fig. 20).
Cela peut s'interpréter par l'appauvrissement de l'eau en substances réductrices (les Cyanobactéries réussissent en présence de pouvoir réducteur), mais aussi par compétition. Plus compétitives en eau riche, les Diatomées excluent les Cyanobactéries (dès que le milieu n'est pas réducteur) et les algues vertes. Les eaux d'aval, appauvries par le prélèvement des algues d'amont, mais appauvries en substances réductrices, sont peuplées d'algues vertes qui supportent les eaux plus pauvres.
Source la Tête de Lion (Station 6)
Comme au Cornadore, l'eau de la source de la Tête de Lion (Saint-Floret, 63) est fortement minéralisée (Ca2+, HCO3-, Fe2+) et gazeuse (beaucoup de CO2, un peu de H2S). En aval de la source, des organismes photosynthétiques fixent le CO2, font précipiter le calcaire, s'encroûtent, puis sont régulièrement remplacés : il se forme alors un tuf fonctionnel ou travertin (Fig. 21 et article sur les aspects géologiques de ces sources).
Le travertin accumulé ressemble à quelque tête fabuleuse : dans son livre sur Les eaux minérales du centre de la France, H. Lecoq (1865) écrit que le visiteur « croirait voir la tête d'un animal monstrueux s'avancer et vomir l'eau ». Le site, aménagé par le Conservatoire des Espaces et des Paysages d'Auvergne, est aussi appelé source de la Tour Rambaud, du nom d'une ruine médiévale proche.
Figure 21. Source de la Tête de Lion
La couleur bronze est due aux oxydes fer, et à des revêtements de Diatomées.
La couleur rouille de la source et de l'amont de son exutoire (Fig. 22 et Fig. 23) est due à la présence de bactéries ferroxydantes oxydant les ions Fe2+.
Figure 23. La source principale de la Tête de Lion Le massif de travertin calcaire se trouve à 20 m en aval. Noter l'absence totale de cyanobactéries ou d'algues dans la source et dans le ruisseau qui s'en échappe. |
L'aspect luisant et irisé de l'eau en surface à quelques mètres en aval de la source n'est pas due à des pollutions de mazout ou à des matières grasses mais à la présence d'un film d'oxydes ferriques déposé en surface par des bactéries ferroxydantes planctoniques (Fig. 24 et 25). L'irisation est liée aux oxydes de fer.
Figure 24. Irisation de la surface de l'eau du ruisseau à 3 m en aval de la source principale Cette irisation est due à la présence d'un film de fer ferrique issu du fonctionnement de bactéries planctoniques. Notez les bulles de CO2 qui sont libérées lors du dégazage. | Figure 25. Détail du film Il s'agit d'une mince pellicule de fer ferrique issu de bactéries planctoniques ferroxydantes. |
Bien que la source elle-même et les premiers mètres du ruisseau qui s'en échappe soient en pleine lumière, cyanobactéries et algues photosynthétiques sont absentes. La forte concentration en Fe2+ (et éventuellement en H2S, mais cette molécule semble ici plus rare – il suffit de goûter l'eau !) rend probablement la chimiolithotrophie plus efficace que la photosynthèse. De plus, la forte concentration en réducteurs a sans doute un effet toxique pour les organismes à photosynthèse oxygénique. La photosynthèse apparaît cependant avec des cyanobactéries à 3-4 m en aval (Fig. 26), sans doute quand la concentration en réducteurs a diminuée. Diatomées et algues vertes apparaissent encore plus loin, au niveau de la cascade de travertin (Fig. 21).
Conclusions
L'ensemble des observations menées sur ces deux sites montre une zonation des bactéries et des algues en réponse à un gradient de pouvoir réducteur et de richesse trophique (Fig. 27). Pour les fortes concentrations en substances réductrices, la chimiolithotrophie domine alors que, pour les faibles concentrations, la photolithotrophie devient possible, à condition qu'il y ait de la lumière. Le métabolisme des bactéries et des algues est également à l'origine d'un gradient de richesse trophique, les eaux fortement minéralisées s'appauvrissant progressivement en éléments réducteurs (prélevés par les bactéries) et en ions biogènes (piégés sous forme de précipités avec le refroidissement des eaux, ou assimilés par les organismes).
Deux stratégies écologiques majeures sont illustrées par ces observations : la tolérance au stress (stratégie S) et la compétitivité (stratégie C). Pour les organismes photosynthétiques, plus l'on se rapproche du point d'émergence de la source d'eau réductrice, plus la tolérance aux fortes concentrations en substances réductrices augmente (zone à Cyanobactéries). Lorsque l'on s'en éloigne, le milieu s'appauvrit en nutriments et plus dominent les algues vertes, tolérant les milieux les plus pauvres. Entre deux, dans un milieu favorable riche et non trop réducteur, se développent les organismes les plus compétitifs : les Diatomées. Cyanobactéries et algues vertes pourraient théoriquement vivre là où vivent les Diatomées mais en sont exclues par compétition. Les Diatomées ne pourraient quant à elle se contenter des autres milieux. Il faut y voir un investissement des ressources et une adaptation fonctionnelle optimisant soit les mécanismes de tolérance au stress, soit les mécanismes de compétitivité (vitesse de croissance élevée et monopolisation des ressources, utiles en milieu riche seulement). Ces stratégies sont des exclusives car elles ont toute deux un coût et les organismes, ne disposant que de ressources finies, ne peuvent optimiser les deux simultanément. On retrouve cela à l'ombre, entre bactéries chimiolithotrophes : dans la canalisation les bactéries les plus compétitives dominent en amont et sont remplacé par des bactéries tolérantes au stress dans les milieux pauvres en réducteurs, rejetées à l'aval.
La compétition joue aussi sur la répartition des chimiolithotrophes et des photolithotrophes, souvent en faveur des seconds : en présence de lumière, quand le milieu n'est pas trop réducteur, on observe une plus forte compétitivité des photolithotrophes. Ceci s'explique par deux raisons. D'abord le rendement de la photolithotrophie (rapport énergie lumineuse absorbée / énergie chimique dans les molécules organiques) est de 10 à 30 % alors que le rendement de la chimiolithotrophie (rapport énergie issue de l'oxydation des molécules / énergie chimique dans les molécules organiques) est de 5 à 10 % : ce moindre rendement s'explique par des déperditions énergétiques au long des nombreuses conversions énergétiques de ce métabolisme (Fig. 3). Deuxièmement, ce métabolisme requiert une grande quantité de substrats à réduire. On rencontre également la chimiolithotrophie au niveau des fumeurs noirs et dans les sols (nitrification), où la lumière est absente et où les concentrations en réducteurs sont plus fortes.
La chimiolithotrophie est un métabolisme très varié d'une bactérie à l'autre (comme en témoigne la diversité des réactions vues ici). Elle illustre l'extraordinaire diversité métabolique des bactéries, qui s'oppose à la faible diversité (photosynthèse et respiration ou fermentation) décrite chez les Eucaryotes. Elle assure une adaptation métabolique à des conditions de vie très variées et ce sont ces métabolismes qui contribuent à faire tourner les cycles des éléments (ici, fer, carbone et soufre au moins !).
Enfin, la succession spatiale des communautés bactériennes et d'algues (toposéquence) observées le long des suintements (grotte) ou des courants d'eau (canalisation, ruisseaux) illustre la succession temporelle de ces mêmes communautés (chronoséquence) lors d'un processus de colonisation. En effet, l'installation d'une communauté modifie le milieu, ce qui favorise l'installation de la communauté suivante, par un processus de favorisation. Par exemple, en condition de pleine lumière, l'installation initiale des bactéries chimiolithotrophes diminue la concentration en substances réductrices dans le milieu et autorisera l'installation de communautés photolithotrophes. À l'inverse, en condition d'obscurité, l'installation initiale de bactéries chimiolithotrophes peut modifier le milieu et le rendre favorable à l'installation de bactéries chimiolithotrophes différentes, comme nous l'avons observé le long de la canalisation. On observe donc un effet en retour (feedback) des organismes sur le milieu. Dans les exemples vus ici, cependant, cette succession écologique est bloquée par un facteur du milieu. Par exemple, l'absence de lumière empêche l'installation des cyanobactéries ou des algues dans la grotte dans les zones où la concentration en réducteurs est faible. De même, le maintien d'une concentration en substances réductrices trop élevée au niveau des sources rend impossible l'installation des diatomées et des algues vertes dans les zones de pleine lumière.
Ces observations auvergnates permettent donc à loisir d'évoquer divers concepts d'écologie, de métabolisme des microorganismes, et d'évoquer les cycles de la matière… Leur mérite majeur est de mettre de la couleur sur nos vieux cours d'écologie microbienne et sur le monde peu visible des bactéries. Un complément en salle de TP, avec l'observation des différents biofilms, démontrera la nature des communautés observées et aura un succès garanti, devant l'immense diversité des organismes en présence. Mais c'est une autre histoire !
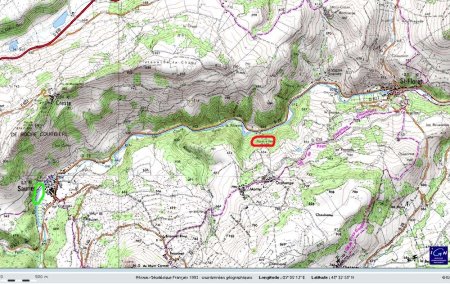
Localisation des lieux étudiés
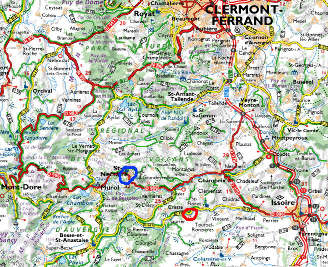
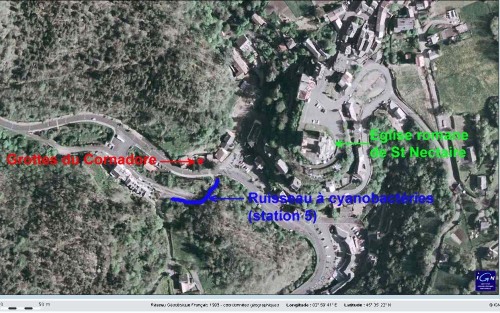
Les figures suivantes permettent de localiser les deux sites auvergnats cités ici : Saint Nectaire et ses grottes du Cornadore d'une part, la source de la Tête de Lion d'autre part. Nous ne localisons pas (sur plan précis) les Grottes du Cornadore, fléchées et situées au centre de Saint nectaire, mais la position relative grotte/station 5. La source de la Tête de Lion se situe dans la commune de Saint Floret (63), en pleine forêt. Elle est sommairement aménagée et signalée par un panneau.