Article | 01/03/2023
La sédimentation dans un lac carbonaté étudiée par la chimie des eaux : exemple du lac du Bourget
01/03/2023
Résumé
Fonctionnement du système carbonate dans un lac au fil des saisons. Effet d’un lac carbonaté sur le bilan d’export de carbonates à l’échelle du bassin versant.
Table des matières
Introduction
Les lacs carbonatés sont des lacs dont les eaux contiennent surtout des ions calcium, Ca2+, et hydrogénocarbonate (ou bicarbonate), HCO3−.
Leurs sédiments sont essentiellement des calcaires (CaCO3) résultant pour une part importante d'une précipitation de carbonate de calcium au sein du lac. Cette précipitation au sein du lac correspond d’une part à des réactions purement chimiques et d'autre part à des processus faisant intervenir des organismes vivants. Certaines réactions atteignent immédiatement l'état d'équilibre, d'autres non, et l'ensemble constitue ce que l'on appelle le « système carbonate ».
Pour comprendre la sédimentation dans un tel lac, une étude des substances dissoutes et des réactions auxquelles elles participent est nécessaire. On présente ici une telle étude dans le lac du Bourget.
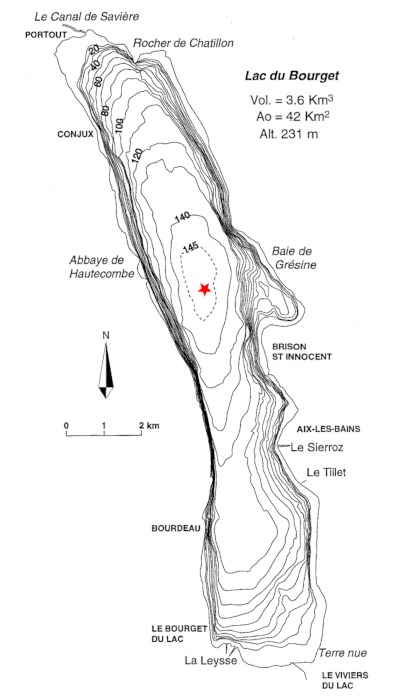
Le lac du Bourget, présentation générale
Situé en Savoie à 231 m d'altitude, le lac du Bourget est le reste d'un plan d’eau d'origine glaciaire plus vaste. Il reçoit trois affluents : la Leysse au Sud, le Sierroz et le Tillet à l'Est. Le canal de Savière, au Nord, en constitue l'exutoire.
Source - © 1999 D’après Emmanuel Chapron
Figure 1. Carte bathymétrique du lac du Bourget
L'étoile rouge indique le site de prélèvement.
Les principales caractéristiques morphométriques du lac sont assemblées dans le tableau 1.
Tableau 1. Principales caractéristiques du lac du Bourget
Superficie | 42 km2 |
Volume | 3,6 km3 |
Profondeur maximale | 145 m |
Profondeur moyenne | 80 m |
Longueur | 18 km |
Largeur maximale | 3 km |
Temps de résidence de l'eau* | environ 10 ans |
Superficie du bassin versant | 560 km2 |
* Le temps de résidence de l'eau est le rapport du volume du lac sur la somme des arrivées d'eau (affluents, pluie), somme qui est égale à celle des départs (exutoire, évaporation) car le lac a un volume constant.
Source - © 1999 D’après Emmanuel Chapron
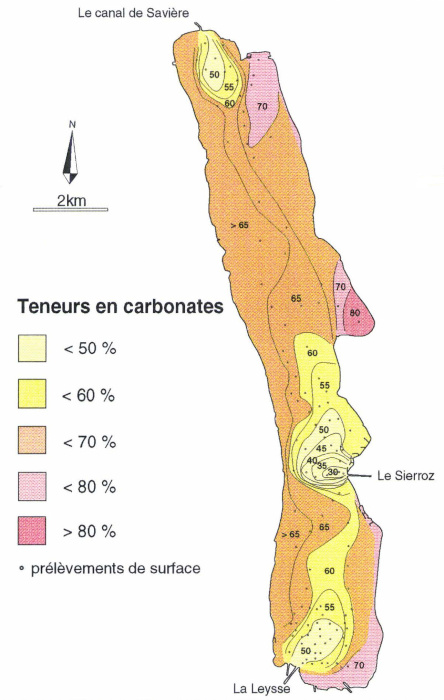
Les sédiments du lac contiennent généralement plus de 65 % de carbonates, essentiellement carbonate de calcium (figure 2) en grande partie formé au sein du lac. Les zones à plus faible teneur en CaCO3 sont à l'arrivée des affluents et contiennent des sables.
Le bassin versant actuel est surtout composé de terrains sédimentaires carbonatés datant du Jurassique supérieur au Crétacé. Ils sont partiellement recouverts par des terrains quaternaires, essentiellement issus de la glaciation du Würm.
Calcium dissout
Les dépôts sédimentaires étant principalement constitués de CaCO3 formés par précipitation au sein du lac, pour comprendre cette formation, il faut suivre le comportement du calcium et du carbonate dans les eaux du lac. Les teneurs en “carbonate” dépendent aussi des interactions avec le vivant (photosynthèse, respiration) et il faut prendre en compte les différentes espèces dissoutes.
Le comportement chimique du calcium est beaucoup plus simple que celui des carbonates et l'évolution de ses concentrations dans le temps et dans l'espace feront émerger des questions sur la structuration des masses d'eau à l'intérieur du lac.
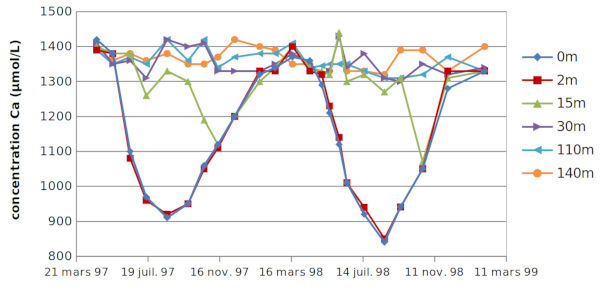
Les concentrations de calcium dissout, comme celle de tous les éléments chimiques ont été mesurées sur des prélèvements effectués avec des bouteilles que l'on ferme à la profondeur choisie. Les campagnes de prélèvement ont eu lieu une fois par mois sur une période de 2 ans.
Les concentrations varient suivant la profondeur, mais pratiquement pas dans un plan horizontal, sauf au voisinage des berges : il est admis qu'une étude sur une verticale au point de profondeur maximale donne une excellente vue d'ensemble sur la chimie du lac.
Les résultats sont présentés sur la figure 3 : les concentrations exprimées en µmol/L sont portées en fonction du temps pour différentes profondeurs.
Aux profondeurs supérieures ou égales à 30 m, les concentrations de calcium sont sensiblement les mêmes et peu variables au cours du temps. En surface (0 et 2 m), il y a une baisse importante de la teneur en calcium pendant l'été, alors que la teneur hivernale est égale à celle des eaux profondes. À la profondeur de 15 m, la concentration en calcium est semblable à la concentration en profondeur jusqu'en septembre, puis elle est égale à celle des eaux de surface à partir d'octobre. Cette évolution, très claire en 1998, l'est un peu moins en 1997, mais s’avère néanmoins similaire.
Si la diminution du calcium dissout en surface peut être liée à la précipitation de CaCO3, comment comprendre l'augmentation qui se produit à partir du mois d'aout ? En outre, si la diminution est bien due à la précipitation, pourquoi celle-ci ne se produit-elle qu'en surface et en été ?
On peut répondre à la première question en étudiant l'évolution des températures dans le lac qui est en relation avec la stratification ou le mélange des masses d'eau. La seconde sera abordée avec l'étude du comportement de ce que l'on appelle le « système carbonate ».
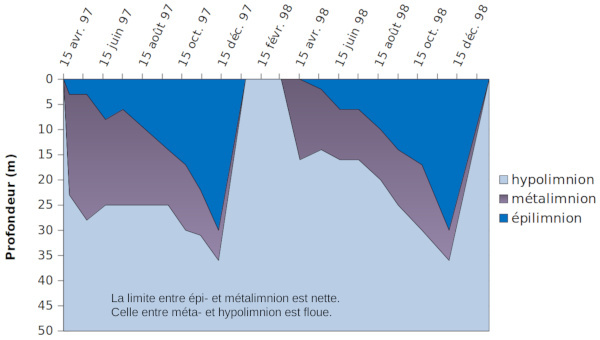
Température : stratification, retournement
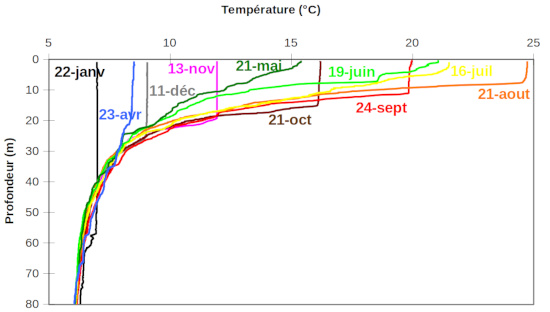
La température, de même que d'autres paramètres physiques (conductivité, turbidité), est mesurée par une sonde qui prend des valeurs en continu lors de sa descente de la surface jusqu'au fond. La figure 4 présente ces “profils” mesurés aux mêmes dates que les prélèvements d'eaux. Ces profils sont similaires en 1997 et 1998 et l'on ne présente que ceux de 1997 par souci de clarté.
Entre avril et juillet, l'eau de la surface du lac est chauffée par le soleil : elle devient moins dense, ce qui crée une stratification stable qui, peu à peu, se propage à des profondeurs croissantes. Pendant le mois d'aout, le chauffage s'est d'abord poursuivi (ou maintenu par inertie thermique), puis l’eau de surface s’est refroidie et est devenue plus dense que les eaux sous-jacentes. Il se crée une zone de mélange à température uniforme, surmontant une zone à très fort gradient de température et donc de densité. Ce phénomène va s'accentuer pendant la période de refroidissement, jusqu'à ce que la température devienne uniforme sur toute la profondeur du lac. On dit que le lac « s'est retourné ».
Il se forme ainsi, au moins à partir de juillet-aout, une zone superficielle mélangée d'épaisseur croissante (épilimnion), séparée d'une zone profonde (hypolimnion) – également à température constante – par une zone (métalimnion) où le gradient de température initialement fort diminue progressivement avec le temps.
Figure 5. Zonation du lac du Bourget dans les 50 premiers mètres
Pendant la période où le lac est homogène, la dénomination hypolimnion est théoriquement abusive : elle signifie alors que la température est la même que dans l'hypolimnion pendant les périodes stratifiées.
Le mélange des eaux est aisé dans les zones à température constante (épi- et hypolimnion), surtout dans l'épilimnion sous l'action du vent. Il est très difficile dans les zones de fort gradient de température et donc de densité (métalimnion).
En conséquence, la concentration des éléments dissouts reste constante dans l'épilimnion, quelle que soit la profondeur. Elle y varie en fonction du temps s'il se produit des réactions chimiques ou biochimiques, ou quand les eaux se mélangent avec les eaux sous-jacentes de concentrations différentes.
En septembre 1998, l'épilimnion avait une épaisseur de 12 m et ne contenait que les prélèvements à 0 et 2 m. L'eau à 15 m de profondeur, dans le métalimnion, avait une concentration de calcium plus élevée. Le 20 octobre, les 20 premiers mètres s'étaient mélangés et les 3 prélèvements (à 0, 2 et 15 m de profondeur) avaient la même teneur, intermédiaire.
Entre mai et aout, la couche d'eau à 2 m de profondeur ne s’est pas mélangée pas avec des eaux de concentration différente, la diminution observée de la concentration de calcium correspond principalement à une perte par réaction chimique : la précipitation de CaCO3.
Entre septembre et février de l'année suivante, l'augmentation des concentrations de calcium a été principalement due au mélange des eaux de surface avec des eaux sous-jacentes qui n'ont pas subi de pertes de calcium, complété par un apport par les rivières.
Système carbonate
Espèces dissoutes du système carbonate
Contrairement au calcium, présent sous l'unique forme d'ion Ca2+, les “carbonates” sont présents sous 3 formes : le CO2 dissout noté CO2,dis, l'ion hydrogénocarbonate (ou bicarbonate) HCO3−, et l'ion carbonate CO32−. Ces 3 espèces sont liées entre elles par 2 équations chimiques faisant intervenir l'ion H+ (noté aussi H3O+ – H+ + H2O) :
CO2,dis+ H2O ⇌ HCO3- + H+ ⇌ CO32- + 2 H+ .
Ces 2 équilibres acide-base sont immédiatement atteints et les 2 équations suivantes sont toujours vérifiées :
(équation 1)
(équation 2)
que l'on peut regrouper en
(équation 3).
L'ion hydrogénocarbonate, HCO3−, est généralement, et c'est particulièrement le cas ici, la forme prédominante.
Réactions avec changement de phase
Échange de gaz avec l'atmosphère
À la surface du lac, la molécule dissoute CO2,dis peut être échangée avec l'air :
CO2,dis ⇌ CO2,gaz.
À l'équilibre, la teneur en CO2 de l'air est proportionnelle à la concentration en CO2 dissous. On l'exprime en pression partielle p(CO2).
(équation 4)
La constante B croît avec la température.
Contrairement aux équilibres en solution, cet équilibre n'est pas atteint immédiatement, c'est-à-dire que la relation précédente n'est généralement pas vérifiée. On définit alors une pression partielle fictive de CO2 dans la solution.
(équation 5)
Si p(CO2)eau < p(CO2)air, , le gaz passera de l'air dans l'eau ; par contre le gaz passera de l'eau dans l'air si p(CO2)eau > p(CO2)air. On se rapprochera d'autant plus de l'équilibre que la surface du lac sera agitée par le vent.
Photosynthèse
Le CO2 dissout est le composé essentiel de la photosynthèse qui produit la matière organique de formule simplifiée CH2O :
CO2 + H2O → CH2O + O2,
réaction qu'il vaut mieux écrire, compte tenu de la forte prédominance de HCO3−,
2 HCO3− → CH2O + CO32− + O2 (équation 6).
On voit alors que la photosynthèse conduit à la formation d'ions CO32− qui pourront participer à la formation de CaCO3.
Cette réaction, réalisée par les végétaux, nécessite la présence de lumière, de CO2 et d'éléments en trace comme les nitrates et les phosphates. Elle est donc limitée aux eaux de surface. Elle ne dépend pas de l'état chimique du système carbonate.
Respiration
La respiration (ou minéralisation de la matière organique – M.O.) s'écrit, en présence d'oxygène,
CH2O + O2 → CO2 + H2O, ou bien encore
CH2O + CO32− + O2 → 2 HCO3− (équation 7).
C'est la réaction opposée à la photosynthèse ; elle nécessite la présence d'êtres vivants. Elle non plus ne dépend pas de l'état chimique du système carbonate.
La photosynthèse, nécessitant de la lumière, ne se produit qu'en surface ; dans cette zone, la respiration va minéraliser une partie de la matière organique produite, et le reste tombera dans la zone profonde où elle se minéralisera plus ou moins complètement. La modification de la chimie des eaux de surface résultera de l'excès de la photosynthèse par rapport à la respiration (photosynthèse nette). Dans l'hypolimnion, seule la respiration peut intervenir.
Précipitation / dissolution du carbonate de calcium
L'ion carbonate est impliqué dans la formation ou la dissolution du calcaire :
CO32− + Ca2+ ⇌ CaCO3.
Contrairement aux réactions de photosynthèse et de respiration, cette réaction est un équilibre chimique, qui obéit à l'équation :
(équation 8).
Le produit de solubilité Ks, qui dépend de la température, est connu et donné dans des tables. Cet équilibre n'est généralement pas atteint, mais on peut prévoir le sens de la réaction à partir de l'analyse chimique de la solution :
- si , il peut y avoir précipitation, mais la dissolution est impossible,
- si il peut y avoir dissolution, mais la précipitation est impossible.
On se contente toutefois souvent d'une analyse qualitative : une augmentation de [CO32−] augmentera la probabilité de précipitation de CaCO3.
L'analyse du système carbonate
Les espèces dissoutes ne sont pas mesurables directement. On doit passer par l'analyse de grandeurs associées, dont certaines ont un intérêt direct pour l'étude.
Alcalinité
Les ions carbonates mis à part, les autres espèces majeures présentes dans les eaux naturelles sont sous une forme unique. Ainsi le calcium est toujours sous forme d'ion Ca2+, le sulfate sous forme d'ion SO42−, etc. L'ensemble de ces ions apporte une charge globale :
(équation 9),
que l'on appelle alcalinité qui est très généralement positive dans les eaux naturelles. Comme une solution est électriquement neutre, cette alcalinité doit alors compensée par les autres charges négatives présentes dans la solution, mauis portées par des composés présents sous plusieurs formes ioniques, tels les “carbonates” :
(équation 10).
Les autres composés chimiques qui peuvent être sous différentes formes ioniques ayant des charges différentes (phosphates, silicates, ions de l'eau H+ et OH−) sont en quantités négligeables, en particulier au Bourget.
L'alcalinité est donc une grandeur liée aux ions dissouts autres que les carbonates (équation 9) et elle donne une relation (équation 10) entre les concentrations des deux ions carbonates.
On peut mesurer l'alcalinité avec grande précision par un titrage par un acide fort.
Somme des carbonates (ΣCO2)
La somme des carbonates est définie par
(équation 11).
Cette grandeur traduit les quantités de CO2 ajoutées ou retranchées par litre de solution par les réactions chimiques (dissolution et sortie de gaz, précipitation et dissolution de carbonate de calcium…) et biologiques (photosynthèse, minéralisation de la matière organique). Par exemple, si, dans une eau, la photosynthèse consomme 30 µmol de CO2 par litre, ΣCO2 diminuera de 30 µmol/L [chacune des trois espèces peut être modifiée de façon très variable suivant la composition initiale de la solution : par exemple, si l'on part d'une solution contenant 1 mmol/L de ΣCO2 et d'Alc, à 25°C, HCO3− diminuera de 39 µmol/L, CO2,dis de 8 µmol/L et CO32− augmentera de 17 µmol/L].
Les mesures de Alc et ΣCO2 associées aux relations acide-base (équations 1 et 2) permettent de déterminer les concentrations de toutes les espèces d'ions carbonates.
Ce sont les grandeurs qui sont directement affectées par les réactions (bio)chimiques ; une discussion sur l'ensemble des processus intervenant dans un milieu naturel nécessitera toujours la connaissance de ces deux quantités.
On peut mesurer ΣCO2 en introduisant, par exemple, un petit volume connu d'échantillon additionné d'un excès d'acide dans un flacon de volume connu et en mesurant le CO2 en phase gazeuse.
Mais alcalinité et somme des carbonates sont presque égales dans les eaux du lac du Bourget. Un calcul montre dans ce cas qu'une diminution de 1 % de ΣCO2 sans variation de l'alcalinité entraine une augmentation de plus de 50 % de la concentration en ion carbonate et une diminution de 40 % de celle de CO2,dis. Il en résulte une différence de pH d'environ 0,2 unité. Les analyses courantes de ΣCO2 étant affectées d'une incertitude d'environ 1 %, il est nécessaire de procéder autrement si l’on désire mesurer de faibles variations.
pH
La mesure du pH (= −log(H+)) est une mesure très habituelle, mais qui demande de grandes précautions. Il faut le mesurer à la température de l'échantillon in situ. Il faut éviter tout échange avec les gaz de l'air. La calibration de l'électrode est délicate. Mais le calcul du paragraphe précédent montre que pour les eaux du lac une mesure de pH, même à 0,05 unité près, donnera plus de précision que la mesure de ΣCO2 pour les eaux du lac du Bourget.
Alc et pH ont donc été mesurés et ΣCO2 a été calculé à partir de ces 2 mesures et de celle de la température.
Mesures au lac du Bourget
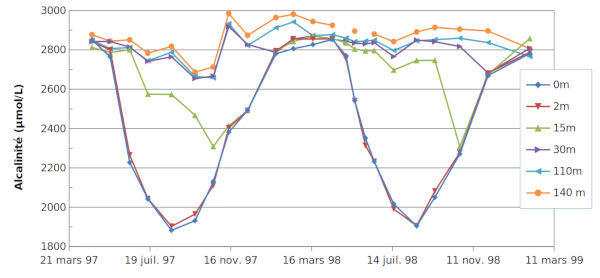
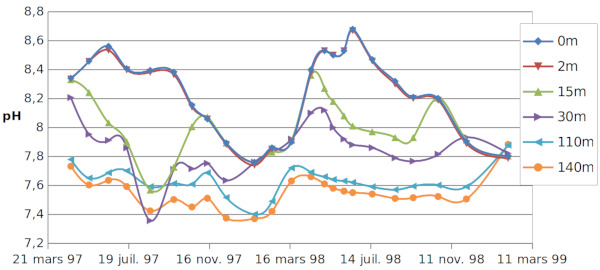
Les mesures d'Alc et de pH sont rassemblées sur les figures (6) et (7).
Les variations de l'alcalinité sont essentiellement liées aux variations de concentration de l'ion Ca2+ (cf. équation 9), dues à la précipitation (ou dissolution) du carbonate de calcium ou aux mélanges avec les eaux plus profondes. Elles sont aussi, dans une moindre mesure, associées aux variations de concentration de nitrates, qui sont impliqués dans la photosynthèse (la M.O. contient toujours de l'azote provenant de l'assimilation des nitrates). Les autres espèces majeures ont des concentrations constantes.
En surface, le pH est assez voisin de 8, valeur à laquelle HCO3− est très dominant et les teneurs en CO2,dis et CO32− sont petites et similaires. Au fond, le pH plus faible indique une valeur plus élevée de [CO2,dis]. Ces constatations vont être confirmées par le calcul.
Calcul de ΣCO2
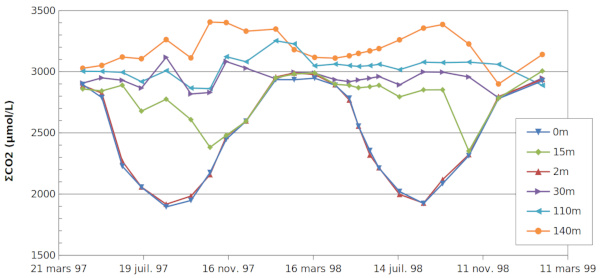
Les relations (1), (2) et (10) et les données des figures 6 et 7 permettent de calculer les concentrations des 3 espèces dissoutes CO2,dis , HCO3− , CO32− et par suite ΣCO2.
Les variations de ΣCO2 représentent les quantités gagnées ou perdues au profit de la matière vivante (par photosynthèse ou respiration) et du carbonate de calcium.
Aux faibles profondeurs, les valeurs et leurs diminutions sont sensiblement le double de celles du calcium (voir figure 3). La précipitation (ou la dissolution) de la calcite faisant intervenir 1 Ca pour 1 carbonate, cela signifie que l'autre carbonate est utilisé par une autre réaction : la photosynthèse ou la respiration.
Identifications des réactions
Réactions dans l'épilimnion : photosynthèse et précipitation de calcaire
Mise en évidence de ces 2 réactions
Ces deux réactions font intervenir de façon différente alcalinité et somme des carbonates.
La précipitation d'une unité (par exemple, 10 µmol par litre d'eau) de CaCO3 fait baisser ΣCO2 d'une unité et l'alcalinité de 2 unités. La consommation d'une unité de CO2 par la photosynthèse fait baisser ΣCO2 d'une unité et augmenter légèrement l'alcalinité car elle consomme environ 0,1 unité de NO 3−, ce qui fait croitre Alc de 0,1 unité.
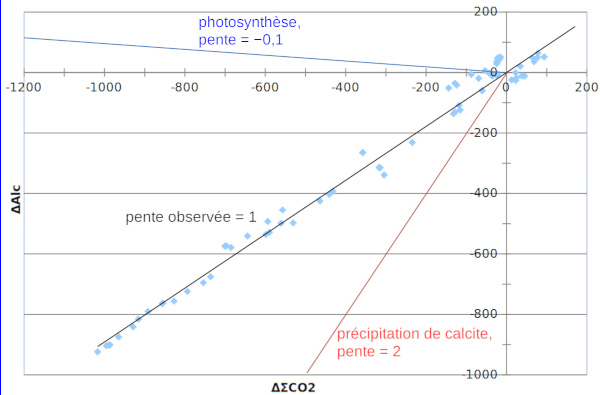
Les “déficits” de ΣCO2 et d'Alc dans les tous premiers mètres du lac peuvent être estimées en comparant leur concentration à celle mesurée à 30 m de profondeur (ΔΣCO2 et ΔAlc), profondeur à laquelle leur valeur est peu dépendante du temps (figure 9).
En première approximation, les points représentatifs des eaux du lac définissent une droite dont la pente est voisine de 1 ; ceci signifie que photosynthèse et précipitation de calcite se produisent en proportions constantes et pratiquement égales.
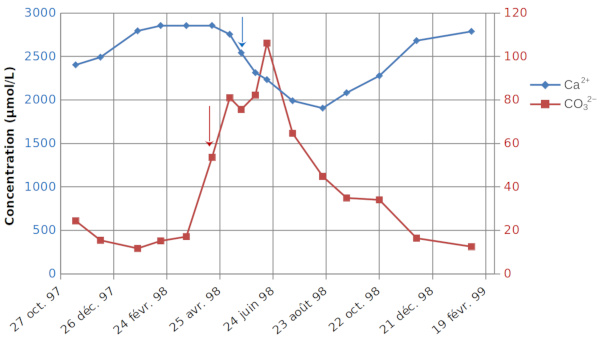
Mais comme discuté plus haut, de faibles variations de ΣCO2 et Alc peuvent entrainer de fortes variations des ions CO32− ; la figure 10 le met en évidence. Il y a pratiquement un facteur 10 entre la valeur maximale (106 µmol/L en juin 1998) et la valeur minimale (11 µmol/L en janvier de la même année) à 0 et 2 m de profondeur.
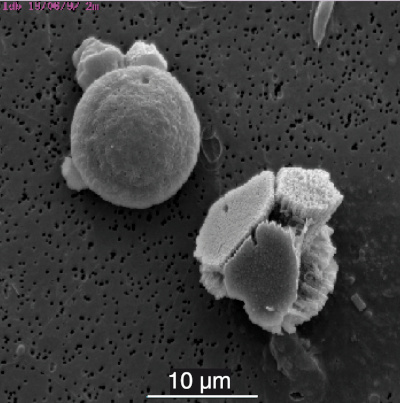
La photosynthèse débute avec le printemps, entre le 18 mars et le 16 avril, ce qui est mis en évidence par l'augmentation des ions CO32−– le 16 avril (flèche rouge sur la figure 10), augmentation qui va initier la précipitation de la calcite. L'initiation de cette précipitation, qui débute le 6 mai (flèche bleue sur la figure 10), sera favorisée par la présence de surfaces solides (principalement coquilles d'organismes végétaux constituées de calcaire comme les Phacotus, mais aussi de silice – Diatomées), qui servent de noyaux de cristallisation.
Figure 11. Cristal de carbonate de calcium (calcite) |
Estimation des quantités précipitées
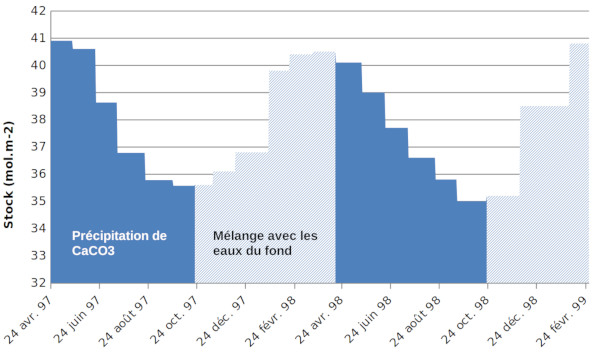
Avec les concentrations de Ca mesurées, que l’on peut compléter par une corrélation avec les mesures de conductivité, on peut calculer le stock de calcium (par exemple, dans une colonne d'eau de 1 m2 de section). L’avantage de la méthode par mesures de conductivité est que celles-ci peuvent être menées avec un pas plus serré.
La diminution du stock entre avril et octobre est liée à la précipitation de calcaire. La quantité totale précipitée pour une année est d'environ 5 mol.m−2.
Comme, d'après la carte de la figure 2, cette précipitation a lieu sur toute la surface du lac, (4.107 m2) une estimation de la quantité précipitée conduit à 2.108 mol sur l'ensemble du lac, soit 20 000 tonnes de CaCO3.
La croissance du stock dissout après le mois d'octobre est due au mélange avec les eaux profondes plus riches en Ca. Compte tenu des apports par les rivières et des sorties de calcium par l'exutoire plus faibles pendant la période stratifiée, le stock se reconstitue pendant l'hiver et on repart sur un stock sensiblement égal à celui de l'année précédente.
Réaction dans l'hypolimnion : minéralisation de la matière organique
En dessous de 30 m, les concentrations en espèces carbonate varient peu en fonction du temps, mais certaines changent avec la profondeur. Le tableau 2 présente les concentrations moyennes en ΣCO2 et en Ca2+, ainsi que celles en CO2,diss et les pH aux profondeurs supérieures ou égales à 30 m.
Tableau 2. Concentrations annuelles moyennes (µmol/L) de quelques espèces aux profondeurs égales et supérieures à 30 m dans le lac du Bourget
Prof. (m) | ΣCO2 | Ca2+ | pH | CO2 diss |
30 | 2945 | 1354 | 7,85 | 107 |
110 | 3037 | 1363 | 7,64 | 180 |
140 | 3195 | 1365 | 7,49 | 285 |
La concentration en ΣCO2 augmente sensiblement avec la profondeur, alors que la concentration en calcium ne varie pratiquement pas : il n'y a pas dissolution de CaCO3 dans cette zone. Par contre, l'augmentation de ΣCO2, entrainant une diminution du pH, traduit l'existence d'une minéralisation de la matière organique, celle qui a été produite à la surface du lac et qui ne s'est pas décomposée dans l'épilimnion (photosynthèse nette). Dans le sédiment, la quantité de matière organique (M.O.) est très inférieure à celle de CaCO3. Il en résulte une augmentation notable de CO2,diss dans les zones profondes.
L'enfouissement de la M.O. dans le sédiment est faible et la plus grande partie de la M.O. formée en surface s'est décomposée soit en surface (voir Respiration), soit dans l'hypolimnion.
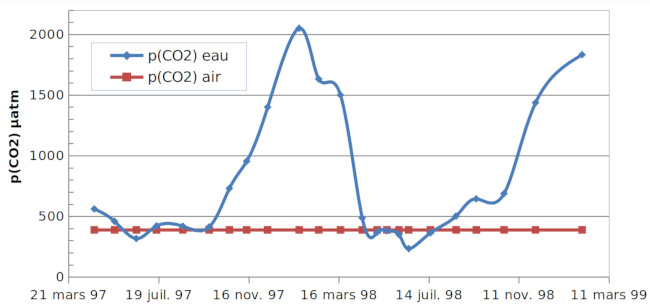
Au retournement du lac (en septembre-octobre) cet excès de CO2,diss passe dans l'eau de surface et, à l'interface avec l'air, la pression partielle dans l'eau (équation 5) devient supérieure à la pression partielle dans l'air (figure 14) et le lac dégaze du CO2.
Globalement, la solution de bicarbonate et de calcium qui arrive au lac donne naissance à CaCO3 déposé dans le sédiment pendant la période chaude et à CO2 dégazé pendant la période froide :
2 HCO3− + Ca2+ → CaCO3(solide) + CO2(gaz) + H2O.
D'où une estimation approximative de la quantité de CO2 dégazée annuellement égale à la quantité de CaCO3 déposée, soit 2.108 mol/a soit 8 000 à 9 000 tonnes de CO2 par an.
Conclusion
L'apport par les rivières affluentes de “bicarbonate de calcium” dissout résulte d'une altération en amont d'une roche calcaire par de l'eau enrichie en CO2 au contact du sol. Le lac du Bourget peut être assimilé à un réacteur biogéochimique recevant une eau riche en ions HCO3− et Ca2+ et qui, en utilisant une compartimentation temporaire en 2 sous-réacteurs, produit du carbonate de calcium qui se dépose et du dioxyde de carbone qui est envoyé dans l'atmosphère.
Le lac du Bourget n’est donc pas un simple réservoir temporaire à l’exutoire duquel les eaux auraient la même composition que les eaux entrantes. En effet, il s'oppose partiellement, à l’échelle du bassin versant, à l’export de “calcaire dissout”, en sédimentant du carbonate de calcium en son sein.