Obsolète Article | 22/01/2007
L'origine de la vie : les apports de la géologie et de l'astronomie
22/01/2007
Résumé
Les connaissances sur l'origine de la vie, d'une chimie banale à des molécules complexes aboutissant à des cellules.
Table des matières
- La vie, une "banalité" chimique vis à vis des éléments
- Les plus vieux "fossiles" sur Terre
- Le chemin théorique faisant passer des molécules organiques simples aux cellules
- La 3ème et dernière étape : des macro-molécules aux cellules
- La 2ème étape : l'origine des macro-molécules (protéines, acides nucléiques …)
- La 1ère étape : la synthèse des acides aminés, des bases azotées et autres monomères
- Conclusion générale
Cette ressource est classée “obsolète” car elle répond à au moins l'un des trois critères suivants : 1/ contenu scientifique daté, imparfait, dépassé ; 2/ contenu repris et/ou mieux expliqué dans au moins une ressource plus complète ; 3/ ressource redondante car au moins une ressource plus récente en est une mise à jour (même peu de temps après).
Dans le cas présent, au moins un article équivalent plus récent a été publié.
De tout temps, l'homme s'est posé le problème de son origine. Il y a répondu d'abord par des réponses religieuses. Puis les scientifiques ont compris que l'homme n'était qu'une espèce vivante parmi des milliards, un primate parmi d'autres primates, qui descendait d'ancêtres primates plus anciens, eux-mêmes descendant de mammifères primitifs, qui descendaient de reptiles, eux-même issus d'amphibiens, puis de chordés primitifs… et ainsi de suite jusqu'au plus vieil ancêtre commun à tous les êtres vivants, qui devait ressembler à une cellule bactérienne. Le problème de l'origine de l'homme est devenu le problème de l'origine de la vie
La vie, une "banalité" chimique vis à vis des éléments
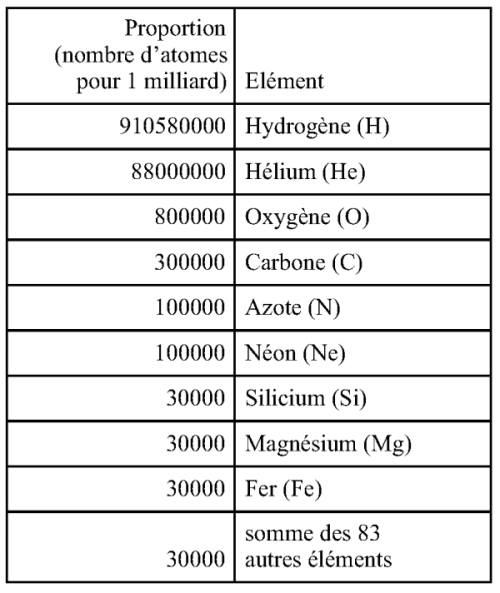
L'univers est constitué d'atomes, de 92 espèces d'atomes. Pour 1 milliard d'atomes pris au hasard dans l'univers, il y a :
L'hélium et le néon sont des gaz inertes, qui ne forment pas de molécules poly-atomiques. Au vu de l'abondance des atomes réactifs, les molécules poly-atomiques les plus fréquentes de l'univers, molécules résultant d'une combinaison d'atomes sont, dans l'ordre d'abondance (1) la molécule de di-hydrogène (H2), puis (2) la molécule d'eau (H20), puis (3) les molécules faites de 2, 3 ou 4 types d'atomes parmi H, O, C et N, puis (4) des molécules faites de Si, O, Mg, Fe. Les molécules contenant H et C, et éventuellement O, et N sont dites « organiques » ou carbonées. Les molécules faites de Si, O, Mg et Fe sont dites « silicatées » ; ce sont elles qui forment les roches, les planètes telluriques (rocheuses) comme la Terre.
La vie, quelle qu'elle soit, est une suite de nombreuses et complexes réactions chimiques. Un muscle qui se contracte, une bactérie qui se divise, un arbre qui pousse, et même Mozart qui compose un opéra, tout cela est, entre autres, une suite d'innombrables et fort complexes réactions chimiques, très loin d'être toutes identifiées et comprises. Cette complexité des réactions impose que les molécules réagissant soient elles-même très complexes. Or des molécules aussi complexes ne peuvent exister que si leur ossature est faite d'atomes tétravalents. Sur les 92 atomes présents dans l'univers, seuls deux permettent une telle complexité : le carbone et, dans une moindre mesure, le silicium. De par sa petite taille, l'atome de carbone est beaucoup plus réactif et permet une complexité beaucoup plus grande que l'atome de silicium.
Les réactions moléculaires de molécules carbonées (ou à la rigueur silicées) doivent se dérouler dans un solvant, qui peut être l'eau, mais qui pourrait aussi être le méthane (CH4), l'ammoniac (NH3) liquides... De tous les solvants, c'est l'eau qui est de loin le plus réactif.
Sur Terre la vie utilise la chimie du carbone : sucre, protéine, lipide…, tous les constituants biologiques terrestres sont à base de carbone, associé avec H, O et N. Et la vie terrestre utilise l'eau comme solvant : un corps humain par exemple, c'est 3/4 d'eau en poids. La vie terrestre utilise donc le carbone (le plus réactif et le plus abondant des 2 atomes possibles) associé à H, O et N, en solution dans l'eau, le plus abondant et le plus réactif des solvants. Utilisant les éléments chimiques les plus abondants en solution dans le solvant le plus abondant et le plus réactif, on peut dire que la vie a "choisi" la solution de facilité. Une vie au silicium et à l'ammoniac comme on en trouve dans certains romans de science fiction aurait beaucoup moins de chance d'être apparue et de s'être complexifiée qu'une vie au carbone et à l'eau.
Sur ce, ce n'est pas parce que la chimie des composés carbonés en solution dans de l'eau est une "banalité" qu'on explique comment sont apparues les réactions complexes et nombreuses qui sont à la base de la vie.
Les plus vieux "fossiles" sur Terre
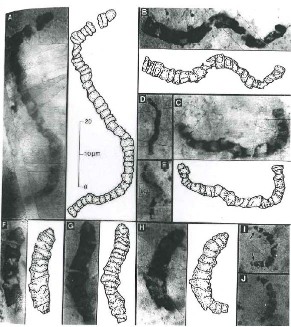
Les plus vieux fossiles connus sur Terre datent de -3,5 Ga. Ce sont des stromatolites, des traces de voiles bactériens, et même des bactéries fossiles trouvées dans des roches sédimentaires en Australie et en Afrique du Sud. Ce sont des fossiles discrets, très difficiles à trouver et à identifier, surtout pour les bactéries isolées.
Source - © 2007 Jean-François Moyen | Source - © 1993 J. William Schopf, Science, vol 260 Les formes filamenteuses ont la taille et la morphologie de cyanobactéries actuelles. |
Actuellement, les cyanobactéries sont les principaux organismes constructeurs de stromatolites, mais ce ne sont pas les seuls (il y a aussi des eubactéries "non cyano" et même des eucaryotes). Ce qui permet de caractériser formellement les cyanobactéries des autres eubactéries, c'est certes la taille (les cyanobactéries sont statistiquement plus grosses que les autres eubactéries), mais surtout des caractéristiques génétiques et métaboliques. Les possibles bactéries fossiles de Pilbara ayant la taille des cyanobactéries actuelles, on est tenté de proposer que ça en soit ; mais comme on n'a aucune idée de leur caractéristiques génétiques et métaboliques... Si on fait la proposition que ces possibles bactéries fossiles de 3,5 Ga sont bien des cyanobactéries, cela a de fortes implications. En effet, d'après des critères de phylogenèse moléculaire, les biologistes montrent que, dans le règne des eubactéries, les cyanobactéries sont tardives et très évoluées. Les bactéries primitives à l'origine de ces cyanobactéries (très évoluées) seraient donc beaucoup plus anciennes.
On connaît des sédiments plus vieux dans le monde, en particulier au Groenland, où on en trouve datant de -3,8 Ga. Mais ce sont des sédiments qui ont été pris dans la formation d'une chaîne de montagne ancienne, et qui ont été transformés, réchauffés et déformés par ces événements métamorphiques.
Source - © 1999 M.T. Rosing, Science, vol 283
Figure 4. Quatre types de roches de 3,8 Ga, Isua, Groenland
a : méta-basalte, b : méta-fer rubané, c : méta-calcaire, d : méta-grès.
Les fossiles que contenaient ces sédiments, si ils en contenaient, ont disparu à la suite de ces transformations. Mais les molécules contenues dans ces fossiles n'ont pas disparu, et les géochimistes savent reconnaître une molécule carbonée synthétisée par les êtres vivants de la même molécule synthétisée par voie abiotique. En effet, les êtres vivants séparent les isotopes du carbone. Le carbone possède 2 isotopes stables, le 12C et le 13C. Or les réactions biologiques "trient" ces 2 isotopes du carbone, et enrichissent les molécules en 12C. Dans une roche ancienne contenant du carbone, il suffit donc de voir si ce tri a eu lieu pour savoir si la vie est ou non à l'origine des molécules carbonées de cette roche. Et ce tri a bien eu lieu il y a 3,8 Ga au Groenland ; la vie semble bien y avoir été présente.
Source - © 2003 J.M. Garcia-Ruiz et al., Science 302
Figure 5. Roche sédimentaire transformée contenant du carbone riche en 12C
À gauche : vue générale de l'affleurement. À droite : lame mince de cette roche. Les points noirs sont constitués de carbone (graphite) enrichi en 12C.
Quand la vie est-elle apparue ? Avant -3,8 Ga. On ne connaît pas (pour l'instant) de roches sédimentaires (même transformées) plus vieilles que celles du Groenland. Les fossiles ou les traces chimiques des premiers êtres vivants risquent d'avoir disparu à tout jamais.
Ce que l'on sait, c'est que depuis sa formation il y a 4,5 Ga, et jusqu'à 4 Ga, la Terre a été extraordinairement bombardée d'une multitude de météorites et de comètes. Les innombrables cratères que l'on voit sur la Lune sont les cicatrices de ce bombardement intense. Ce bombardement, dont les traces ont disparu sur Terre, a vraisemblablement détruit toute vie qui serait apparue avant ou pendant, et a "stérilisé" notre planète. Il semble donc que la Terre ait été "invivable" jusqu'à -4 Ga. Et comme la vie était bien présente il y a -3,8 Ga, tout c'est donc fait entre ces deux dates, pendant ces 200 Ma fatidiques. Et 200 Ma, c'est très court à l'échelle géologique ; cela représente moins de 5% de l'histoire de la Terre.
La vie est donc apparue très vite. Et quand quelque chose apparaît vite, c'est qu'a priori, c'est "facile" à faire.
Le chemin théorique faisant passer des molécules organiques simples aux cellules
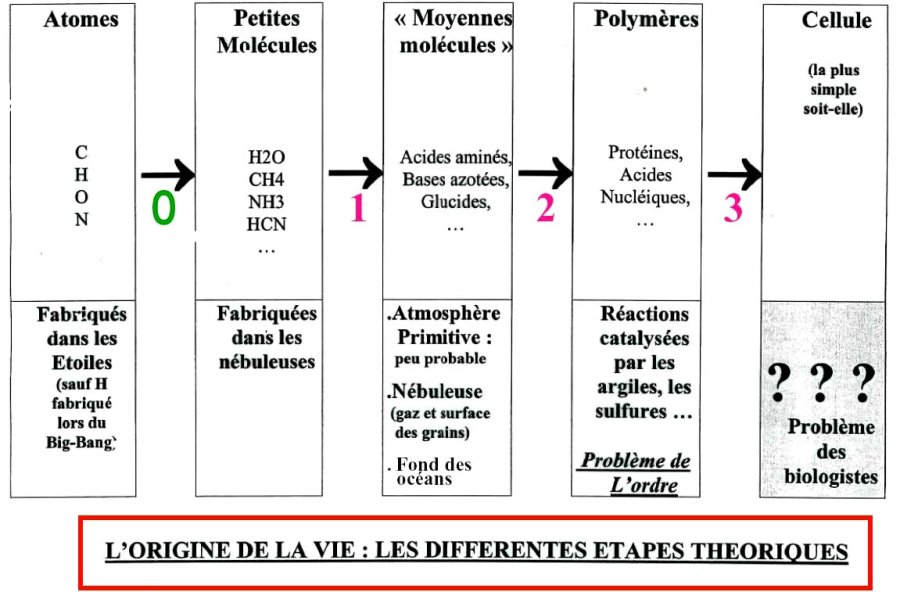
Un organisme vivant, du plus complexe et plus grand au plus simple et plus petit, est bâti de cellules, nombreuses chez les êtres pluricellulaires, unique chez les êtres unicellulaires comme les bactéries. En remontant le temps au-delà de la première cellule, on imagine qu'il a dû se dérouler 4 étapes théoriques pour aboutir à cette cellule, c'est-à-dire pour passer des atomes de C, H, O et N à la première cellule. Si l'étape la plus précoce (passer des atomes aux molécules simples comme CH4, NH3 ou H2O, nommé "0" sur la fig 5) ne pose aucun problème car elle se fait spontanément dans l'univers, les 3 étapes nécessaires qui suivent posent problèmes.
Figure 6. Les étapes théoriques de l'origine de la vie
Il y a une étape "sans problème" (l'étape 0) et trois étapes posant des problèmes, les étapes 1 à 3.
Dernière étape "à problème" (notée 3). Toutes les cellules sont faites de macro-molécules complexes, dont les principales sont les protéines et les acides nucléiques. La dernière étape précédant l'origine de la vie, c'est le regroupement-association de ces molécules complexes en une entité fonctionnelle, la cellule. Quand, comment et pourquoi ces macro-molécules se sont-elles regroupées ?
L'avant-dernière étape "à problème" (notée 2), c'est la synthèse de ces macro-molécules, les protéines et les acides nucléiques. Or ces macromolécules sont des polymères, car elles résultent de la polymérisation (regroupement) de molécules de taille moyenne, appelées monomères et dont les principaux sont les acides aminés et les bases azotées. Quand, comment, pourquoi et où ces monomères se sont-ils polymérisées ? Ces macro-molécules devaient en outre avoir des propriétés d'auto-réplication, ce qui n'est pas fréquent pour des macro-molécules.
La 1ère étape "à problème" (notée 1), c'est la synthèse de ces monomères, les acides aminés et les bases azotées. Pour synthétiser ces monomères, il faut disposer de petites molécules organiques et/ou azotées ou oxygénées comme le méthane (CH4), l'ammoniac (NH3), l'eau (H2O), le cyanure d'hydrogène (CNH)... Quand, comment, pourquoi et où ont été synthétisés acides aminés et bases azotées ?
Quelles réponses partielles apportent la géologie et l'astronomie à ce problème ?
La 3ème et dernière étape : des macro-molécules aux cellules
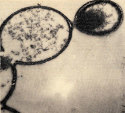
Géologie et astronomie n'apportent que bien peu d'éléments face à ce problème, surtout traité par les chimistes et les biologistes. Comment, en partant de protéines et/ou d'acides nucléiques déjà présents, "fabriquer" une cellule ? Cela n'a, pour l'instant, jamais pu être reproduit en laboratoire. Ce que l'on sait, c'est que ces macromolécules, de par leur structure moléculaire, leur charge et leurs pôles hydrophile et hydrophobe… ont tendance à se regrouper pour former des filaments, films et membranes. Ces membranes peuvent se fermer sur elles-même, isolant ainsi un milieu "intérieur" du milieu extérieur. C'est un soviétique, Oparin, qui est le "père" de ces expériences, qui ont bien sûr été continuées depuis. Ces "sacs" protéiques ont étés appelés « coacervats ».
Source - © 2007 Cornell University :
Figure 7. Un coacevat d'Oparin
Ces sacs protéiques en forme de micro-sphères peuvent avoir des échanges avec le milieu extérieur, absorber de l'eau et des petites molécules, et donc grossir, et même se diviser en 2 sacs plus petits, comme l'a montré en premier l'américain Sydney Fox dans les années 1970.
Source - © 2001 Marcello Barbieri
Figure 8. Division des micro-sphères de Sydney Fox
Mais ces structures, reproduites, complétées et étudiées à fond maintes fois depuis ces expériences historiques, sont loin d'être "vivantes" et on ne sait comment sont apparues (1) les premières réactions métaboliques et (2) les premières réplications moléculaires à la base de la reproduction, deux des propriétés qui permettent de caractériser le vivant.
Un autre problème se pose. Pour fonctionner et se reproduire, une cellule a besoin de 2 types de macro-molécules essentielles : des molécules qui font fonctionner la cellule, et des molécules qui la programment. Les molécules fonctionnelles, ce sont les protéines. Les molécules "programme", ce sont les très célèbres acides nucléiques, l'ADN et l' ARN. Mais les protéines ont besoin d'ADN ou d'ARN pour être fabriquées, et l'ADN et l'ARN ont besoin des protéines pour se dupliquer. Il y avait donc un problème de poule et d'œuf : qui des protéines ou des acides nucléiques se sont associés en premier pour former une entité cellulaire. Ce problème de poule et d'œuf a été (partiellement et conceptuellement) résolu quand on s'est aperçu que certains acides nucléiques (les ARN) avaient à la fois des propriétés de programme (elles peuvent porter un code génétique) et des propriétés fonctionnelles (elles peuvent avoir des propriétés structurantes et enzymatiques). On peut donc imaginer un « monde ARN », sans protéines, où des molécules d'ARN font tout le travail, programment et exécutent.
Mais l'existence possible de ce « monde ARN » ne résout que très partiellement le problème, et on ne sait pas quand, comment, où et pourquoi ces macro-molécules se sont regroupées en cellules fonctionnelles.
La 2ème étape : l'origine des macro-molécules (protéines, acides nucléiques …)
Face à ce problème dont s'occupent surtout les chimistes, les géologues apportent des éléments. Pour faire ces macro-molécules de protéines et/ou d'acides nucléiques, c'est théoriquement très facile. Il n'y a qu'à prendre des molécules moyennes, appelées monomères, et à les polymériser. Les monomères des protéines sont les acides aminés ; les monomères des acides nucléiques sont des bases azotées (plus des sucres et de l'acide phosphorique). Comment associer ces monomères ? La polymérisation de ces monomères est chimiquement assez spontanée, car elle ne demande que peu d'énergie si ces monomères en solution dans l'eau sont assez concentrés. Or, des substances géologiques fréquentes peuvent favoriser la concentration de monomères, et catalyser leur polymérisation. Parmi ces substances, citons les sulfures (en particulier la pyrite), et surtout les argiles. Les sulfures ont des propriétés électriques qui peuvent adsorber les monomères pré-biotiques. Les argiles sont des minéraux micro-cristallisés, constitués d'un empilement de plaquettes. Une certaine masse d'argiles, constituée de milliards de micro-plaquettes possède donc une "surface interne" énorme.
D'autre part, chaque cristal en forme de micro-plaquette a une structure cristalline faite de feuillets, avec de minces couches "vides" entre les feuillets. Les feuillets ont une épaisseur de 1 ou 1,4 nm suivant les argiles (10 ou 14 Angström), et sont espacés par des inter-feuillets de dimensions analogues.
Source - © 1994 R.L. Kugler et J.C. Pashin,Geological Survey of Alabama
Source - © 2006 ANDRA-CRMCM :
Figure 9. Structure « en plaquettes » des argiles
À gauche, images au microscope électronique à balayage montrant la structure "en plaquettes"des argiles (ici kaolinites).
À droite, image très haute résolution de la structure interne des cristaux d'argile, montrant leur structure en feuillet de 10 ou 14 Angström (1 et 1,4 nm) suivant la nature de l'argile (illite et chlorite).
De l'eau peut s'adsorber et s'absorber à la surface des plaquettes argileuses, et même entre les feuillets pour certaines argiles comme les smectites. C'est pour cela qu'une argile sèche "pompe" l'eau. Des molécules organiques comme les graisses peuvent aussi être absorbées par les argiles, et c'est pour cela qu'on a longtemps utilisé certaines argiles comme agent dégraissant et nettoyant (terre à foulon, terre de Sommières…, qui sont des noms usuels de smectites). Ce que l'argile fait avec les graisses, elle le fait aussi avec d'autres molécules organiques. Acides aminés et bases azotées peuvent être ainsi piégés, concentrés et rapprochés à la surface, ou entre les feuillets argileux. Il en sera de même dans des roches imprégnées de sulfures. On peut d'ailleurs noter qu'argiles et sulfures sont souvent associés dans de nombreux milieux géologiques où de l'eau est en présence de roches chaudes.
Ainsi concentrés et rapprochés, les monomères pourront réagir entre eux, et se polymériser pour former des macro-molécules.
Il se pose tout de suite un problème majeur. Les molécules moyennes (les monomères) sont au nombre de 20 pour les acides aminés ; au nombre de 4 pour les bases azotées, les fameuses guanine, adénine, thymine et cytosine (5 si on rajoute l'uracile). Les macro-molécules sont comme des textes, écrit avec 20 lettres pour les protéines et avec 4 lettres pour les acides nucléiques. Or, pour qu'un texte ait un sens, il faut que les lettres soient dans le bon ordre. De même, pour qu'une macro-molécule soit fonctionnelle, il faut que les monomères aient été attachés dans un ordre précis. Si sur un clavier d'ordinateur on dispose des grains de blé, et qu'on met devant une poule, celle ci va picorer, et, ce faisant, taper sur le clavier et "écrire" un texte. Ce texte aura toutes les chance de ressembler à :
« kjef ?NJ.LSFDVQHEgazroù_gevFKR*GRBVsofe569THJC ?NVdkfjbd™nsgj ;nSU#DGCdvc.JD&D/SUKdde !§uifvsjqsDFBVDk :gudf ?D/V ».
Il y a bien peu de chance qu'en picorant notre poule écrive les Fleurs du mal de Baudelaire, ou démontre le Théorème de Fermat.
Il se pose donc un gros problème d'ordre : comment la polymérisation des monomères s'est-elle faite dans un certain ordre et comment a-t-elle constitué une macromolécule fonctionnelle ? Sans doute la structure cristalline des argiles, des différents types d'argiles, va-t-elle favoriser tel type de polymérisation, et ce de manière reproductible. Mais de là à faire une macro-molécule fonctionnelle…
La 1ère étape : la synthèse des acides aminés, des bases azotées et autres monomères
Pour faire des polymères, il faut des monomères (acides aminés, bases azotées …) ; et pour faire des monomères, molécules moyennes, il faut faire réagir entre elles des petites molécules comme le méthane (CH4), l'ammoniac (NH3), l'eau (H2O), le cyanure d'hydrogène (HCN)… La 1ère étape, former ces petites molécules n'a jamais posé de question ni de problème car on les trouve "un peu partout" sur Terre, dans l'espace…
Par contre, synthétiser acides aminées et bases azotées avec ces petites molécules est loin d'être évident, et cela a posé un gros problème pendant quasiment tout le 20ème siècle.
L'origine atmosphérique
La première proposition de solution a été élaborée en 1952 par Stanley Miller et Urey. On commençait à savoir, à l'époque, que le système solaire était né de la contraction d'une nébuleuse essentiellement gazeuse. On pensait que l'actuelle atmosphère de Jupiter était représentative de la composition des gaz de cette nébuleuse. On commençait déjà à cette époque à savoir que l'atmosphère de Jupiter contient principalement de l'hydrogène (H2) et de l'hélium (He), avec en plus un faible pourcentage de méthane (CH4), d'ammoniac (NH3), d'eau (H20). Et l'on pensait que l'atmosphère primitive de la Terre avait une composition chimique très semblable.
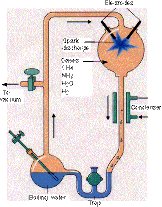
Stanley Miller a donc recréé dans un réacteur chimique cette atmosphère primitive théorique d'H2, CH4, NH3, sous laquelle il a fait bouillir de l'eau, et y a fait éclater des décharges électriques, analogues d'éclairs que l'on supposait être abondants dans l'atmosphère terrestre en ces temps reculés. Au bout de plusieurs mois de fonctionnement, des réactions entres tous les composés avaient produit de très nombreuses molécules organiques, dont des acides aminés que l'on retrouvait en solution dans l'eau.
Source - © 2006 John Kimball
Figure 10. La célèbre expérience de Miller
Ainsi est née la première théorie cohérente de l'origine de la vie : des monomères pré-biotiques (acides aminés...) étaient synthétisés (par des éclairs) dans l'atmosphère primitive de la Terre, tombaient dans la mer (que certains appelaient alors soupe primitive), étaient absorbés par des argiles, se polymérisaient et devenaient des cellules primitives.
Ce scénario a rapidement été remis en question, au moins en ce qui concerne la synthèse des acides aminés.
On a, depuis 1952, profondément modifié nos idées sur l'atmosphère primitive de la Terre. Tout d'abord, celle-ci n'a jamais pu contenir beaucoup d'hydrogène (H2). C'est un gaz trop léger pour être retenu par la gravité terrestre. Ensuite, on s'est aperçu que CH4 et NH3 étaient très facilement détruits par les rayons ultra-violets solaires. Même si la Terre possédait en abondance ces composés au départ, ils auraient rapidement disparu, ou du moins seraient devenus très minoritaires.
D'autre part, le scénario actuellement admis pour l'origine de la Terre n'engendre pas une atmosphère riche en CH4. La Terre est née du rassemblement de poussières et météorites qui sont tombées les unes sur les autres. Poussières et météorites contiennent (en moyenne) 25% de fer, 79% de silicates, 0,9% d'eau et 0,1% de matière organique (carbone réduit) et autres gaz (N2…). Quand ces poussières et météorites se sont rassemblées, cela a dégagé beaucoup de chaleur et la Terre en formation à fondu. Le fer est descendu au centre et a formé le noyau ; les silicates se sont disposés au-dessus et ont formé manteau et croûtes. Eau, gaz et composés carbonés se sont concentrés en surface pour donner l'atmosphère et l'hydrosphère primitives. Le carbone des météorites étant du carbone réduit (matière organique), on pourrait s'attendre à ce que cette atmosphère primitive soit elle-même riche en carbone réduit (CH4 et autres petites molécules organiques). Mais c'est sans compter la très haute température qui régnait lors de la formation de la Terre. Les silicates terrestres comme l'olivine [(MgO, FeO)2 SiO2] contiennent de l'oxyde de fer (FeO). La matière organique des poussières et météorites contient du carbone réduit (C, CH4 , hydrocarbures …). Or, depuis l'invention de la métallurgie du fer, on connaît la réaction chimique suivante : oxyde de fer + carbone réduit → fer réduit (métallique) + dioxyde de carbone (CO2).
C'est ce qui se passe dans les hauts fourneaux, avec réduction par le carbone des minerais de fer. Dans la Terre en formation, plus chaude encore qu'un haut fourneau, la matière organique a dû être oxydée par les oxydes de fer, et est devenue dioxyde de carbone (CO2).
On a toutes les raisons de penser que l'atmosphère de la Terre avait la majorité de son carbone sous forme de CO2, et non pas de CH4. Et l'azote, à cause des ultra-violets, devait être majoritairement sous forme de N2 et non pas de NH3. Les atmosphères de Vénus, Mars, sont d'ailleurs riches en CO2 et N2, et ne contiennent ni CH4 ni NH3 (si ce n'est à l'état de traces).
Et si on fait des expériences type Miller avec un mélange H2O, CO2, N2, on ne synthétise pas de molécules type acides aminés ou bases azotées, mais des molécules beaucoup plus oxygénées.
L'expérience de Miller et celles qui ont suivi sont donc très intéressantes, mais elles ne concernent pas la Terre.
L'origine océanique
Quand la terre s'est formée, le manteau silicaté, principalement formé d'olivine [(Fe, Mg)2 SiO4], ou des laves basaltiques contenant elles aussi de l'olivine ont rapidement été en contact avec l'eau des océans primitifs. Ce manteau devait être beaucoup plus chaud que le manteau actuel, des circulations hydrothermales devaient s'établir, et l'eau devait réagir avec l'olivine. L'olivine contient du FeO (oxyde ferreux). Et le FeO peut réagir avec H2O pour donner du Fe2O3 (oxyde ferrique) et de l'H2 (dihydrogène moléculaire) :
2FeO + H2O → Fe2O3 + H2
Cette réaction était d'ailleurs un ancien procédé industriel utilisé pour la fabrication de l'hydrogène moléculaire.
La réaction ne fonctionne pas qu'avec du FeO pur, mais fonctionne aussi avec l'olivine qui contient du FeO, réaction que l'on peut simplifier en :
Olivine + H2O → Serpentine + H2
L'hydrogène ainsi libéré peut réagir avec du CO2 ou du N2 dissous dans l'eau pour former du méthane, de l'ammoniac (exemple : 4H2 + CO2 → CH4 + 2H2O), qui peuvent ensuite réagir entre eux pour être à la base d'une synthèse de molécules organiques type acides aminés ou bases azotées.
Source - © 2005 Ben Gaddis
Mais dans de tels contextes actuels, cette organo-synthèse ne se fait pas, car l'atmosphère et la mer contiennent de l'oxygène moléculaire (O2), ce qui empêche une telle organo-synthèse de se faire. Par contre, il y a 4 Ga, en présence d'une atmosphère et d'un océan dépourvus d'oxygène moléculaire…
Quand on parle de l'origine océanique possible des molécules pré-biotiques, souvent on confond cela avec les écosystèmes actuels que sont les sources hydrothermales des océans et leurs fumeurs noirs.
Source - © 2003 Pêches et Océans Canada
Dans les fumeurs noirs, il y a oxydation des gaz volcaniques comme H2S (et éventuellement H2) par l'oxygène moléculaire dissout dans la mer, oxygène dissous qui permet par ailleurs aux poissons de respirer. Cette réaction d'oxydation des gaz volcaniques par du O2 dissous libère de l'énergie, utilisée par des bactéries et autres organismes complexes pour croître et synthétiser leur matière organique (on parle de chimiosynthèse et de chimiolithotrophie). Cette énergie chimique est à la base des écosystèmes complexes des sources hydrothermales océaniques actuelles. Cette oxydation des gaz volcaniques par l'oxygène dissous dans l'eau est possible parce que l'atmosphère terrestre et la mer contiennent du O2, libéré par la photosynthèse du plancton, des algues et des plantes. Il y a 4 Ga, l'atmosphère et l'océan ne contenaient pas d'oxygène moléculaire, et les réactions actuelles ne pouvaient pas avoir lieu. Il n'est pas exclu qu'une organosynthèse minérale ait lieu dans ces dispositifs actuels ; mais les molécules éventuellement produites sont tout à fait marginales par rapport aux molécules produites par la chimiosynthèse des organismes vivants. Les écosystèmes des sources hydrothermales océaniques actuelles ne sont donc en aucun cas des équivalents des écosystèmes hydrothermaux très anciens.
L'origine extra-terrestre
Les nuages moléculaires et les nébuleuses
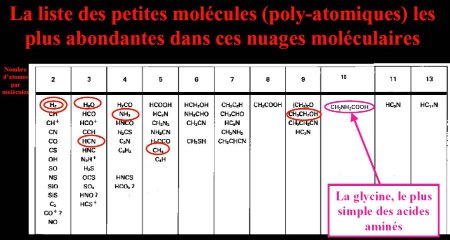
Si l'atmosphère de la Terre n'a sans doute jamais été constituée d'un mélange H2, H2O, CH4 et NH3, il existe un milieu naturel où l'on trouve ces gaz : les nuages moléculaires, aussi appelés nébuleuses. En effet grâce aux études spectrales en infra-rouges et en ondes centimétriques ou millimétriques, on a identifié dans les nébuleuses des dizaines d'espèces de molécules contenant H, C, O et N, dont CH4, NH3, CH3CH2OH (l'alcool éthylique)… Ces molécules s'obtiennent spontanément, puisqu'il y a dans ces nuages de l'énergie disponible (rayons cosmiques, rayonnement UV des étoiles proches) et les atomes H, C, O et N.
Des études spectrales ont même réussi à identifier récemment la glycine, le plus simple des acides aminés.
Source - © 2006 T. Rector / B. Wolpa / Noao / Aura / NSF, in Ciel et Espace : | Figure 14. Liste des molécules les plus abondantes identifiées dans les nuages moléculaires C'est H2, entourée 2 fois qui est de loin la plus abondante. D'autres molécules importantes ont été entourées, dont CH2NH2COOH : la glycine, le plus simple des acides aminés. |
On a pu montrer que ces petites molécules devaient réagir entre elles à la surface des grains de poussière et de glace présents dans ces nébuleuses. Ainsi doivent se former des molécules plus complexes, des polymères de ces molécules complexes… Mais les moyens analytiques actuels ne permettent pas de savoir quelles molécules complexes et polymères sont présents dans les nébuleuses.
Heureusement, on peut avoir accès à des "témoins" peu ou pas modifiés des poussières et objets présents dans notre nébuleuses il y a 4,5 Ga : ce sont les comètes, témoins de ce qui se passait dans le système solaire externe, et les chondrites (les plus fréquentes des météorites), témoins de ce qui se passait dans le système solaire interne.
Les comètes
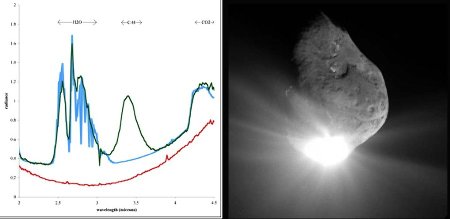
Le dégazage des comètes, quand elles passent près du Soleil, libère une multitude de radicaux et de molécules organiques dont la liste est donnée dans la figure suivante.
Source - © 2006 astronomia.altervista.org - Pierre Thomas
Figure 15. Liste des molécules identifiées dans les queues cométaires depuis la Terre
L'image correspond à la comète Hale-Bopp.
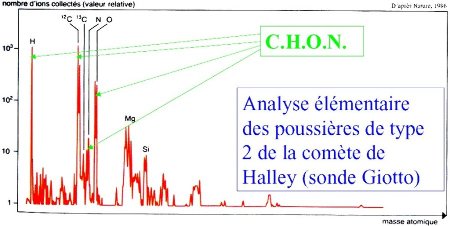
La sonde Giotto, en 1986, a analysé 2 types de grains de poussières, des grains de silicates (type 1) et des grains très riches en CHON (type 2). La technique d'analyse ne permettait pas de déterminer la structure moléculaire de ces composés, mas simplement de connaître leur composition atomique. Ces molécules, qui étaient sous forme de grains solides, étaient forcément des macro-molécules, et non pas de petites molécules organiques, qui auraient été gazeuses dans le vide interplanétaire.
La sonde Deep Impact, en 2005, a trouvé les traces des liaisons CH dans les gaz éjectés lors de l'impact sur la comète Temple 1.
Source - © 2005 Nasa / Univ. of Maryland, in M. F. A'Hearn et al., Science, 310
Figure 17. Impact de la sonde Deep Impact sur la comète Temple 1
À gauche, spectre Infra Rouge des gaz issus de l'impact. Une intense raie aux environs de 3,5 μm montre l'abondance d'hydrocarbures dans ces gaz.
Et d'ici quelques semaines, nous aurons les premiers résultats de l'analyse des poussières de la comète Wild 2 ramenées sur Terre par la sonde Stardust.
Les météorites
Quant aux météorites, elles sont beaucoup plus faciles à analyser directement, puisque les laboratoires en possèdent des kilos.
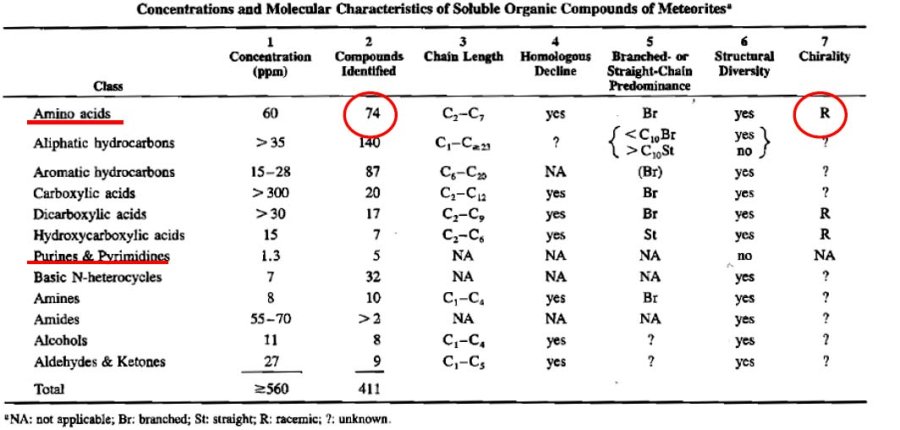
Parmi toutes ces météorites, quelques-unes d'entre elles sont appelées « chondrites carbonées », car elles contiennent entre 0,1 et 5% de matière organique.
Figure 18. Tranche dans un fragment de chondrite carbonée, la chondrite d'Allende Les chondres sont parfaitement visibles. La couleur noire indique la présence de matière carbonée. | Source - © 2004 J. H. Wittke & T. E. Bunch : |
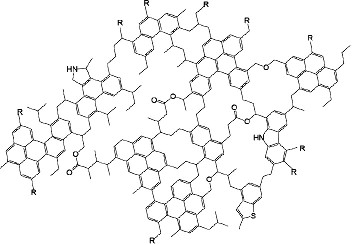
Que contiennent ces météorites carbonées ? La majorité (75 à 95%) de cette matière organique des météorites est faite de très grosses molécules insolubles, dont la structure doit ressembler à ce qui est représenté à la figure suivante.
Un faible pourcentage (5 à 25%) de cette matière organique est faite de plus petites molécules, solubles dans l'eau ou des solvants divers. Et parmi ces molécules, il y a justement des acides aminés et des bases azotées. La figure suivante donne la liste et les proportions de ces molécules organiques solubles.
Quelle est l'origine de cette matière organique des comètes et des météorites ? Une part vient sans doute des molécules présentes dans la nébuleuse pré-solaire. Mais la majorité a probablement été synthétisée dans le système solaire primitif, car le jeune soleil émettait beaucoup de rayonnements ionisants (rayons ultra violet, et particules énergétiques comme des protons et électrons accélérés). L'action de ces rayonnements sur les petites molécules gazeuses (méthane …), notamment celles piégées à la surface des grains de poussière et de glace a dû produire ces molécules organiques complexes.
(Voir aussi l'article La matière organique dans les chondrites carbonées, par laurent Remusat)
L'arrivée des météorites et des poussières cométaires
Comment ces molécules organiques des comètes ou des météorites ont pu arriver sur Terre sans être détruites par leur traversée de l'atmosphère terrestre et leur arrivée au sol ?
Quatre cas sont possibles.
Cas n° 1. Imaginons une météorite "moyenne", par exemple 0,1 m de coté (10 cm) pour une météorite de masse 3 kg et de volume 10-3 m3 (1 dm3), avec une surface de 6.10-2 m2 (600 cm2).
Une telle météorite moyenne voit sa surface chauffer en traversant l'atmosphère, à cause des frottements. Ces frottements et ce chauffage vaporisent la surface sur une épaisseur de quelques cm, et la météorite, souvent, se casse. Frottements et chauffage ralentissent la météorite jusqu'à environ 200 km/h, la vitesse d'équilibre de chute d'un corps dans l'air à 1 atmosphère de pression (c'est la vitesse de chute d'un parachutiste dont le parachute ne s'ouvre pas). Mais, pour une météorite de cette taille, seule sa périphérie sera vaporisée. Son cœur n'aura pas le temps de chauffer, restera froid et arrivera intact jusqu'au sol. Si on assiste à cette chute, on verra ce qu'on appelle un bolide, et on ramassera une "belle" météorite.
Source - © 1992 S. Eichmiller |
Cas n° 2. Si la météorite était petite (moins de quelques cm de rayon), elle est entièrement vaporisée par la chaleur dégagée par le frottement atmosphérique, avant d'atteindre cette vitesse d'équilibre. On assistera à la chute d'une étoile filante, mais rien n'arrivera jusqu'au sol.
Source - © 1998 Lorenzo Lovato, - JPL/NASA
Cas n° 3. Imaginons maintenant une grosse météorite (ou une comète) 104 fois plus grosse (1000 m de rayon dans notre exemple). Elle aura une masse et un volume 1012 fois supérieure (109 m3), et une surface 108 fois supérieure (6.106 m2). En effet, le volume varie comme le cube des rayons, et la surface comme le carré des rayons. L'énergie cinétique de sa météorite arrivant au sommet de l'atmosphère est proportionnelle à sa masse. Pour ralentir cette météorite, le frottement devrait produire une énergie 1012 fois plus forte, or le frottement s'effectue sur une surface seulement 108 fois plus grande. Chaque unité de surface aurait donc à évacuer/absorber 104 fois plus d'énergie, ce qu'elle n'arrivera pas à faire avant que la météorite arrive au sol. La surface de notre grosse météorite chauffera énormément, mais n'arrivera cependant pas à évacuer toute son énergie, ni à vaporiser plus qu'une infime proportion de la météorite ; le ralentissement sera très faible. La météorite arrivera au sol à grande vitesse, plusieurs km/s. Et alors, toute son énergie cinétique sera instantanément transformée en chaleur et en surpression ; notre météorite sera complètement vaporisée. Dans le cas d'une météorite de 1000 m de diamètre, en plus de sa vaporisation totale, le choc créera un cratère de 20 km de diamètre et de 2 km de profondeur.
Cas n° 4. À l'opposé, une météorite 104 fois plus petite (10 μm dans notre exemple, soit à peu près la taille d'un globule rouge) produira 1012 fois moins d'énergie, qui devra s'évacuer par une surface 108 fois plus petite. Chaque unité de surface n'aura qu'à évacuer 104 fois moins d'énergie que dans le cas d'une météorite moyenne, ce qu'elle arrivera facilement à faire, sans même chauffer. Notre micro-météorite ralentira sans chauffer, et arrivera au sol totalement intacte. Ce quatrième cas concerne les micro-météorites, mais aussi les grains cométaires issus des queues des comètes. De telles micro-météorites ou poussières sont collectées par des avions stratosphériques, ou en faisant fondre des mètres cube de glace antarctique ultra-propre.
Source - © 2005 NASA, in J. Llorca, INT. MICROBIOL., 8,1, 5-12
Des quatre cas que nous venons d'évoquer, nous voyons que le cas n° 2 (petite météorite) et le cas n° 3 (giga-météorite ou comète) entraînent une vaporisation-destruction totale de la météorite. Si celle-ci contenait de la matière organique sous forme de monomères type acides aminés ou bases azotées, ceux-ci sont complètement détruits.
Nous voyons par contre que dans le cas n° 1 (météorite moyenne) et le cas n° 4 (micro-météorite et grains cométaires), la météorite n'est pas détruite ni réchauffée (ou seulement sur sa périphérie). Si celle-ci contenait de la matière organique sous forme de monomère type acides aminés ou bases azotées, celle-ci arrivera intacte jusqu'au sol (ou à la mer).
On connaît la masse de météorites de toutes tailles qui tombent actuellement sur Terre (entre 10.000 et 100.000 tonnes/an), surtout sous forme de micro-météorites. En extrapolant cette quantité aux premiers temps de la Terre, quand le bombardement était beaucoup plus intense, on trouve que la quantité de matière organique arrivée sur Terre sans être détruite lors de ces époques reculées devait être largement supérieure à la masse de tous les êtres vivants actuels (animaux + végétaux + champignons + bactéries).
Conclusion partielle
Cette étape de synthèse des monomères, comme les bases azotées et les acides aminés, ne semble donc pas un problème. Si l'atmosphère terrestre primitive ne permettait vraisemblablement pas de telles synthèses contrairement à ce qu'on croyait il y a 50 ans, deux autres sources, d'ailleurs non incompatibles, existaient ou étaient possibles : l'espace et l'océan. Les molécules à la base de la vie viennent-elles de l'océan, de l'espace, ou des deux ? Sommes nous, moléculairement parlant, d'origine extra-terrestre ou océanique ?
Conclusion générale
L'origine de la vie est donc un problème qui n'est pas encore résolu, mais on commence à entrevoir les mécanismes ayant fait passer de la matière minérale aux premières cellules, une "paléo-génération spontanée" en quelque sorte. De nombreuses étapes restent encore incomprises, en particulier le passage des macro-molécules aux premières cellules.
Mais pour ce qui précède ce moment fatidique que représente le passage des molécules à la vie, géologie et astronomie apportent beaucoup.
- C, H, O et N, les atomes constitutifs de la vie, sont les plus abondants de l'univers.
- L'eau, le solvant de la vie, est la deuxième molécule la plus abondante de l'univers.
- Il existe partout dans l'univers (et il en existait un peu ou s'en fabriquait sur Terre) des petites molécules comme CH4, NH3… bases des synthèses ultérieures.
- Sur la Terre primitive, synthétisées dans (et venant de) l'espace et/ou l'océan, il y avait abondance des molécules "briques élémentaires" de la vie que sont acides aminés, bases azotées…
- Ces molécules ont pu être concentrées à la surface de minéraux particuliers comme les sulfures et les argiles, et se polymériser.
- Il ne restait plus alors à ces polymères qu'à s'associer pour former des cellules. Comment ? Ce sera aux chimistes et aux biologistes d'apporter les réponses.
Si ces idées sont correctes, alors l'apparition de la vie doit être un phénomène relativement spontané et facile, dès que les conditions s'y prêtent. C'est ce que suggère la rapidité avec laquelle la vie est apparue sur Terre : moins de 200 millions d'années. Phénomène spontané et facile, la vie a dû se développer ailleurs que sur Terre, à partir du moment où étaient présentes eau liquide, petites molécules organiques… C'est-à-dire un nombre immense de sites dans notre galaxie, dont plusieurs dans notre système solaire : Mars pendant son premier milliard d'années, certains satellites de Jupiter ou de Saturne comme Europe ou Titan… Trouver ne serait-ce qu'un micro-fossile de «"bactéroïde" sur un ce ces corps sera(it) une magnifique confirmation du caractère spontané, voir "obligatoire" de l'apparition de la vie.
Cce texte a été commandé par le Conseil Général de l'Allier dans le cadre des travaux préparatoires au Centre Européen de Paléontologie qui va être construit à Gannat (03) dans les années qui viennent.
Ce texte est publié dans Planet-Terre avec l'accord du Conseil Général de l'Allier.