Article | 15/07/2000
Les forêts produisent-elles de l'oxygène ?
15/07/2000
Résumé
Bilan de la consommation et de la production de dioxygène dans une forêt, devenir de ce dernier, origine et évolution du dioxygène atmosphérique.
Table des matières
Question
« On dit toujours que les forêts font du dioxygène. J'ai lu dans les livres du nouveau programme que ce n'était pas vrai. Pouvez vous m'éclairer. »
Question posée par M. J. le 27 juin 2000 par courrier électronique .
Réponse
En résumé :
Le budget carboné de l'écosystème forestier est difficile à estimer et discuté par les spécialistes. Théoriquement, le dioxygène est produit en même temps que la matière organique (lors de la photosynthèse) et consommé en même temps que la respiration (minéralisation du carbone, par les producteurs eux-même, des consommateurs ou des décomposeurs) et les incendies naturels (même équation bilan que la respiration !). Si la biomasse d'une forêt n'augmente pas, elle produit autant de matière organique qu'elle en consomme. Elle produit donc autant d'oxygène qu'elle en consomme !
Cependant, une forêt en cours de croissance (reconquête de terre agricole) accumule de la biomasse (sous forme de cellulose et de lignine)). Mais lorsque la forêt naturelle est "adulte", elle arrive à un équilibre entre production primaire et décomposition des arbres morts : elle ne produit plus alors de dioxygène.
En réalité, la forêt n'est pourtant pas un système isolé... l'écoulement de l'eau entraîne de la matière organique à distance (on parle d'exportation). Si, là ou elle va, cette matière organique n'est pas respirée ou brûlée, elle correspond à de l'oxygène non réutilisé ! De ce fait, une partie de l'oxygène produit par certaines forêts, dont l'Amazonie, s'accumulerait dans l'atmosphère ! Pourtant, même le chiffrage détaillé de ces fuites n'est pas clair, on constate que le taux d'oxygène n'augmente pas : cette matière organique fossilisée est le pendant de la matière organique anciennement fossilisée, qui revient en surface par érosion des roches et se trouve progressivement oxydée. Ici encore, le flux est nul à l'échelle globale !
Donc une forêt à l'équilibre ne produit pas d'oxygène. Toutefois, son extension, ou la fossilisation in situ ou ex situ de sa matière organique, peut correspondre à un flux local net d'oxygène.
Une forêt à l'équilibre ne produit pas de dioxygène !
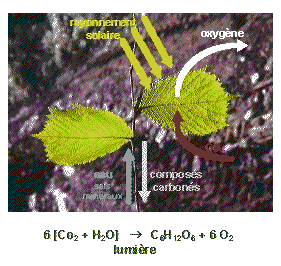
La photosynthèse peut se résumer à l'équation suivante :
6 CO2 + 6 H2O → C6H12O6 (glucose ou C6(H2O)6) + 6 O2
Figure 1. La photosynthèse
À chaque fois que la photosynthèse produit de la matière organique contenant 12 g de carbone, il y a production de 32 g de dioxygène. L'O2 est donc libéré dans la proportion de 32/12 par rapport au C incorporé au cours de la photosynthèse.
En ne prenant en compte que C et O, en éliminant H2O et en divisant par 6, la réaction de la photosynthèse peut s'écrire :
CO2 → C + O2
de masses molaires respectives :
44 g de CO2 →12 g de C (fixé dans du glucose) + 32 g d'O2
Que devient ce dioxygène ? S'accumule-t-il ?
C6H12O6 (glucose ou C6(H2O)6) + 6 O2→ 6 CO2 + 6 H2O
soit après simplification :
C + O2 → CO2
et, en masse molaire :
12 g de C (fixé dans du glucose) + 32 g d'O2 → 44 g de CO2
Les 32 g d'O2 libéré par la synthèse du glucose sont totalement et exactement absorbés par la respiration de ce même glucose. Le glucose et toute la matière organique "utilisés" par la plante ne libèrent donc de l'O2 que très provisoirement. Au bout d'un certain temps (au plus le temps d'utilisation des réserves), l'O2 produit est réutilisé. L'O2 ne peut donc pas s'accumuler.
Le glucose qui participe à la croissance du végétal (et qui est transformé en cellulose, lignine...) n'est pas respiré par la plante. L'O2 libéré par sa synthèse pourrait donc s'accumuler... Mais c'est oublier que les plantes sont mortelles ! À la mort de la plante, tous les tissus sont métabolisés par bactéries, champignons et microfaune du sol (voir équation ci-contre).
12 g de glucose (sous forme de cellulose ou autre molécule) + 32 g de O2 → 44 g de CO2
À la fin de la décomposition totale du végétal, tout l'O2 libéré lors de sa vie aura donc été réutilisé.
Notez que les écosystèmes forestiers, tempérés et même tropicaux, brûlent souvent et naturellement (exemple de l'incendie de Yellowstone ou des 0,3 % de forêts françaises, pourtant gérées, qui brûlent chaque année). Les incendies naturels constituent une autre cause de minéralisation, mais qui consomme aussi de l'oxygène (même équation bilan que la respiration !).
Une forêt à l'équilibre, c'est-à-dire dont la biomasse ne croît pas, où il y a autant d'arbres qui naissent et poussent que d'arbres qui meurent (c'est-à-dire une forêt naturelle, « vierge ») ne libère donc pas de dioxygène.
Le dioxygène de l'atmosphère ne devrait donc être la contrepartie que de la biomasse produite et non encore métabolisée. La biomasse totale représentant environ 3.000 Gt de C, l'atmosphère devrait contenir que 32/12 de 3.000 Gt, soit 8.000 Gt d'O2. Or l'atmosphère contient 1.000.000 Gt d'O2, soit 125 fois plus que les 8000 théoriques. Sur tout l'O2 de l'atmosphère, 1/125 vient donc des forêts (et autres écosystèmes), et 124/125 (la quasi totalité) vient d'ailleurs.
D'où viennent les 1.000.000 Gt d'oxygène atmosphérique actuel ?
L'O2 de l'atmosphère est en fait la contrepartie de la matière organique quand (et seulement quand) celle ci n'a pas été respirée et métabolisée. Le seul processus qui empêche cette métabolisation de la matière organique, c'est sa fossilisation (sous forme de kérogène, de matière organique dispersée, de charbon, de pétrole...). À chaque fois qu'il se synthétise de la matière organique contenant 12 g de C et que cette matière organique se fossilise, les 32 g d'O2 libérés ne sont pas réutilisés, et s'accumulent dans l'atmosphère. Nous respirons donc un O2 libéré par des végétaux anciens (par exemple carbonifères) devenus matière organique fossile.
La sédimentation de matière organique et la production de dioxygène.
L'Amazonie ne produit pas d'oxygène directement... Elle en produit quand même un peu. À chaque fois que de la matière organique est emportée à la mer par l'Amazone (arbre mort flottant...), elle peut se sédimenter dans son delta, et être préservée de l'oxydation par de l'argile ou d'autres sédiments ; il y a alors libération nette d'O2. Les sites indirectement responsables de la production d'O2, ce sont donc les bassins sédimentaires et autres marges piégeant beaucoup de matière organique (d'origine terrestre ou marine) dans des sédiments.
Puisqu'il y a continuellement sédimentation de matière organique, la teneur en O2 devrait augmenter, ce que l'on ne constate pas !
Il existe en réalité 2 sites géologiques qui "absorbent" une quantité équivalente d'O2 :
- les chaînes de montagnes où l'érosion met à jour des roches sédimentaires riches en matière organique, ou des roches contenant du Fe2+ et/ou de la matière organique. Fe2+ et matière organique s'oxydent ( 4 FeO (contenu dans les silicates comme les pyroxènes) + O2 → 2 Fe2O3) ;
- les dorsales : l'eau de mer contient de l'O2 dissout (et d'autres oxydants comme les sulfates) qui s'infiltre dans la lithosphère océanique, y oxyde le Fe2+ des silicates en Fe3+, et ressort totalement dépourvue d'O2.
Que sait-on sur l'évolution de la teneur en O2 depuis 4,5 Ga ?
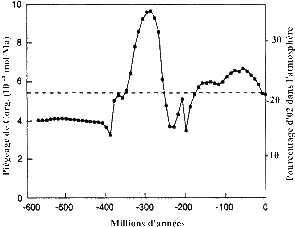
Depuis 500 Ma
Pendant le Phanérozoique, on peut raisonnablement faire l'hypothèse suivante : l'O2 vient d'une accumulation de matière organique fossile non respirée. Cette hypothèse implique que de l'O2 produit n'a pas servi de façon majeure à oxyder des éléments comme Fe2+ ou S-.
Donc, estimer à un moment donné la quantité de matière organique fossile permet avec cette hypothèse de connaître l'O2 de l'atmosphère. Grâce à des données isotopiques sur la quantité de C organique piégé dans les sédiments en fonction du temps, on obtient par différence la teneur en O2.
La méthode la plus simple est le rapport 12C/13C. La matière organique étant riche en 12C, plus il y a de 12C, plus le C non organique est pauvre en 12C. La mesure du δ13C des carbonates donne donc directement la quantité de C organique piégée, donc indirectement l'O2.
La teneur en O2 de l'atmosphère depuis 500 Ma est variable (de 15% à 35% de l'atmosphère, actuellement 21%), en fonction de la prépondérance soit du piégeage de la matière organique des sédiments, soit de l'altération des roches sédimentaires et/ou de l'activité des dorsales.
De -2,5 à -1,8 Ga
Avec des sédiments dont on est sûr qu'ils sont en équilibre avec l'atmosphère (sédiments éoliens, sédiments détritiques torrentiels grossiers, sols continentaux désertiques...), et grâce aux éléments existant avec plusieurs états de valence (Fe2+ ou Fe3+, U4+ ou U6+, ...), on peut facilement savoir s'il y avait de l'O2 en quantité appréciable dans l'atmosphère.
Avant 2,5 Ga, pas d'O2 dans l'atmosphère (mais présence ici ou là de milieux confinés oxydants). Depuis 1,8 Ga, il y a de l'O2 (une teneur supérieure à 0,1% (actuel 21%), avec ici ou là des milieux confinés sans O2). Il y a donc une montée formidable entre -2,5 et -1,8 Ga, confirmée par la précipitation générale de Fe2O3 dans les océans à cette époque.
De -1,8 Ga à -500 Ma
Pour joindre -1,8 Ga à -0,5 Ga (-500 Ma) où l'on dispose d'une quantité "chiffrée" d'O2, on ne sait pas trop ce qui se passe. L'hypothèse faite pour le Phanérozoique (O2 en relation avec l'accumulation de matière organique) est en effet de moins en moins valable...