Article | 25/06/2025
Les pompes océaniques de carbone
25/06/2025
Auteur(s) / Autrice(s) :
Publié par :
- Olivier DequinceyENS de Lyon / DGESCO
Résumé
Les flux de carbone air-océan. Formes du carbone (organique / inorganique - dissout / particulaire), processus physiques et biologiques impliqués, échelles de temps, estimation des flux et liens avec le climat.
Début juin 2025 s’est tenue à Nice la troisième conférence des Nations unies sur l'océan (UNOC 3)(lien externe - nouvelle fenêtre). Parmi les priorités définies par cette conférence, et après les objectifs de protection des écosystèmes marins et de développement de l'économie, se trouve le souhait de « renforcer et mieux diffuser les connaissances liées aux sciences de la mer pour une meilleure prise de décision politique ». L'océan constitue un réservoir de carbone cinquante fois plus important que l'atmosphère. Ces deux enveloppes fluides échangent du carbone via des flux qui modulent la quantité de CO2 atmosphérique, affectant ainsi l'effet de serre et donc le climat terrestre. Les pompes océaniques de carbone désignent l'ensemble des mécanismes susceptibles de retirer du CO2 atmosphérique pour le séquestrer dans l'océan profond à des échelles de temps allant de la centaine d'années aux millions d'années. Cet article vise à présenter les différentes pompes océaniques de carbone pour appréhender leur importance relative ainsi que les conséquences de leur potentielles variations à différentes échelles de temps.
Les formes du carbone océanique
Le carbone se trouve dans l'océan sous différentes formes que les océanographes biogéochimistes ont classé selon des critères pratiques : le dissout, le particulaire, l'organique, et l'inorganique (figure 1). Le carbone dissout correspond à la fraction qui passe à travers un filtre de porosité 0,2 µm (ou 0,7 µm selon les auteurs). Le carbone particulaire est donc la fraction qui reste sur le filtre. Le carbone organique est la fraction qui ne se dissout pas dans l'acide chlorhydrique. Le carbone inorganique est calculé comme la différence entre le carbone total et la fraction résiduelle non dissoute. Ces critères définissent quatre compartiments : le carbone organique particulaire (POC), le carbone inorganique particulaire (PIC), le carbone organique dissout (DOC), et le carbone inorganique dissout (DIC).
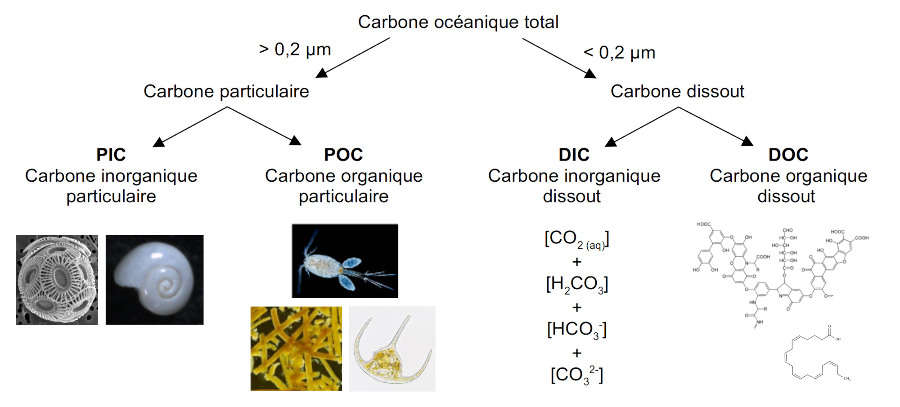
Source - © 2025 — Mathieu Rembauville
Le POC est constitué de cellules et de tissus organiques planctoniques, le PIC des tests carbonatés fabriqués par le plancton calcifiant. Le DOC regroupe une grande diversité de molécules organiques excrétées par le phytoplancton et le zooplancton (glucides, protéines, lipides). Le DIC est constitué de la somme des concentrations des ions carbonés dissouts auquel on ajoute conceptuellement le CO2 aqueux et l'acide carbonique H2CO3 (difficilement mesurables).
DIC = [CO2(aq)] + [H2CO3] + [HCO3−] + [CO32−].
Au pH moyen de l'eau de mer (de 8,05), les ions bicarbonate (ou hydrogénocarbonate) HCO3− représentent plus de 90 % du DIC et les ions carbonates CO32− un peu moins de 10 %. Le CO2 aqueux et l'acide carbonique sont négligeables avec moins de 1 %.
Le DIC constitue de loin le plus grand stock de carbone océanique (38 000 Gt), suivi par le DOC (700 Gt) tandis que les formes particulaires sont minoritaires avec 3 Gt pour le POC et 0,03 Gt pour le PIC (Friedlingstein et al., 2025[8]). La distinction particulaire / dissout est importante pour comprendre les vecteurs des flux de carbone : la matière particulaire peut couler par gravité dans l'océan alors que la matière dissoute ne peut être transportée que par les courants océaniques.
Une autre grandeur utile à la compréhension du cycle du carbone océanique est l'alcalinité. La définition chimique de l'alcalinité totale est la somme des ions accepteurs de protons moins la somme des ions donneurs, tous affectés de leur charge. L'alcalinité est donc une mesure du pouvoir tampon de l'océan, c'est-à-dire de sa capacité à neutraliser des acides sans modification de pH. L'alcalinité des carbonates est une fraction de l'alcalinité qui représente à elle seule 96 % de l'alcalinité totale. On simplifie donc souvent l'alcalinité totale par l'alcalinité des carbonates.
Alcalinité totale = [HCO3−] + 2 [CO32−] + [OH−] + [B(OH)4−] + 2 [HPO42−] + 3 [PO43−] + [H3SiO4−] + [NH3] + [HS−] + 2 [S2−] − [H+] − [HF] − [HSO4-] − [H3PO4].
Alcalinité des carbonates = [HCO3−] + 2 [CO32−].
La pompe physique
La pompe physique correspond à la solubilisation du CO2 atmosphérique dans les eaux de surface, suivie de sa séquestration en profondeur quand ces eaux plongent et sont emportées par la circulation thermohaline. Elle est aussi appelée « pompe à solubilité » et implique donc deux mécanismes physiques différents : premièrement l'entrée de CO2 et sa solubilisation en DIC et deuxièmement la mise en mouvement de l'eau de la surface vers le fond, qui piège ce DIC d'autant plus longtemps que la profondeur atteinte est grande. Le temps maximal de séquestration théorique correspond au temps d'un tour de circulation thermohaline, parfois appelée « tapis roulant océanique », soit environ 1 500 à 2 000 ans.
Le flux de CO2 à l'interface air-mer (FCO2, en mol/m2/a) est calculé à partir de la mesure en continu de la pression partielle de CO2 (pCO2) de l'air et de l'eau à bord de navires océanographiques.
F CO 2 = − k × s × ( pCO 2 a − pCO 2 w ).
Le paramètre k est la vitesse de transfert des gaz et s est la solubilité du CO2. Dans cette équation, la différence de pCO2 entre l'air (pCO2a) et l'eau (pCO2w) fixe le sens du flux. Quand pCO 2 a > pCO 2 w, le CO2 est solubilisé de l'air vers l'eau et l'océan est donc un puits de CO2 (le flux FCO2 est négatif). Inversement quand pCO 2 a < pCO 2 w, le CO2 est dégazé de l'eau vers l'air et l'océan est une source de CO2 pour l'atmosphère (le flux FCO2 est positif). Les paramètres k et s déterminent l'intensité du flux. La vitesse de transfert des gaz (k) est proportionnelle à la vitesse du vent au carré : les vents puissants brassent l'océan de surface, injectant ainsi des bulles d'air dans l'eau. La solubilité (s) est inversement proportionnelle à la température : le CO2 se dissout mieux dans les eaux froides. La mesure de la pCO2 de l'air ou de l'eau est réalisée par spectrométrie infrarouge, la température de l'eau par une sonde CTD[1], et la vitesse du vent par un anémomètre (figure 2). L'ensemble des instruments peut fonctionner de manière autonome, ce qui permet la mesure en continu du flux de CO2 air-mer lors du déplacement d'un navire. Les instruments peuvent également être miniaturisés pour équiper une bouée dérivante.

Source - © - — Photographies Claire Lo Monaco, service OISO, Laboratoire LOCEAN
Depuis 1998, le programme OISO sillonne l'océan Indien et mesure la pression partielle de CO2 océanique et atmosphérique ainsi que le carbone inorganique dissout (DIC) et l'alcalinité. L'eau de mer est pompée sous la coque du navire et arrive dans un débulleur qui alimente tous les instruments. Le dosage du DIC et de l'alcalinité est réalisé par titration potentiométrique. Pour la mesure du CO2, l'eau de mer est équilibrée avec de l'air qui est ensuite séché dans un piège à froid. Le CO2 contenu dans l'air sec équilibré avec l'eau est ensuite mesuré par absorption infrarouge dans un analyseur en continu. L'instrument bascule régulièrement entre la mesure de la pCO2 océanique et atmosphérique. Les instruments sont autonomes et calibrés avec des standards toutes les 6 heures. Les données obtenues en temps réel sont vérifiées et validées par les chercheurs embarqués qui s'assurent du fonctionnement optimal des instruments tout au long de la campagne en mer.
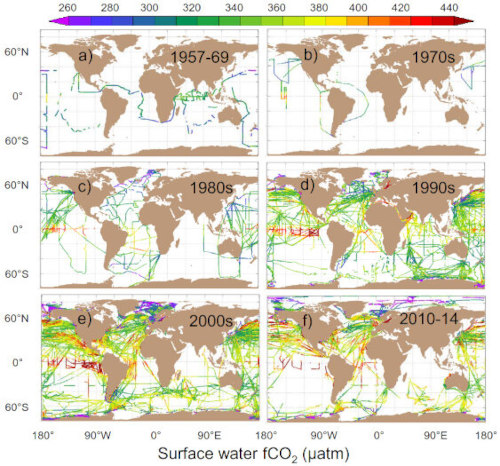
Source - © 2016 — Bakker et al. [ 1 ]
Chaque point est une mesure ponctuelle réalisée le long du trajet d'un navire ou d'une bouée dérivante.
La base de donnée SOCAT (Surface Ocean Carbon Atlas) compile les millions de mesures réalisées pendant les trajets des navires depuis 1950 ou par des bouées dérivantes pour cartographier le flux de CO2 air-mer (figure 4). Les zones sources majoritaires (flux positif de l'eau vers l'air) sont associées à des courants ascendants d'eau profonde : upwelling équatorial et upwelling circumpolaire autour de l'Antarctique. Elles correspondent à des remontées d'eaux âgées donc riches en DIC qui a été produit par la respiration des bactéries et du zooplancton et accumulé pendant des centaines voire des milliers d'années. Dans l'océan intertropical, la croissance du phytoplancton est limitée par la disponibilité en macronutriments comme les phosphates ou en micronutriments comme le fer. La photosynthèse consomme donc peu de CO2 ce qui maintient une pCO2 océanique élevée. Les zones puits (flux négatif de l'air vers l'eau) forment deux ceintures entre 40° et 50° de latitude observables dans les deux hémisphères. Ces eaux froides sont brassées par les vents d'Ouest (s et k augmentent) et sont des zones productives riches en macro- et micro-nutriments où la photosynthèse consomme le CO2 dans les eaux de surface et creuse le gradient de pCO2 air-mer. Elles correspondent également à des zones de formation d'eau dense (eau Nord-Atlantique profonde et eau modale Subantarctique) qui plongent en profondeur et emportent avec elles le CO2 dissout. Pour estimer le bilan net de la pompe physique, il faut calculer l'intégrale spatiale du flux air-mer de CO2 afin de prendre en compte les zones puits et les zones sources. Le bilan net est un puits océanique de carbone valant 3 ± 0,5 GtC/a selon les estimations récentes (Friedlingstein et al., 2025[8]).
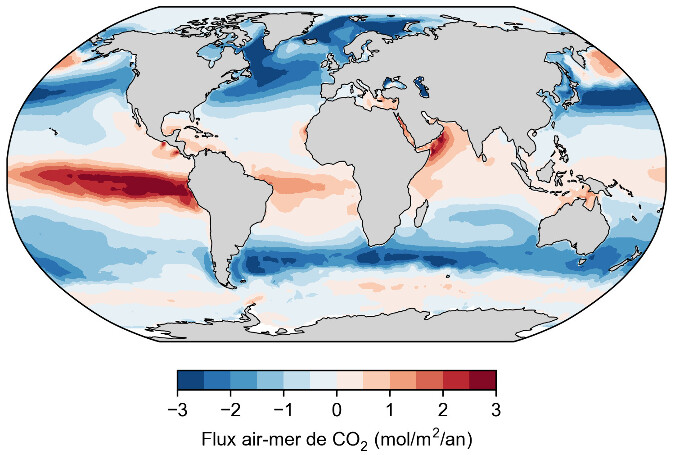
Source - © 2025 — Mathieu Rembauville d'après les données de Fay et al., 2021 [ 6 ]
Un flux positif correspond à un dégazage de l'océan vers l'atmosphère. Un flux négatif correspond à une solubilisation de l'atmosphère vers l'océan.
Après solubilisation dans l'océan, le CO2 réagit avec l'eau selon la succession de réactions suivantes.
Formation de l'acide carbonique :
CO2 + H2O → H2CO3.
Dissociation de l'acide carbonique formant des ions bicarbonate (hydrogénocarbonate) et des protons :
H2CO3 → HCO3− + H+.
Réaction entre les ions carbonates déjà présents et les protons libérés précédemment :
CO32− + H+ → HCO3−.
La solubilisation du CO2 a donc pour conséquence une augmentation du DIC, une diminution du pH et une modification de l'équilibre des carbonates en faveur de l'accumulation d'ions hydrogénocarbonate (bicarbonate) HCO3−. La grande quantité de mesures de DIC océanique ainsi que d'autres paramètres chimiques permettent de calculer la composante anthropique du DIC, c'est-à-dire la part du DIC océanique qui a pour origine le CO2 issu de la combustion des énergies fossiles et qui a ensuite été solubilisé dans l'océan. Ce calcul peut être réalisé à partir des mesures isotopiques du DIC océanique : le CO2 anthropique a en effet une signature particulièrement pauvre en isotope 13C et riche en 12C, qui traduit son origine fossile. Plus souvent, le DIC anthropique est calculé à partir des mesures de DIC total, de dioxygène dissout et de température. Il est possible de calculer la concentration théorique de DIC naturel qui serait uniquement due à la respiration (connue à partir du dioxygène) ainsi qu'à sa solubilité (connue à partir de la température). L'écart entre la concentration mesurée et la concentration théorique naturelle calculée correspond à la part anthropique du DIC. La répartition du DIC anthropique montre sa solubilisation en surface et son injection dans l'océan profond par la circulation océanique aux hautes latitudes (figure 5). L'océan profond en zone équatoriale est quasi-dépourvu de DIC anthropique, car la circulation thermohaline qui a piégé le carbone anthropique en surface depuis la révolution industrielle n'a pas encore atteint de telles profondeurs.
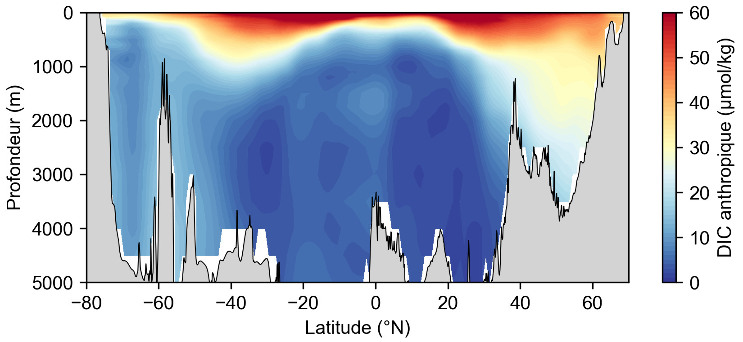
Source - © 2025 — Mathieu Rembauville d'après les données GLODAP (Global Ocean Data Analysis Project)
L'océan de surface est le plus concentré en DIC anthropique qui s'y est dissout récemment. Aux latitudes supérieures à 40°, la formation d'eau dense Nord-Atlantique et Antarctique entraine le DIC en profondeur. Dans l'océan équatorial profond, les eaux sont pauvres en DIC anthropique car elles étaient au contact de l'atmosphère avant la révolution industrielle. Le DIC anthropique constitue donc un traceur de la circulation thermohaline.
La pompe biologique
La pompe biologique désigne l'export de carbone organique particulaire (POC) depuis l'océan de surface où il a été produit par photosynthèse vers l'océan profond. Aussi appelée pompe des « tissus mous », elle est constituée d'agrégats de phytoplancton, de pelotes fécales de zooplancton et de divers détritus organiques formant une « neige marine », qui sédimente par gravité vers les fonds océaniques. D'autres mécanismes transportent activement le carbone organique, comme la migration des organismes zooplanctoniques qui consomment le POC en surface puis le digèrent et le respirent en profondeur où l'eau froide diminue les couts métaboliques. Cette migration peut être quotidienne : migration dite nycthémérale selon le cycle jour/nuit, ou saisonnière : migration dite ontogénique selon le cycle de développement de l'espèce zooplanctonique considérée.
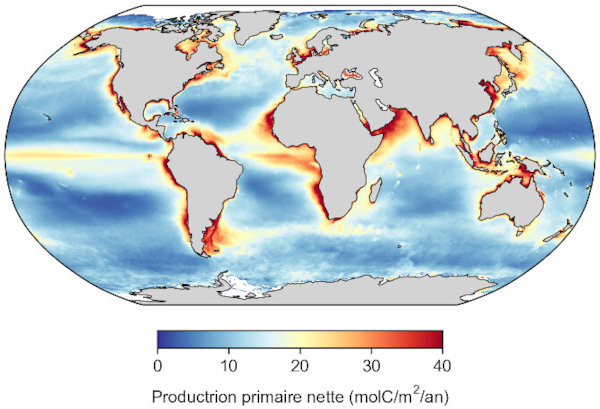
Source - © 2025 — Mathieu Rembauville d'après les données de l'Ocean Productivity Group, T. Westberry
Résultat d'un modèle de production primaire appliqué aux données satellitaires de couleur de l'eau. Le centre des gyres océaniques est peu productif car le phytoplancton y est limité par la faible concentration en nutriments. Les zones les plus productives correspondent à un enrichissement en nutriments par les courants ascendants (upwellings côtiers ou équatoriaux) ou par l'apport des fleuves côtiers.
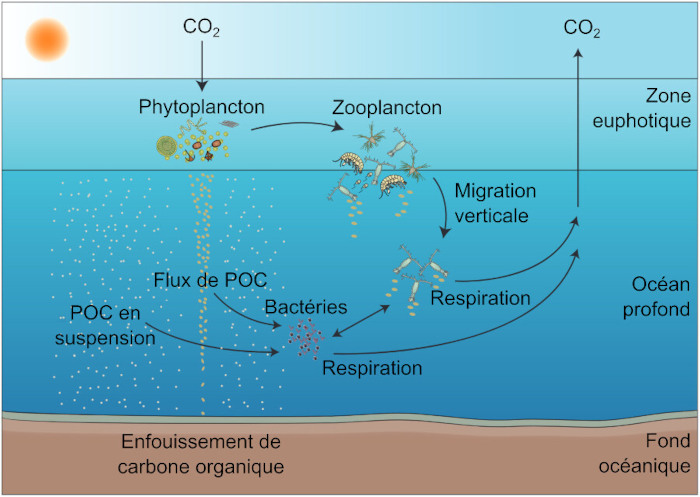
Source - © 2025 — D’après Herndl et Reinthaler, 2013 [ 10 ] , francisé
Le phytoplancton fixe le CO2 par photosynthèse dans la couche éclairée de l'océan (zone euphotique). Le carbone organique particulaire produit (POC) est consommé par le zooplancton herbivore, ou consommé indirectement par les bactéries marines qui exploitent la matière organique solubilisée. La reminéralisation de la matière organique dans la colonne d'eau convertit le carbone organique en CO2. On estime que seulement 1 % du POC produit en surface atteint les fonds océaniques.
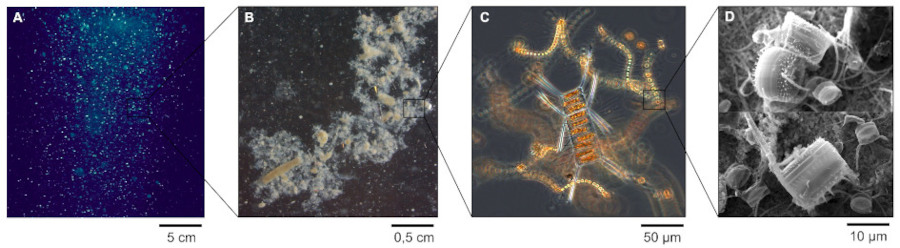
Source - © 2025 — Mathieu Rembauville
A. Photographie des particules marines dans la masse d'eau.
B. Observation à la loupe binoculaire. On distingue des pelotes fécales de zooplancton de forme ovoïde ou cylindrique prises dans un agrégat blanchâtre de phytoplancton.
C. Observation au microscope optique d'un agrégat de cellules phytoplanctoniques constitué principalement de chaines de diatomées.
D. Observation au microscope électronique de cellules de diatomées dont on reconnaît les frustules siliceux.
Pour mesurer la pompe biologique, l'approche traditionnelle consiste à collecter les particules qui chutent dans l'océan à l'aide d'un piège à particules. Cet entonnoir géant est placé à une profondeur prédéterminée le long d'une ligne de mouillage ancrée au fond marin (figures 9 et 10). Les particules qui tombent dans l'entonnoir sont dirigées vers un carrousel de 12 à 24 godets remplis d'une solution de préservation (chlorure mercurique ou formol). Chaque godet collecte la matière particulaire qui tombe pendant quelques jours, puis un moteur fait tourner le carrousel selon un cycle programmé, et le godet suivant est placé en face de l'entonnoir. L'ensemble des godets permet de mesurer la dynamique temporelle de l'export de POC. La ligne de mouillage sur laquelle est fixée le piège est récupérée lors d'une campagne océanographique, généralement après un an de collecte. Le carbone organique contenu dans les godets est ensuite analysé en laboratoire par combustion suivie d'une détection du CO2 libéré par spectrométrie infrarouge. En divisant la quantité de POC accumulée par le temps de collecte et l'aire du piège à particules, on obtient un flux d'export de POC en mol/m2/a. D'autres méthodes qui ne nécessitent pas de déployer une ligne de mouillage ont été développées pour mesurer ponctuellement la pompe biologique. On peut citer par exemple les méthodes géochimiques utilisant les isotopes du thorium qui s'adsorbent sur les particules marines. Plus récemment, des méthodes optiques ont été développées qui photographient à très haute résolution la quantité et la taille des particules marine dans la colonne d'eau, ensuite converties en flux selon des modèles physiques et/ou statistiques. Ces méthodes ont considérablement augmenté la quantité de données collectées, tout en baissant les couts d'acquisition. Cependant, seuls les pièges à particules permettent un accès direct à la matière exportée afin de caractériser finement la chimie et la biologie des particules marines.

Source - © - — Technicap
Le piège conique de grande taille porte à sa base un carrousel de godets qui échantillonnent tour à tour les particules marines collectées par le piège. La grande surface de ce piège permet de collecter de nombreuse particules dans les environnements peu productifs.

Source - © 2025 — Mathieu Rembauville
A. Le piège cylindrique, ici tête en bas, est fixé sur la ligne de mouillage. La forme en cylindre est moins sensible aux courants que la forme conique de la figure 9.
B. Détail du carrousel portant les 12 godets qui vont collecter les particules marines pendant plusieurs mois.
C. Le déploiement se termine par la mise à l'eau du lest en béton qui ancre la ligne de mouillage au fond de l'océan. On distingue sur le pont les bouées ainsi que les largueurs acoustiques (deux cylindres métalliques) qui libéreront la ligne en réponse à une émission acoustique du navire lors de la campagne de récupération du piège.
D. Schéma de la ligne de mouillage déployée sur le plateau des iles Kerguelen en 2016 lors de la campagne SOCLIM.
Les premiers déploiements massifs de pièges à particules réalisés par l'équipe du chercheur américain John Martin dans le Pacifique Nord à la fin du XXe siècle ont mis en évidence une décroissance du flux de POC avec la profondeur (figure 11 ; Martin et al., 1987[14]). Elle est causée par la consommation des particules organiques au cours de leur chute par les organismes hétérotrophes (bactéries et zooplancton), qui les reminéralisent en CO2. Martin formalisera cette décroissance par une équation qui porte son nom :
F z = F 100 × ( z 100 ) − b.
Fz est le flux de POC à une profondeur z, F100 est le flux de POC à 100 mètres de profondeur, et l'exposant b quantifie l'intensité de l'atténuation du flux avec la profondeur. Le paramètre b résume le fonctionnement de l'écosystème pélagique : une valeur faible correspond à une faible activité hétérotrophe donc une faible reminéralisation et une séquestration efficace du POC dans l'océan profond. Inversement, une valeur élevée de b traduit une reminéralisation intense par les organismes hétérotrophes, une forte atténuation du flux de POC avec la profondeur et donc une faible efficacité de la pompe biologique. En moyenne le flux de POC atteignant les fonds océaniques ne représente qu'environ 1 % de la production primaire de surface, et les estimations globales de l'intensité de la pompe biologique aboutissent à une valeur de 0,6 GtC/a séquestré à 1 000 mètres (Doney et al., 2024[4]). L'incertitude sur ce flux est considérable (± 50 %), notamment du fait d'un nombre limité d'observations d'export de POC causé par la logistique complexe et le cout important du déploiement des lignes de mouillage.
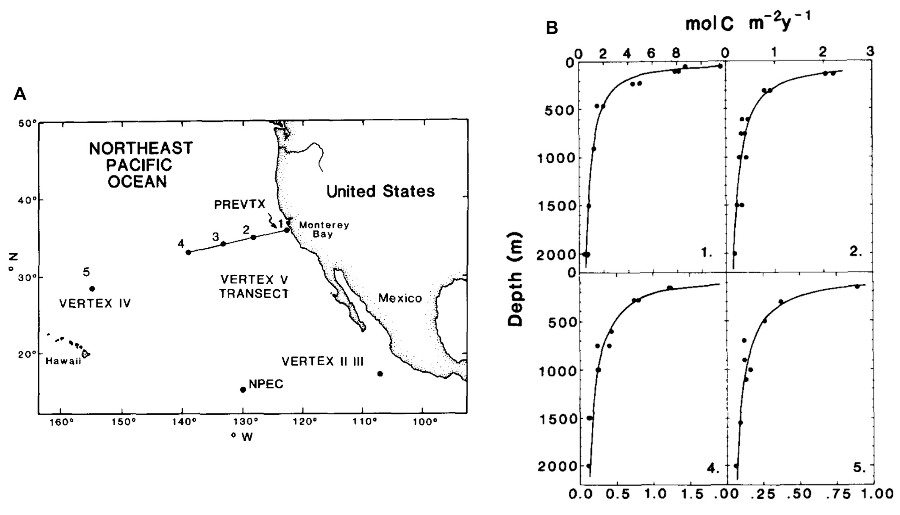
Source - © - — Martin et al., 1987 [ 14 ]
A. Carte des déploiements de pièges à particules des différents programmes VERTEX entre 1978 et 1984. Chaque point correspond à une ligne de mouillage sur laquelle des pièges ont été déployés à différentes profondeurs.
B. Flux vertical de POC dérivé des mesures de pièges à particules aux stations 1, 2, 4 et 5. La courbe représente une fonction puissance ajustée aux données, dite « courbe de Martin ». Elle décrit l'atténuation du flux de POC avec la profondeur, provoquée par sa consommation et reminéralisation en CO2 par les organismes hétérotrophes.
La plus longue série temporelle de flux de POC actuellement disponible est localisée dans l'océan Atlantique tropical à l'observatoire BATS (Bermuda Atlantic Time Series, figure 12). Depuis 1988, des déploiements successifs de pièges à particules à 300 mètres, couplés à des mesures de production primaire en surface, ont permis de caractériser la dynamique temporelle de la pompe biologique. Si la production primaire phytoplanctonique montre un signal saisonnier clair, avec une efflorescence printanière et une production faible en hiver, il ne semble pas y avoir de lien direct avec le flux de POC mesuré à 300 mètres de profondeur. On ne peut donc pas directement relier l'intensité de l'export de POC à l'intensité de sa production en surface, et il faut prendre en compte la complexité de l'écosystème pélagique (des bactéries aux prédateurs supérieurs) pour comprendre comment le flux de carbone organique est atténué avec la profondeur. De telles séries temporelles d'observation continue restent rares : on pourra citer l'observatoire français DYFAMED (Méditerranée Ouest), l’anglais PAP (Atlantique Nord-Est) ou l’allemand CB (Cap Blanc, au large de la Mauritanie). Elles restent fondamentales pour constituer des séries suffisamment longues pour pouvoir y détecter de potentiels signaux climatiques.
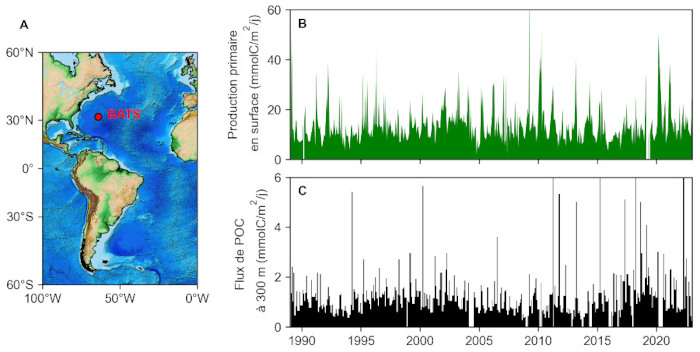
Source - © 2025 — Mathieu Rembauville d'après les données du Bermuda Institute of Ocean Sciences
A. Localisation de la station d'observation à long terme BATS (Bermuda Atlantic Time Series).
B. Production primaire phytoplanctonique dans l'océan de surface mesurée au cours de campagnes hebdomadaires.
C. Flux de POC collecté à 300 mètres de fond par un piège à particule. Chaque barre verticale noire correspond au matériel collecté par un godet. Les périodes sans données traduisent des conditions n'ayant pas permis de récupérer et redéployer la ligne de mouillage.
La pompe (ou contre-pompe) des carbonates
Le plancton calcifiant fabrique des tests constitués de carbonate de calcium (figure 13). Le minéral produit dépend du groupe taxonomique : les coccolithophoridés et les foraminifères fabriquent de la calcite (système cristallin rhomboédrique) tandis que les ptéropodes fabriquent des coquilles en aragonite (système cristallin orthorhombique). Lors de la bioprécipitation du carbonate de calcium dans l'océan de surface, du CO2 est libéré selon la réaction :
Ca2+ + 2 HCO3− → CaCO3 + H2O + CO2.
Le carbonate de calcium (PIC) qui chute dans l'océan constitue une pompe des carbonates exportés en profondeur mais aussi une source de CO2 en surface qui s'oppose au puits de CO2 de la pompe biologique des tissus mous (POC). C'est la raison pour laquelle on désigne souvent l'export de PIC sous le terme « contre-pompe » des carbonates. Pour estimer son importance, il faut mesurer le rapport stœchiométrique PIC:POC de la matière particulaire collectée dans les pièges à particules, et affecter à ce ratio un paramètre ψ qui correspond aux moles de CO2 libérées par moles de CaCO3 précipitées lors de la fabrication des test carbonatées. Le facteur ψ dépend de la température et de la pCO2 de l'eau dans laquelle a lieu la précipitation et varie de 0,6 à 0,8 pour l'océan actuel (Frankignoulle et al., 1994[7]).
CCP = PIC POC × Ψ.
La contre-pompe des carbonates (CCP), généralement exprimée en %, représente ainsi la fraction du CO2 fixé par la pompe biologique qui est libérée lors de la bioprécipitation du PIC par les organismes calficiants. Elle est en moyenne inférieure à 10 %, bien qu'elle puisse atteindre plus de 30 % dans les zones où la production carbonatée est importante (Salter et al., 2014[15]).
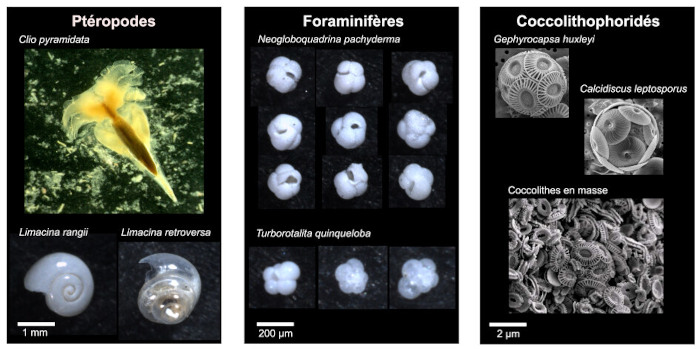
Source - © 2025 — Mathieu Rembauville
Les ptéropodes sont des mollusques qui fabriquent une coquille en aragonite. Les foraminifères sont des unicellulaires appartenant aux Rhizaires dont le test en calcite est constitué de loges successives terminées par une ouverture ombilicale. Les coccolithophoridés sont des unicellulaires appartenant aux Haptophytes qui fabriquent des écailles en calcite, les coccolithes, qui entourent la cellule en formant une coccosphère.
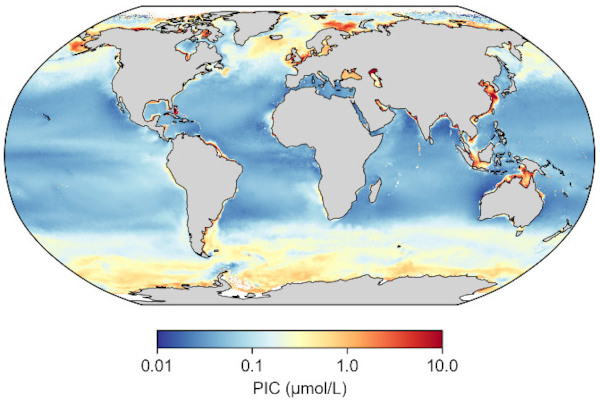
Source - © 2025 — Mathieu Rembauville d'après les données Nasa Ocean Color
Les fortes concentrations aux hautes latitudes, ou « ceintures de calcite », reflètent la présence de coccolithophoridés dans les eaux froides. Les fortes concentrations en zone côtière peuvent être dues à l'apport de PIC détritique terrigène par les fleuves.
La solubilité des carbonates dans l'océan est régie par leur état de saturation Ω, défini comme le rapport du produit ionique sur le produit de solubilité Ksp du minéral considéré (ici calcite ou aragonite).
Ω = [ Ca 2 + ] × [ CO 3 2 − ] K sp.
Si Ω > 1, les conditions dites « sursaturées » sont propices à la précipitation de carbonate de calcium alors que si Ω < 1, les conditions sont « sous-saturées » et la dissolution du CaCO3 est favorisée. Dans l'océan de surface, l'état de saturation est toujours supérieur à 1 et le plancton calcifiant vivant constitue activement des conditions très largement sursaturées permettant la bioprécipitation du CaCO3. Le produit de solubilité Ksp augmente en profondeur quand la pression augmente et la température diminue. D'une manière générale, le produit de solubilité de l'aragonite est supérieur à celui de la calcite. Dit autrement, l'aragonite se dissout plus facilement que la calcite. La profondeur à laquelle Ω = 1 est appelée profondeur de compensation des carbonates. Elle est en moyenne égale à 1 000 mètres pour l'aragonite et 4 000 mètres pour la calcite. Après la mort du plancton calcifiant, quand le PIC coule sous la profondeur de compensation des carbonates, il se dissout en conditions sous-saturées selon la réaction :
CaCO3 + H2O + CO2 → Ca2+ + 2 HCO3−.
La dissolution des carbonates libère les ions Ca2+ et HCO3− ce qui augmente l'alcalinité des eaux profondes. Ce mécanisme nous fournit une autre manière d'appréhender la pompe des carbonates : on peut la considérer comme une pompe à alcalinité qui consomme de l'alcalinité dans l'océan de surface lors de la précipitation du PIC et la relargue dans l'océan profond après son export et sa dissolution (figure 15). Le flux global de PIC atteignant les sédiments marins est actuellement estimé à 0,1 GtC/a (Berelson et al., 2007[2]) et serait principalement représenté par des tests de foraminifères (jusqu'à 80 %), tandis que la contribution des coccolithophoridés et des ptéropodes serait bien moins importante (Schiebel, 2002[16]). Encore une fois, ces chiffres sont à considérer avec prudence, car l'incertitude est de l'ordre de grandeur de l'estimation.
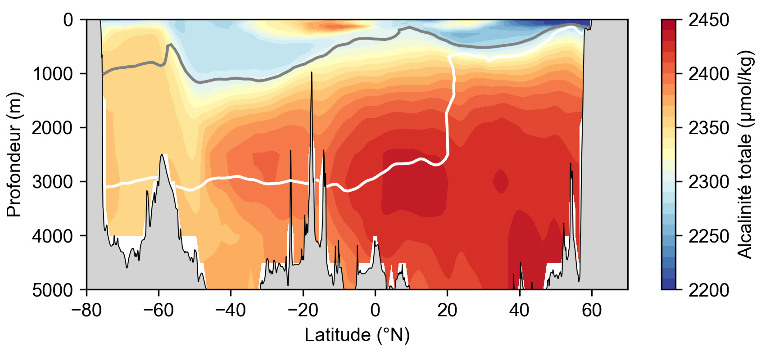
Source - © 2025 — Mathieu Rembauville d'après les données GLODAP : Global Ocean Data Analysis Program
La profondeur de compensation des carbonates (Ω = 1) est représentée par une courbe grise pour l'aragonite et blanche pour la calcite. En surface, la bio-précipitation des carbonates consomme des ions hydrogénocarbonate (HCO3-) et la solubilisation du CO2 aboutit à une augmentation de la concentration en H+. Ces deux mécanismes contribuent à diminuer l’alcalinité totale. Les eaux denses qui plongent aux hautes latitudes depuis la surface et atteignent 1 000 mètres de profondeur possèdent donc une faible alcalinité. Sous la profondeur de compensation des carbonates, la dissolution du carbone inorganique particulaire (PIC) qui coule depuis la surface produit des ions HCO3− qui augmentent l'alcalinité.
La pompe microbienne
Dernière pompe considérée ici, la pompe microbienne concerne le DOC et fait intervenir le compartiment bactérien. La mesure du DOC total est réalisée par oxydation et détection du CO2 émis par spectrométrie infrarouge. La nature chimique des molécules qui le composent est identifiée par chromatographie liquide couplée à la spectrométrie de masse. Le DOC produit dans l'océan de surface par le phytoplancton et le zooplancton peut être subdivisé en différentes fractions, définies par leur temps de demi-vie. Le DOC labile (LDOC) est constitué de molécules riches en énergie comme des glucides et des lipides facilement consommés par les bactéries, ce qui lui confère un temps de demi-vie court (quelques semaines tout au plus). Le DOC réfractaire (RDOC) est constitué de molécules organiques complexes, souvent partiellement dégradées par les hétérotrophes, potentiellement associées à des minéraux, et qui ne peuvent pas entrer dans les voies cataboliques des bactéries hétérotrophes. Le temps de demi-vie du RDOC peut alors atteindre plusieurs milliers d'années. Si ce DOC réfractaire est emporté par la circulation thermohaline, il peut alors être séquestré à grande échelle de temps dans l'océan profond (figure 16), constituant ainsi la « pompe microbienne de carbone » océanique.
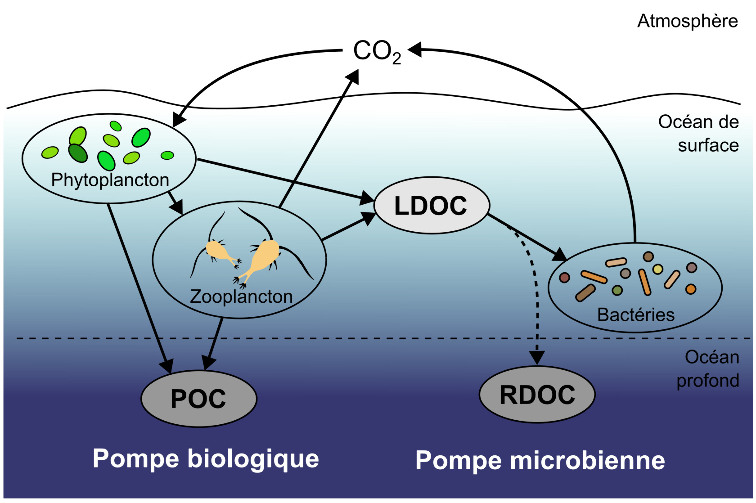
Source - © 2025 — Mathieu Rembauville
Les termes peuvent porter à confusion : la pompe microbienne est bien réalisée par des processus biologiques, mais elle décrit uniquement la séquestration de carbone organique dissout réfractaire (RDOC) qui est le résidu de la consommation du carbone organique dissout labile (LDOC) par les bactéries. La pompe biologique au sens strict décrit uniquement la séquestration de la fraction particulaire du carbone organique (POC) dans l'océan profond.
Les stocks et la nature du DOC océanique sont connus (figure 17), cependant la mesure du flux de RDOC profond est complexe étant donné le temps de résidence considéré et la lenteur de la circulation thermohaline. Un modèle appliqué au RDOC possédant un temps de résidence supérieur à 100 ans aboutit à un flux estimé de 0,2 GtC/a à une profondeur de 1 000 mètres pour la pompe microbienne (Legendre et al., 2015[12]). De nombreuses interrogations persistent, comme le lien entre la diversité bactérienne et l'intensité des flux métaboliques dans l'océan profond. Or le métabolisme des bactéries dépend de la pression, il n'est donc pas possible d'extrapoler directement les taux métaboliques mesurés en laboratoire à la pression atmosphérique. Ces questions nécessitent le développement de nouvelles méthodes d'étude et sont au cœur d'un champ foisonnant de recherche aux frontières de la génomique et de la chimie marine : l'océanographie microbienne.
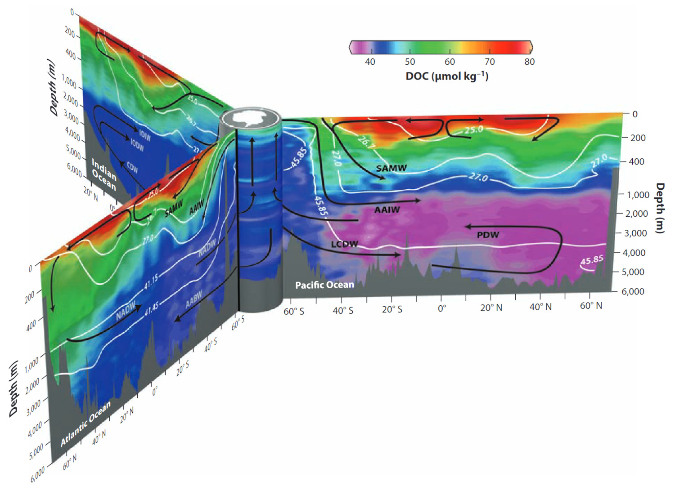
Source - © - — Hansell, 2013 [ 9 ]
Le DOC est produit par exsudation du phytoplancton et excrétion du zooplancton en surface. Il est ensuite consommé et reminéralisé par les bactéries dans l'océan profond tout au long de son transport par la circulation thermohaline. Les faibles concentrations localisées à plus de 1 000 mètres de profondeur dans le Pacifique (couleur violette) sont essentiellement constituées de DOC réfractaire résiduel au temps de demi-vie dépassant le millier d'années. Ce stock de carbone organique peu consommable, et donc peu reminéralisable, séquestre à long terme le carbone dans l'océan et limite son retour dans l'atmosphère.
NADW North Atlantic Deep Water ; SAMW Subantarctic Mode Water ; AAIW Antarctic Intermediate Water ; AABW Antarctic Bottom Water ; LCDW Lower Circumpolar Deep Water ; PDW Pacific Deep Water.

Source - © 2025 — Mathieu Rembauville, campagne OMER 2012
L'instrument du haut (RESPIRE, REspiration of Sinking Particles In the subsuRface ocEan) collecte la neige marine et mesure la consommation de dioxygène due à la respiration des bactéries attachées aux particules. L'instrument du bas (IODA, In situ Oxygen Dynamic Autosampler) est une chambre d'incubation déployée ouverte et qui se ferme à une profondeur voulue pour mesurer la respiration des bactéries libres en suspension dans la masse d'eau.
Synthèse et implications climatiques
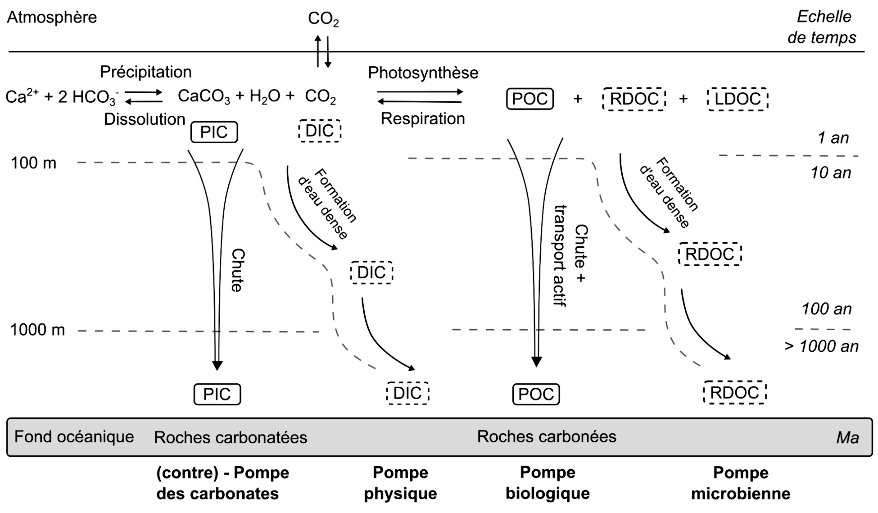
Source - © 2025 — Mathieu Rembauville
Les échelles de temps représentent l'ordre de grandeur du temps de résidence du carbone dans les différentes couches océaniques avant qu'il ne rejoigne l'atmosphère.
Si des incertitudes demeurent dans la valeur absolue des flux de carbone, la comparaison de l'intensité des pompes océaniques de carbone permet de dégager une tendance. La pompe la plus efficace actuellement est la pompe physique, avec un puits net de 3 ± 0,5 GtC/a. C'est également la mieux mesurée et donc celle associée à la plus faible incertitude. Elle représente un peu plus d'un quart des 11 Gt de carbone émis annuellement par les activité humaines (10 Gt causées par la combustion des énergies fossiles, 1 Gt attribuée au changement d'usage des sols). Son intensité est équivalente au puits de carbone constitué par la biosphère continentale, ces deux puits additionnés fixant alors la moitié des émissions anthropiques annuelles de carbone (figure 18). La pompe océanique physique est cependant saturable : elle n'existe que tant que la pCO2 de l'océan est inférieure à celle de l'atmosphère. De plus, la solubilité du CO2 et l'intensité de la formation d'eau dense sont également affectés par le changement climatique via le réchauffement global et la modification des vents. L'efficacité de la pompe physique océanique aurait ainsi diminué de 13 % sur les vingt dernières années à cause du changement climatique (Bunsen et al., 2024[3]).
La pompe biologique est actuellement peu efficace avec un flux global estimé de 0,6 GtC/a à 1 000 mètres de profondeur. Dans l'océan moderne, les surfaces océaniques éloignées des continents sont limitées en micronutriments tel que le fer, ce qui contribue à expliquer la faible efficacité de la pompe biologique. Les carottes de sédiments océaniques montrent qu'au dernier maximum glaciaire, il y a environ 21 000 ans, l'apport atmosphérique de fer à l'océan Austral était considérablement plus élevée. De manière concomitante les carottes de glaces montrent une diminution de la pCO2 atmosphérique de 280 à 180 ppm. Cette fertilisation par le fer est probablement causée par une modification de la circulation atmosphérique et une augmentation de la mobilisation des poussières en période glaciaire. Elle pourrait avoir soutenu une pompe biologique plus intense qui aurait contribué à diminuer la pCO2 atmosphérique. C'est l'« hypothèse du fer » formulée en 1990 par Martin (Martin, 1990[13]), le même qui déployait les pièges à particules dans le Pacifique quelques années plus tôt. Des études de modélisation plus récentes suggèrent que la fertilisation par le fer pourrait expliquer une diminution du CO2 atmosphérique de 50 ppm en période glaciaire en augmentant l'efficacité de la pompe biologique (Yamamoto et al., 2019[17]). À plus grande échelle de temps (plusieurs millions d'années), l'accumulation de POC dans les sédiments marins et son entrée en subsidence est à l'origine de la formation du pétrole, lequel pétrole est actuellement brulé à une vitesse infiniment plus rapide que sa vitesse de formation.
La contre-pompe des carbonates représente une source de CO2 pour l'océan de surface qui diminue l'efficacité de la pompe biologique d'environ 10 % en moyenne. Elle constitue cependant un flux d'alcalinité qui augmente le pouvoir tampon de l'océan profond. Des carottes sédimentaires suggèrent une augmentation de la production carbonatée des foraminifères et des coccolithophoridés à la fin de la dernière période glaciaire dans l'océan Austral, ce qui pourrait avoir stimulé la contre-pompe des carbonates et favorisé la sortie de glaciation (Duchamp-Alphonse et al., 2018[5]). À plus grande échelle de temps, l'accumulation de tests calcaires au fond des océans aboutit à la formation de roches carbonatées qui, des millions d'années plus tard, après surrection et érosion, façonnent les paysages calcaires qui nous entourent.
La pompe microbienne reste la plus énigmatique et la moins bien caractérisée. Son étude est complexe car elle nécessite de mesurer à très grande profondeur des flux très faibles comme la respiration bactérienne et la production de RDOC. Il n'existe actuellement aucun traceur permettant d'estimer les variations passées de la pompe microbienne.
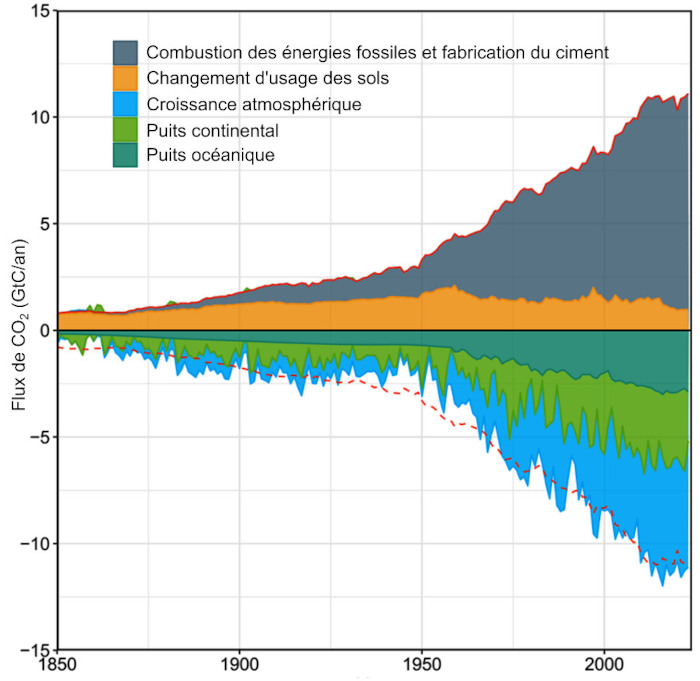
Source - © - — D’après Friedlingstein et al., 2025 [ 8 ] , francisé
Les émissions anthropiques annuelles sont représentées par un flux positif. Les puits sont représentés par un flux négatif. Toutes les estimations sont indépendantes et issues de modèles alimentés par des données de terrain. La courbe rouge pointillée, symétrique de la somme des sources, représente le puits total théorique attendu pour compenser les sources.
Les mécanismes associés aux quatre pompes de carbone océaniques sont des mécanismes lents qui agissent avec des vitesses inférieures à celle des émissions anthropiques de CO2. Rappelons que la pCO2 atmosphérique est passée de 280 à 420 ppm au cours des deux derniers siècles, soit une augmentation de 50 %. Des ambitions techno-solutionistes relevant de la géo-ingénierie proposent de stimuler artificiellement les pompes océaniques de carbone pour accélérer le puits de CO2. Parmi les techniques envisagées, on peut citer la fertilisation artificielle de l'océan en fer pour stimuler la pompe biologique ou bien l'augmentation de l'alcalinité océanique pour augmenter la pompe physique. Ces solutions sont difficiles à envisager techniquement et leur efficacité ainsi que les conséquences environnementales associées sont inconnues. En octobre 2022, l'Organisation Maritime Internationale(lien externe - nouvelle fenêtre), une institution spécialisée de l'ONU, a conclu lors de la réunion consultative des parties que « les activités de géo-ingénierie marine ne devraient pas être considérées comme pouvant remplacer les mesures visant à réduire les émissions de dioxyde de carbone ». La seule solution techniquement réalisable et scientifiquement honnête reste donc, encore et toujours, une diminution des émissions anthropiques de carbone.
Bibliographie
- D.C.E. Bakker, B. Pfeil, C.S. Landa, N. Metzl, K.M. O'Brien, A. Olsen, K. Smith, C. Cosca, S. Harasawa, S.D. Jones, S. Nakaoka, Y. Nojiri, U. Schuster, T. Steinhoff, C. Sweeney, T. Takahashi, B. Tilbrook, C. Wada, R. Wanninkhof, S.R. Alin, C.F. Balestrini, L. Barbero, N.R. Bates, A.A. Bianchi, F. Bonou, J. Boutin, Y. Bozec, E.F. Burger, W.-J. Cai, R.D. Castle, L. Chen, M. Chierici, K. Currie, W. Evans, C. Featherstone, R.A. Feely, A. Fransson, C. Goyet, N. Greenwood, L. Gregor, S. Hankin, N.J. Hardman-Mountford, J. Harlay, J. Hauck, M. Hoppema, M.P. Humphreys, C.W. Hunt, B. Huss, J.S.P. Ibánhez, T. Johannessen, R. Keeling, V. Kitidis, A. Körtzinger, A. Kozyr, E. Krasakopoulou, A. Kuwata, P. Landschützer, S.K. Lauvset, N. Lefèvre, C. Lo Monaco, A. Manke, J.T. Mathis, L. Merlivat, F.J. Millero, P.M.S. Monteiro, D.R. Munro, A. Murata, T. Newberger, A.M. Omar, T. Ono, K. Paterson, D. Pearce, D. Pierrot, L.L. Robbins, S. Saito, J. Salisbury, R. Schlitzer, B. Schneider, R. Schweitzer, R. Sieger, I. Skjelvan, K.F. Sullivan, S.C. Sutherland, A.J. Sutton, K. Tadokoro, M. Telszewski, M. Tuma, S.M.A.C. van Heuven, D. Vandemark, B. Ward, A.J. Watson, S. Xu, 2016. A multi-decade record of high-quality fCO2 data in version 3 of the Surface Ocean CO2 Atlas (SOCAT)(lien externe - nouvelle fenêtre), Earth System Science Data, 8, 383–413 [CC BY 4.0]
- W.M. Berelson, W.M. Balch, R. Najjar, R.A. Feely, C. Sabine, K. Lee, 2007. Relating estimates of CaCO3 production, export, and dissolution in the water column to measurements of CaCO3 rain into sediment traps and dissolution on the sea floor: A revised global carbonate budget(lien externe - nouvelle fenêtre), Global Biogeochemical Cycles, 21 [Free Access]
- F. Bunsen, C. Nissen, J. Hauck, 2024. The Impact of Recent Climate Change on the Global Ocean Carbon Sink, Geophysical Research Letters, 51, e2023GL107030 [Open access]
- S.C. Doney, K.A. Mitchell, S.A. Henson, E. Cavan, T. DeVries, N. Gruber, J. Hauck, C.B. Mouw, J.D. Müller, F.W. Primeau, 2024. Observational and Numerical Modeling Constraints on the Global Ocean Biological Carbon Pump(lien externe - nouvelle fenêtre), Global Biogeochemical Cycles, 38, e2024GB008156 [Open access]
- S. Duchamp-Alphonse, G. Siani, E. Michel, L. Beaufort, Y. Gally, S.L. Jaccard, 2018. Enhanced ocean-atmosphere carbon partitioning via the carbonate counter pump during the last deglacial(lien externe - nouvelle fenêtre), Nature Communications, 9, 2396 [Open access]
- A.R. Fay, L. Gregor, P. Landschützer, G.A. McKinley, N. Gruber, M. Gehlen, Y. Iida, G.G. Laruelle, C. Rödenbeck, A. Roobaert, J. Zeng, 2021. SeaFlux: harmonization of air–sea CO2 fluxes from surface pCO2 data products using a standardized approach(lien externe - nouvelle fenêtre), Earth System Science Data, 13, 4693-4710 [CC BY 4.0]
- M. Frankignoulle, C. Canon, J.-P. Gattuso, 1994. Marine calcification as a source of carbon dioxide: Positive feedback of increasing atmospheric CO2(lien externe - nouvelle fenêtre), Limnology and Oceanography, 39, 458-462 [Free Access]
- P. Friedlingstein, M. O'Sullivan, M.W. Jones, R.M. Andrew, J. Hauck, P. Landschützer, C. Le Quéré, H. Li, I.T. Luijkx, A. Olsen, G.P. Peters, W. Peters, J. Pongratz, C. Schwingshackl, S. Sitch, J.G. Canadell, P. Ciais, R.B. Jackson, S.R. Alin, A. Arneth, V. Arora, N.R. Bates, M. Becker, N. Bellouin, C.F. Berghoff, H.C. Bittig, L. Bopp, P. Cadule, K. Campbell, M.A. Chamberlain, N. Chandra, F. Chevallier, L.P. Chini, T. Colligan, J. Decayeux, J.M. Djeutchouang, X. Dou, C. Duran Rojas, K. Enyo, W. Evans, A.R. Fay, R.A. Feely, D.J. Ford, A. Foster, T. Gasser, M. Gehlen, T. Gkritzalis, G. Grassi, L. Gregor, N. Gruber, Ö. Gürses, I. Harris, M. Hefner, J. Heinke, G.C. Hurtt, Y. Iida, T. Ilyina, A.R. Jacobson, A.K. Jain, T. Jarníková, A. Jersild, F. Jiang, Z. Jin, E. Kato, R.F. Keeling, K. Klein Goldewijk, J. Knauer, J.I. Korsbakken, X. Lan, S.K. Lauvset, N. Lefèvre, Z. Liu, J. Liu, L. Ma, S. Maksyutov, G. Marland, N. Mayot, P.C. McGuire, N. Metzl, N.M. Monacci, E.J. Morgan, S.-I. Nakaoka, C. Neill, Y. Niwa, T. Nützel, L. Olivier, T. Ono, P.I. Palmer, D. Pierrot, Z. Qin, L. Resplandy, A. Roobaert, T.M. Rosan, C. Rödenbeck, J. Schwinger, T.L. Smallman, S.M. Smith, R. Sospedra-Alfonso, T. Steinhoff, Q. Sun, A.J. Sutton, R. Séférian, S. Takao, H. Tatebe, H. Tian, B. Tilbrook, O. Torres, E. Tourigny, H. Tsujino, F. Tubiello, G. van der Werf, R. Wanninkhof, X. Wang, D. Yang, X. Yang, Z. Yu, W. Yuan, X. Yue, S. Zaehle, N. Zeng, J. Zeng, 2025. Global Carbon Budget 2024(lien externe - nouvelle fenêtre), Earth System Science Data, 17, 3, 965-1039 [CC BY 4.0]
- D.A. Hansell. 2013. Recalcitrant Dissolved Organic Carbon Fractions(lien externe - nouvelle fenêtre), Annual Review of Marine Science, 5, 421-445 [PDF – Texte intégral(lien externe - nouvelle fenêtre)]
- G.J. Herndl, T. Reinthaler, 2013. Microbial control of the dark end of the biological pump(lien externe - nouvelle fenêtre), Nature Geoscience, 6, 718-724 [PDF – Texte intégral(lien externe - nouvelle fenêtre)]
- L. Legendre, R.B. Rivkin, M.G. Weinbauer, L. Guidi, J. Uitz, 2015. The microbial carbon pump concept: Potential biogeochemical significance in the globally changing ocean(lien externe - nouvelle fenêtre), Progress in Oceanography, 134, 432-450 [PDF – Texte intégral(lien externe - nouvelle fenêtre)]
- J.H. Martin, 1990. Glacial-interglacial CO2 change: The Iron Hypothesis(lien externe - nouvelle fenêtre), Paleoceanography, 5, 1, 1-13 [PDF – Texte intégral(lien externe - nouvelle fenêtre)]
- J.H. Martin, G.A. Knauer, D.M. Karl, W.W. Broenkow, 1987. VERTEX: carbon cycling in the northeast Pacific(lien externe - nouvelle fenêtre), Deep Sea Research Part A. Oceanographic Research Papers, 34, 2, 267-285
- I. Salter, R. Schiebel, P. Ziveri, A. Movellan, R. Lampitt, G.A. Wolff, 2014. Carbonate counter pump stimulated by natural iron fertilization in the Polar Frontal Zone(lien externe - nouvelle fenêtre), Nature Geoscience, 7, 885–889 [PDF – Texte intégral(lien externe - nouvelle fenêtre)]
- R. Schiebel, 2002. Planktic foraminiferal sedimentation and the marine calcite budget(lien externe - nouvelle fenêtre), Global Biogeochemical Cycles, 16, ,4, 1065 [Free Access]
- A. Yamamoto, A. Abe-Ouchi, R. Ohgaito, A. Ito, A. Oka, 2019. Glacial CO2 decrease and deep-water deoxygenation by iron fertilization from glaciogenic dust(lien externe - nouvelle fenêtre), Climate of the Past, 15, 3, 981-996 [Open access]
[1] CTD (Conductivity Temperature Depth) : instrument mesurant simultanément la conductivité électrique de l’eau, sa température et la profondeur.


