Article | 11/10/2019
Les vertébrés volants : revue des troupes
2019
Résumé
Ailes, plumes, patagium… l'acquisition du vol (actif ou plané) chez les dinosaures (dont les oiseaux), les ptérosaures et les mammifères.
Table des matières
Un article paru dans la revue Nature le 9 mai 2019 décrivait un curieux dinosaure, assez proche mais néanmoins distinct des oiseaux, dont les pattes antérieures allongées auraient soutenues une membrane lui permettant peut-être de voler à la façon d'une chauve-souris [28]. Une autre étude indépendante repose la question des relations évolutives entre ptérosaures et dinosaures et de la date d'apparition des plumes [31]. Ces fossiles sont l'occasion d'un passage en revue des différents groupes de vertébrés qui, au cours des temps géologiques, ont acquis la capacité à voler, et de comparer leurs solutions à ce mode de propulsion.
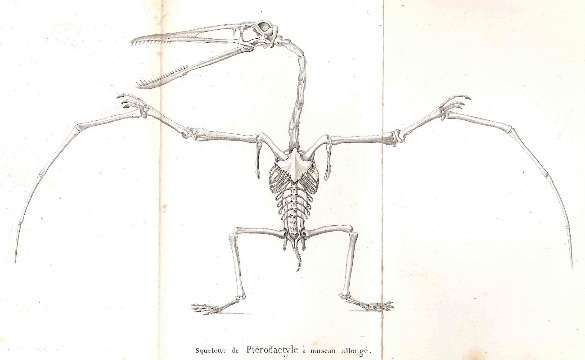
Source - © 1840 G. Cuvier
Source : Georges Cuvier, 1840 (8e éd.). Discours sur les révolutions de la surface du globe et sur les changemens qu'elles ont produits dans le règne animal, Paris, H. Cousin et E. d'Ocagne, 355p.
Introduction
À l'heure actuelle, deux groupes de vertébrés se déplacent activement dans les airs, à côté – et souvent aux dépens – des insectes : les oiseaux et les chauves-souris, ou chiroptères (ou chéiroptères, littéralement “les mains ailées”, ou “les mains en forme d'aile”, terme forgé par Georges Cuvier (1769-1832) en 1798 sur les racines grecques χείρ (cheir), la main, et πτερόν (ptéron), l'aile). On peut y ajouter un deuxième groupe de mammifères nettement plus rares et moins diversifiés, les dermoptères (de δερμα, (derma, dermatos), la peau, et ptéron, défini en 1811 par le zoologue allemand Johan Karl Wilhem Illiger (1775-1813)). Ces derniers –qui représentent par ailleurs les plus proches parents des primates – ne sont pas capables d'un vol battu et ne décollent pas directement du sol, mais effectuent un vol plané après avoir atteint un point haut, par exemple la ramure d'un arbre. D'autres mammifères encore ont développé séparément la capacité de planer, à un degré moindre : des rongeurs comme les écureuils volants, par exemple, ou certains marsupiaux.
La surface élargie et mince, qui fournit à ces animaux la portance nécessaire à leur trajet aérien, se présente sous deux formes :
- chez les Mammifères (mais aussi certains lézards), il s'agit d'un patagium, c'est-à-dire une surface de peau tendue entre des structures allongées, à la façon des baleines d'un parapluie. Chez les dermoptères, elle est attachée entre les pattes antérieures et postérieures, et s'étend aussi entre les pattes arrières et la queue (à la différence des écureuils volant, p. ex.) ; chez les chiroptères, elle est tendue entre des phalanges extrêmement allongées, et également entre pattes et queue ; chez certains lézards volants, ce sont à la fois les membres et les côtes aplaties et étirées qui soutiennent cette membrane ;
- chez les oiseaux, c'est une superposition de phanères spécialisées, allongées et accrochées sur le membre supérieur, les plumes (et plus spécifiquement les rémiges, longues plumes dissymétriques qui forment l'essentiel de la surface de l'aile et la surface caudale).
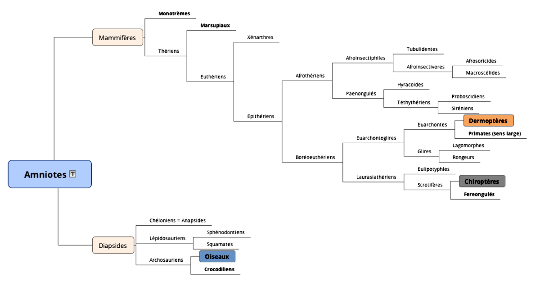
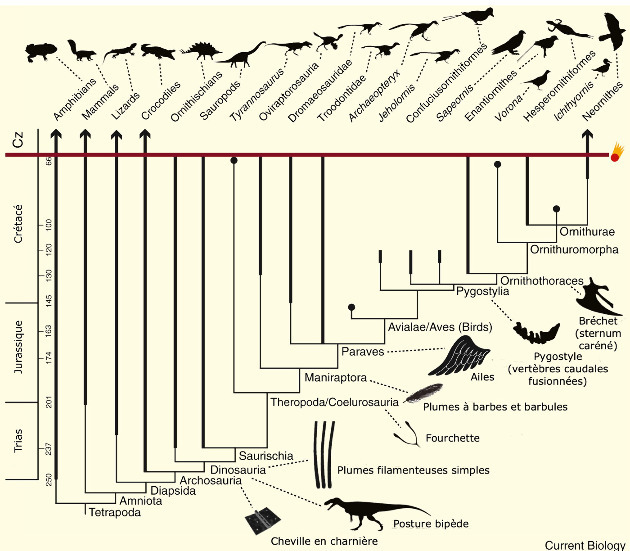
La solution développée par les oiseaux est structuralement nettement différente des autres, indice (parmi d'autres) de l'éloignement phylogénétique des oiseaux par rapport aux deux types de mammifères, évidemment plus proches mais nettement séparés (figure 2). Ces trois groupes sont reconnus comme des clades monophylétiques par la phylogénie moderne (les espèces que chacun contient descendent toutes d'une population ancestrale commune)[1] .
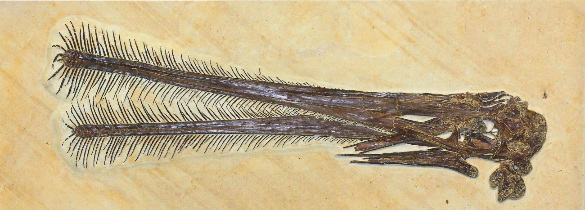
Les fossiles récoltés et analysés depuis deux siècles, et surtout au cours des dernières décennies, ont éclairci l'histoire évolutive de ces groupes, notamment celle des oiseaux, désormais affiliés aux dinosaures. Mais ils ont aussi largement étendu le registre des animaux et des groupes d'espèces qui ont un jour évolué dans les airs au cours des 200 derniers millions d'années. Un groupe majeur et entièrement éteint s'y est très tôt ajouté, celui des ptérosaures (Pterosauria). C'est encore Georges Cuvier qui décrivit correctement le premier fossile attribué à ce groupe, qu'il identifia comme un reptile (un Diapside, cf. figure 2) et non comme une forme inconnue de chauve-souris [24] et qu'il baptisa Pterodactylus (“le doigt ailé” ou “l'aile faite d'un doigt”, figure 1). Bien que leurs fossiles restent rares et souvent fragmentaires, on sait aujourd'hui qu'ils se diversifièrent intensément et occupèrent les cieux durant plus de 150 millions d'années, du Trias (vers 220 Ma) jusqu'à la fin du Crétacé (66 Ma). Par ailleurs, des découvertes récentes suggèrent qu'à côté des oiseaux, un groupe de dinosaures a développé auparavant, et indépendamment, un autre type d'aile, assez similaires à celles des ptérosaures ou des chauve-souris.
Source - © 2017 D'après Lecointre et Le Guyader [16]
Figure 2. Phylogénie des Amniotes
Les trois groupes cités (Oiseaux, Chiroptères, Dermoptères) sont soulignés.
Les dinosaures : non-aviens, non-aviens volants, aviens...
Ironiquement, c'est le même savant britannique, Richard Owen (1804-1892) – véritable fondateur de la paléontologie mais opposé à la théorie de l'évolution de son compatriote Charles Darwin (1809-1882) – qui analysa les premiers fossiles de dinosaures, inventa pour eux ce nom de « terribles lézards » (toujours du grec, deinos, terrible, et sauron, lézard) en 1842 et décrivit en 1863 l'un des premiers fossiles d'Archæopteryx découvert en Allemagne, dans la paléo-lagune de Solnhofen, sans pour autant relier les premiers au second. Ce qui se conçoit puisque les restes d'Archæopteryx montraient des plumes bien identifiables et un squelette bipède (le tout premier fossile découvert en 1860 consistait d'ailleurs en une seule rémige isolée), alors que les premières reconstitutions de dinosaures en faisaient des quadrupèdes patauds ressemblant à des iguanes et recouverts d'écailles. Rappelons aussi que la phylogénie et la classification des dinosaures ont toutes deux affirmé, jusqu'à très récemment, une division fondamentale du groupe selon la forme de leur bassin, entre les Saurischiens (« à bassin de reptile ») et les ornitischiens (« à bassin d'oiseaux »), mais que les conclusions récentes enracinent les oiseaux parmi… les saurischiens.
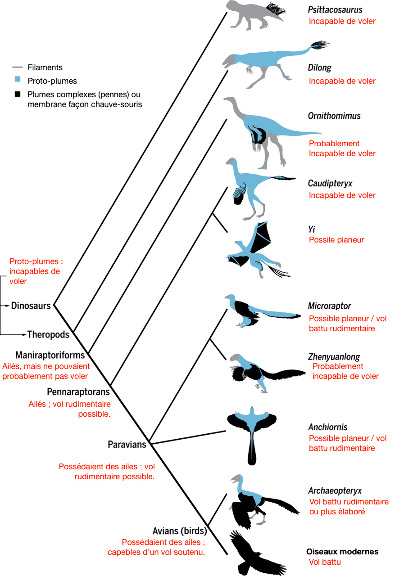
Source - © 2017 D'après Brusatte [6], modifié
Pourtant, l'idée que les oiseaux soient phylogénétiquement proches des dinosaures n'est pas neuve. Elle aurait déjà été avancée par le « bouledogue de Darwin », son ami, défenseur et critique Thomas Henry Huxley (1825-1895) [5]. C'est la découverte de nouveaux fossiles, dans les années 1960, d'abord aux États-Unis (avec le petit théropode carnivore bipède aux longues pattes antérieures Deinonychus, « griffe terrible »), puis plus tard en Chine avec des spécimens arborant des restes de plumes fossilisées, qu'a été confirmé que la plume était apparue avant les oiseaux, chez les dinosaures, et que les oiseaux appartenaient par conséquent aux dinosaures (pour plus de détails sur certains de ces fossiles, voir Plumes fossiles et évolution des oiseaux : quelques nouveautés). Des dinosaures déjà connus auparavant ont aussi été réinterprétés et garnis de plumes suite à de nouvelles découvertes. C'est notamment le cas du fameux Velociraptor, découvert en 1924 et qu'une étude de 2007 suggère de recouvrir de plumes [27].
Les fossiles disponibles aujourd'hui permettent de reconstituer les étapes évolutives qui ont conduit de la plume de duvet très simple, à rôle de protection thermique, portée par des dinosaures non-volant, à la plume complexe, en penne, à barbe et barbule, dissymétrique, formant la surface portante des oiseaux et de leurs plus proches parents non-aviens [19]. De même, l'acquisition, dans la lignée des oiseaux, du vol battu, actif, et de toutes les adaptations morpho-anatomiques qui l'accompagnent, peut aussi être décomposée en stades successifs grâce aux fossiles (figure 3). Néanmoins, cette histoire évolutive restent très schématique, ne serait-ce que parce que les différents spécimens disponibles vivaient dans des régions bien distinctes, à des moments différents : beaucoup de dinosaures emplumés ont été déterrés sur des sites crétacés de Chine, alors que tous les Archæopteryx connus à ce jour proviennent de la région de Solnhofen, en Allemagne.
Quoi qu'il en soit, le groupe des dinosaures n'est monophylétique que si l'on y inclut les oiseaux, passés et actuels. Inversement, la définition des oiseaux devient plus floue. Les chercheurs distinguent donc désormais les oiseaux sensu stricto, Aves, qu'ils insèrent avec des dinosaures emplumés très proches dans les Paraves, et eux-mêmes dans les Pennaraptora, les “raptors à pennes”. Les “vrais” oiseaux sont donc les dinosaures capables de vol battu, prolongé, efficace. Les premiers remontent au Jurassique, il y a 150 Ma environ, avec l'Archæopteryx, toujours considéré comme l'un des premiers oiseaux, même si ce statut a été débattu puis récemment ré-affirmé [13] et que son vol n'était pas aussi efficace que celui des oiseaux modernes.
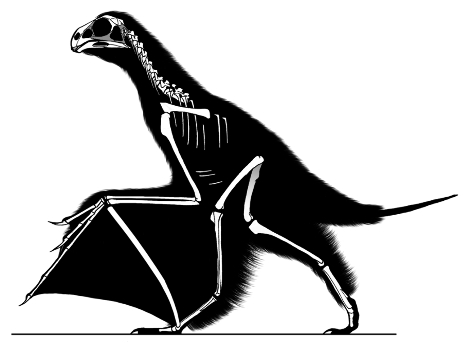
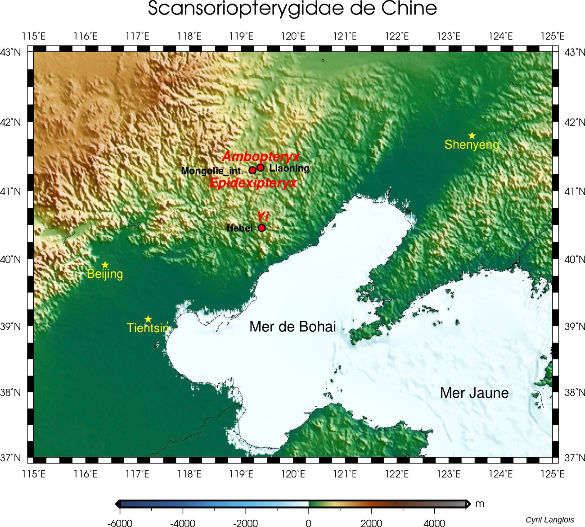
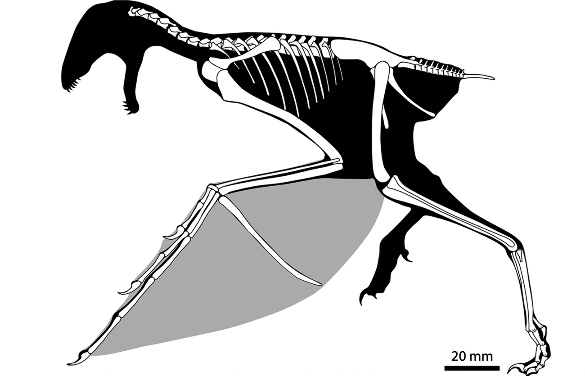
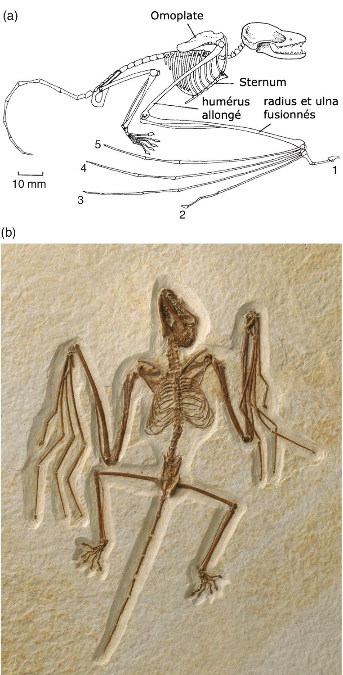
Par ailleurs, les fossiles attribués à ce groupe des Pennaraptora se caractérise par un allongement des membres antérieurs et des phalanges et la réduction du nombre de doigts. Mais chez certains d'entre eux, décrits en 2015 et en mai 2019, un os allongé s'insérait presque perpendiculairement aux doigts sur le poignet et semble avoir soutenu une fine membrane, formant une aile rappelant celle des chauves-souris [28, 30]. Le premier de ces fossiles, décrit en 2015 dans Nature, a été découvert dans la province du Hebei, en Chine, à l'Est de Pékin, dans la formation de Tiaojishan, datée du Callovo-Oxfordien (160 à 153 Ma, donc à peine plus ancien que l'Archæopteryx). Ses découvreurs chinois l'ont baptisé Yi qi (“aile bizarre”, en mandarin), ce qui en fait aussi l'un des quelques fossiles dont le nom n'est pas, de près ou de loin, basé sur des racines grecques ou latines. Ce petit animal (50 cm d'envergure pour probablement moins de 400 g), que les chercheurs qualifient donc explicitement de “bizarre”, possédait à la fois des plumes (reconnaissables sur le fossile, avec des plumes courtes, filamenteuses, recouvrant le corps et de longues plumes au bout de la queue) et une membrane de type patagium (figure 5), dont des fragments apparaissent sur le fossile. Cependant, la surface de ce patagium et sa forme exacte une fois tendue ne sont pas complètement élucidées. Ce fossile venait rejoindre un autre spécimen, Epidexipteryx, décrit sept ans plus tôt, trouvé lui aussi au Nord-Est de Pékin, en Mongolie intérieure [32], ainsi que des fossiles d'animaux juvéniles (dont Scansoriopteryx, “l'aile grimpante” – du latin scancere, grimper, et pteryx, l'aile, mais en grec –, qui a donné son nom à ce sous-groupe des Pennaraptora, les Scansoriopterygidae [11]). Tous ces animaux présentent un ou deux doigts robustes et très allongés au bout d'un membre antérieur de grande taille et sont interprétés comme de petits dinosaures arboricoles.
Source - © 2017 Jaime Headden – CC BY 3.0
En 2019 est venu s'y ajouter un nouveau fossile, qui présente lui aussi un patagium et provient, encore une fois, de Chine. Chez cet animal, comme chez Yi qi, un os allongé en bâton, attaché sur le poignet à côté des trois doigts conservés, venait tendre la membrane du patagium. Baptisé Ambopteryx longibrachium (littéralement [l'animal] “aux deux sortes d'ailes et aux longs bras”, figure 7), celui-là a été retrouvé dans des roches d'âge oxfordien (163 Ma) de la province du Liaoning, environ 120 km au Nord du site du Hebei. Tous ces fossiles se trouvaient donc très proches, dans l'espace (les formations du Nord-Est de la Chine, à cheval sur le Hebei, le Liaoning et la Mongolie-Intérieure, cf. figure 6) comme dans le temps (le Jurassique supérieur).
Pour l'heure, ces animaux ne semblent représenter qu'un petit groupe localisé, dont certaines espèces auraient développé une adaptation originale au vol, restée anecdotique et sans lendemain. Ils montrent que les temps géologiques et l'évolution ont pu produire des formes vivantes qu'aucun auteur de fiction n'avaient encore envisagé. Ces animaux “bizarres” le sont d'autant plus que leurs ailes membraneuses rappellent un autre groupe de reptiles diapsides éteints et volants, proche des dinosaures, celui des ptérosaures. Chez les ptérosaures, comme chez les chiroptères, ce sont des doigts allongés qui tiennent la membrane. Chez ces dinosaures, il semble que ce soit un os surnuméraire[2], ou peut-être un élément du poignet, à l'image du fameux « sixième doigt » du grand panda. Les ailes membraneuses de ces dinosaures sont-elles alors une innovation complète (une convergence évolutive), l'exploitation de voies de développement embryonnaires et de circuits génétiques remontant à leur ancêtre commun avec les ptérosaures (parallélisme), voire un peu des deux ?
Source - © 2019 Wang et al. [28] | Source - © 2019 Chung-Tat Cheung / Nature |
Source - © 2015 Brusatte et al. [7], modifié | |
Parallèlement à cette exploration du vol par les Scansorioptérigydés, les oiseaux ont développé leur propre mode de sustentation dans l'air, par de longues rémiges plutôt que par une membrane, le raccourcissement de la queue et la fusion des vertèbres caudales, l'acquisition du bréchet… Les oiseaux se diversifient ainsi très vite, dès le Crétacé. Certains d'entre eux délaissent même le vol pour exploiter les ressources aquatiques, acquérant des morphologies convergentes avec celle des actuels cormorans. Deux groupes, les Enantiornithes et les Ornithuromorphes vont ainsi se développer à partir du Crétacé inférieur et finalement disparaître à la limite Crétacé-Tertiaire, comme leurs cousins non-aviens. Les oiseaux survivants se diversifient à nouveau rapidement après la limite K-Pg, donnant les Neornithes (figure 9), avec les Paléognathes (“ancienne mâchoires”, qui comprend les ratites actuels : émeu, nandou, autruche...) et les Néognathes (“mâchoire nouvelle”), qui regroupe l'intégralité des autres oiseaux tertiaires et quaternaires.
Les ptérosaures
Les premiers représentants des Pterosauria – souvent associés aux dinosaures par le grand public, alors qu'ils n'en font pas partie – ont commencé à voler une soixantaine de millions d'années avant les dinosaures à patagium ou les Oiseaux. Le premier ptérosaure a été décrit en 1784 par Cosimo Alessandro Collini, alors régisseur du cabinet d'histoire naturelle de l'électeur du Palatinat et de Bavière (et par ailleurs ancien secrétaire de Voltaire). Le spécimen provenait du calcaire lithographique de Bavière, daté aujourd'hui du Jurassique supérieur. Cuvier en eut vent en 1800 par l'intermédiaire de l'un de ses amis, Jean Hermann, résidant à Strasbourg. Celui-ci signala à Cuvier la publication de Collini, en joignant à sa lettre un croquis de sa main de l'animal tel qu'il le reconstituait, munis d'ailes et couvert de poils ; Hermann comme Collini voyait dans cet animal une forme de chauve-souris. C'est sur cette base que Cuvier décrivit le ptérodactyle, dont il fera un reptile plutôt qu'un mammifère [24].
Source - © 2004 D'après Taquet et Padian [24] Figure 10. Croquis de Jean Hermann envoyé à Cuvier en 1800 La lettre d'Hermann décrit l'animal comme « une meilleure espèce intermédiaire entre mammifères et oiseaux que les chauve-souris ». | Source - © 2004 D'après Taquet et Padian [24] Figure 11. Croquis de Jean Hermann envoyé à Cuvier en 1800 Ce second croquis corrige la courbure donnée à l'aile sur le premier, qu'Hermann n'estime finalement pas justifiée. |
Avec cette attribution aux reptiles, puis la découverte de ptérosaures beaucoup plus grands que celui de Collini, ces animaux ont naturellement rejoint les dinosaures dans l'imaginaire collectif des XIXe et XXe siècles, tous les deux faisant puissamment écho, surtout en Europe, au registre culturel et iconographique du dragon. Des avatars de cet amalgame apparaissent encore aujourd'hui : aux États-Unis, des partisans de la « chronologie courte » (doctrine créationniste de la “Terre jeune” qui soutient que l'âge de la Terre ne dépasse pas 6000 ans et que l'Homme a vécu au côté des dinosaures et autres fossiles) avancent que les images de dragons ailés bipèdes qui figurent dans les manuscrits de naturalistes et de lettrés du XVe et XVIe siècles, comme le naturaliste italien Ulisse Aldovrandi (1522-1605), seraient des représentations de ptérosaures, que l'être humain aurait donc côtoyé. Si l'argument peut sembler risible, il a néanmoins motivé des travaux de recherche à la frontière de la paléontologie et de l'étude historique et iconographique, qui en ont démontré l'inanité [20].
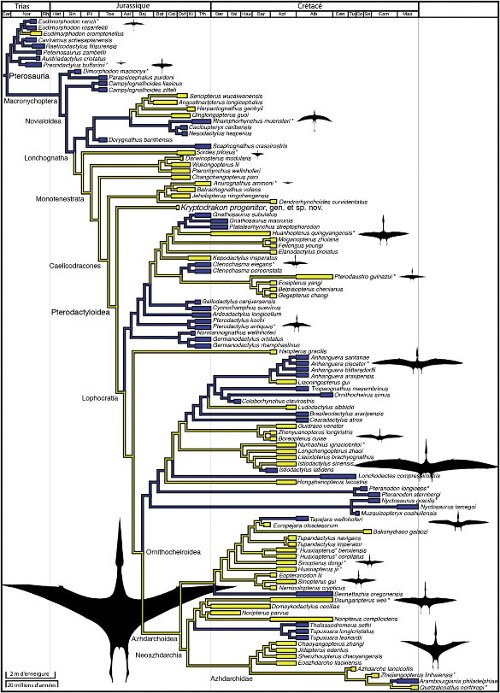
Deux siècles après leur découverte, on sait que l'histoire évolutive des Ptérosaures a été longue, mais elle reste encore mal connue, car les fossiles sont relativement peu nombreux et souvent fragmentaires ; ces animaux aériens, comme les oiseaux, ont développé un squelette très léger, aux os creux, donc fragiles et rarement ou mal fossilisés : comme pour les oiseaux et leurs cousins à plume, les sites fossilifères à ptérosaures sont limités aux gisements à préservation exceptionnelle (Konservat-Lagerstätten), éparpillés dans le temps et l'espace : « les calcaires bitumineux triasiques d'Italie du Nord, les calcaires bitumineux du Jurassique moyen d'Allemagne méridionale, les calcaires lithographiques Jurassique supérieur de Bavière, les nodules du Crétacé inférieur du Brésil, la craie Crétacé supérieure du centre des Etats-Unis [en] sont des exemples bien connus » [8]. Toutefois, cette importance des sites exceptionnels ne biaiseraient pas excessivement le registre des ptérosaures, car « à mesure que de nouvelles espèces ont été découvertes, le nombre de formations et de sites à ptérosaures connus a lui aussi augmenté » [12].
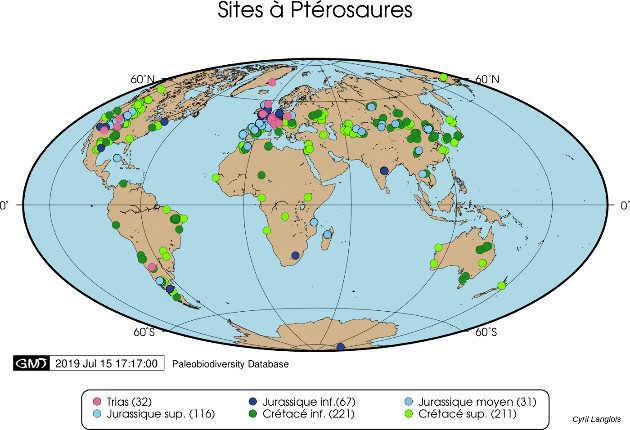
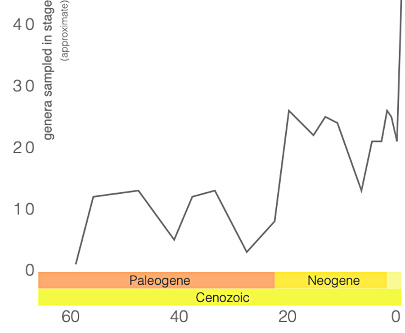
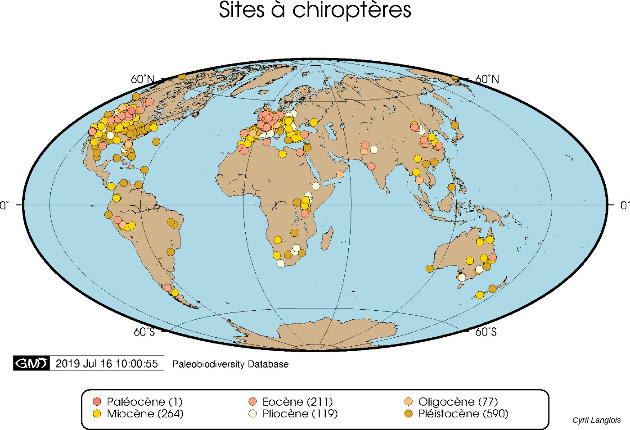
Notons cependant que la base de données utilisées par ces derniers auteurs ne comprenait toujours, en 2009, que 209 spécimens, représentant 110 espèces et 66 genres : bon nombre des genres de ptérosaures ne sont donc représentés que dans un ou deux sites, et sur ces sites par un seul spécimen, rarement complet. Les gisements, eux, s'éparpillent de la Chine à l'Argentine et du Groenland à la Tanzanie, même si l'Europe et les Amériques dominent (figure 21)…
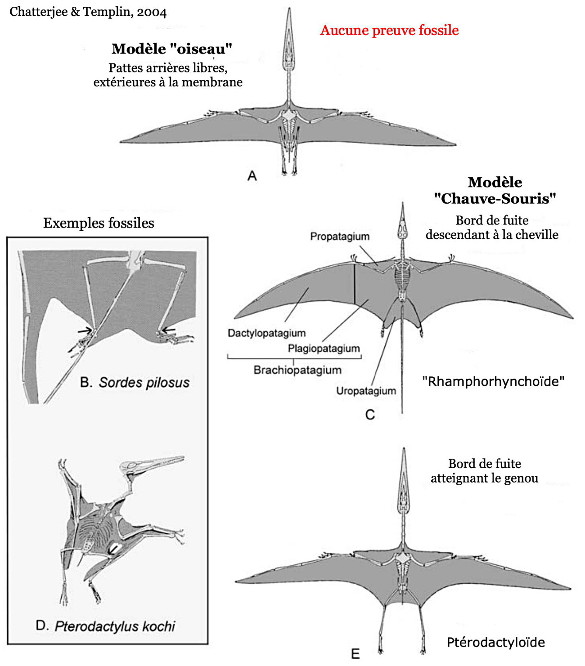
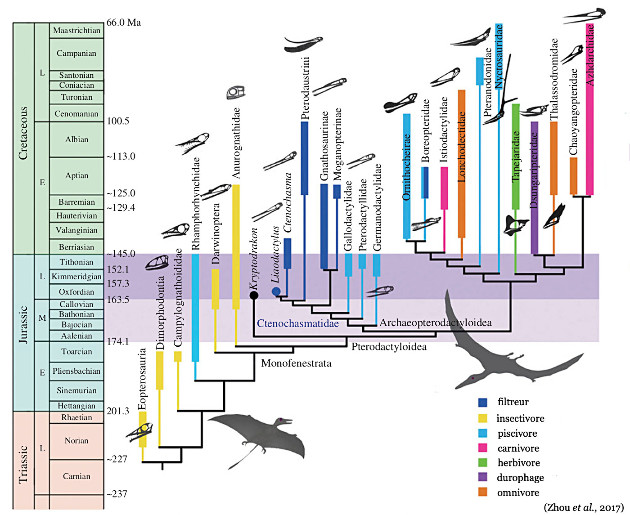
Ces collections modernes, quoique limitées, montrent que ce clade a connu plusieurs phases de diversification, principalement au Jurassique et au Crétacé, et que le plan d'organisation des ptérosaures s'est modifié au cours du temps, avec deux structures successives : une longue queue et un cou relativement court pour toutes les formes de ptérodactyles connues du Trias au Jurassique (le groupe paraphylétique des “rhamphorhynchoïdes”), puis une queue très raccourcie et un cou allongée pour le groupe monophylétique des ptérodactyloïdes (Pterodactyloidae). Ces derniers se développent à partir du Jurassique (figure 12) et sont les seuls qui persistent au Crétacé, durant lequel ils se diversifient largement, notamment au Crétacé inférieur, avec notamment des formes de très grande envergure, dont la silhouette évoque celle des albatros d'aujourd'hui. Bien que les fossiles correspondants soient fragmentaires, on estime que les plus grands de ces ptérosaures ont pu dépasser 10 m d'envergure[3] (l'Albatros hurleur actuel peut atteindre 3,70 m. Un oiseau fossile américain, Pelagornis sandersi, auraient dépassé les 7 m [15]).
Source - © 2014 D'après Andres et al. [1], partiellement francisé
Alors que les ptérosaures à longue queue restent de taille modeste, plusieurs formes de Pterodactyloidea ont évolué en animaux de très grande envergure, principalement au Crétacé.
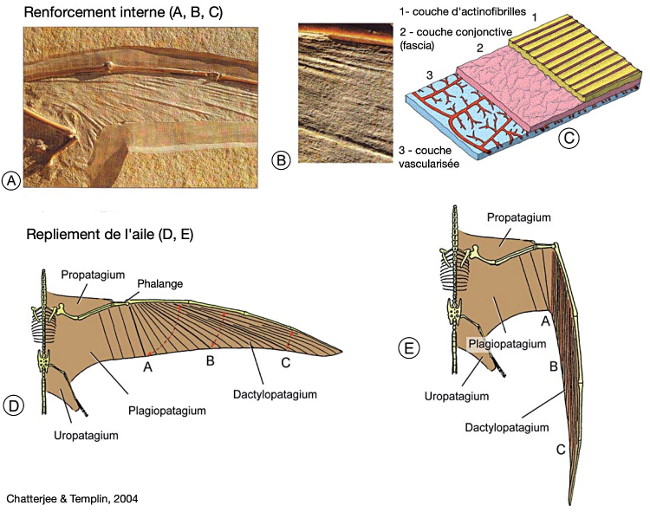
Contrairement aux oiseaux, mais comme chez les chauve-souris, l'aile des ptérosaures était constituée de plusieurs étendues de peau vascularisée. Quelques fossiles exceptionnels ont même permis d'en comprendre la structure, composée de plusieurs couches : sous l'épiderme, le derme comprenait une couche isolante, une ou plusieurs couches fibreuses, une couche de muscles fins et enfin une couche interne vascularisée puis l'épiderme inférieur [3, 18].
Cette membrane n'était par ailleurs pas uniforme, et le patagium comprenait donc plusieurs parties, plus ou moins rigides. La membrane principale (le brachiopatagium) était tendue entre les membres antérieurs et postérieurs, soutenue par l'humérus, l'ensemble radius/ulna, un métacarpe allongé et épais, et enfin les phalanges hypertrophiées du quatrième doigt. Chez certains, elle atteignait la cheville et englobait donc la patte arrière. Chez les Ptérodactyloïdes, il semble qu'elle ne descendait pas en dessous du genou [9]. Comme chez les oiseaux, un système de sacs aériens allégeait le corps ; les sacs s'insinuaient dans les os longs et couraient aussi le long de la phalange hypertrophiée (figure 13). Une deuxième membrane, le propatagium, s'étendait de l'épaule au poignet, où elle s'attachait à un os spécifique, en forme de crochet recourbé, l'os ptéroïde. L'origine embryologique de cet os n'est pas claire : il pourrait correspondre au premier carpe, un os du poignet. Enfin, une troisième membrane, l'uropatagium, s'étirait entre les pattes postérieures et la queue (figure 13).
Source - © 2004 D'après Chatterjee et Templin [9], modifié
A, la structure de cette aile montre des actinofibrilles alignées rigidifiant la membrane portante. B, zoom sur les actinofibrilles. C, reconstitution de la structure en coupe de l’aile. D et E, disposition des actinofibrilles et détail des sous-parties du patagium lorsque l’aile est étendue (D) ou repliée (E).
Un fossile exceptionnel indique que, chez certaines espèces au moins, les orteils des pattes arrières étaient également reliés entre eux par un podopatagium, donnant une palmure (ce que suggèrent aussi les pistes attribuées à des ptérosaures). Mais rien n'assure que cet état était valable pour toutes les espèces. Quelques rares fossiles particulièrement bien préservés montrent que la membrane du patagium était rigidifiée par des fibres, et ne formait pas des replis, mais se pliait le long de lignes de charnière plus souples, à la façon d'un pliage en papier ou d'un éventail. Contrairement aux oiseaux et aux chiroptères, chez qui la charnière principale de l'aile se situe au niveau du poignet, entre les carpes et les métacarpes, elle se situait chez les ptérosaures à la jonction des métacarpes et des phalanges. On voit ainsi que si les membres antérieurs des ptérosaures et des chiroptères sont bien homologues (on y retrouve les mêmes os, plus ou moins modifiés, avec l'organisation caractéristique du membre chiridien), les ailes de ces deux groupes sont des convergences (leurs organisations sont différentes et représentent deux “solutions” distinctes, élaborées indépendamment).
Comment ces animaux décollaient-ils et se déplaçaient-ils ? Là encore, les réponses pourraient être différentes selon les espèces, car fonction de la taille des individus. Des pistes fossilisées dans la boue calcaire du site de Crayssac, en France, indiquent qu'ils se déplaçaient au sol en s'appuyant sur la plante du pied à l'arrière (plantigradie) et sur l'os ptéroïde et les phalanges à l'avant (digitigradie), les ailes repliées vers le haut, à la façon des chauve-souris. Pour ce qui est du décollage, diverses solutions ont été proposées (comme d'ailleurs pour les dinosaures ailés et les premiers oiseaux) : saut depuis un arbre après y être monté (pour les petits ptérosaures), chute du rebord d'un relief (pour les grands et très grands), décollage après une phase de course, utilisation des bras comme “catapulte” pour amorcer le décollage... Sans pouvoir répondre de manière certaine, les paléontologues admettent aujourd'hui que ces animaux étaient actifs et très probablement homéothermes, donc capables de courir. Sur certains spécimens très complets, un revêtement fibreux (pycnofibres) recouvre le corps et évoque une fourrure, autrement dit une adaptation à la limitation des pertes thermiques par emprisonnement d'une couche d'air stable, comme chez les oiseaux (avec leur plumes de duvet) et les mammifères (avec les poils).
Source - © 2004 D'après Chatterjee et Templin [9]
Figure 14. Modèles d'extension de l'aile chez les ptérosaures, d'après les fossiles disponibles
L'espèce Sordes pilosus (B) est un exemple de la structure “Rhamphorhynchoïde” (C) ; Pterodactylus kochi (D) illustre la structure “Pterodactyloïde” (E).
Ces fibres sont cependant mal connues. Une étude parue en janvier 2019 vient d'en décrire des exemplaires sur le corps de deux petits ptérosaures du même genre que celui représenté par la figure 20. Selon les auteurs de ce travail, ces animaux portaient quatre types de pycnofibres différentes selon l'endroit du corps ; plus surprenant peut-être, certaines d'entre elles ont une morphologie qui rappelle la plume, avec une tige centrale portant des fibres latérales, comme les barbes d'une plume d'oiseau [31]. Or, rappelons-le, le groupe des ptérosaures apparait dans la phylogénie comme le plus proche parent des dinosaures, donc des oiseaux. Ces chercheurs posent donc la même question que celle avancée à propos de la ressemblance entre les ailes membraneuses des dinosaures chinois et des ptérosaures : la plume d'oiseau pourrait-elle être apparue bien plus tôt qu'on ne le croyait jusqu'ici, chez l'ancêtre commun aux ptérosaures et aux dinosaures, au début du Trias ? Autrement dit, l'état “archaïque” du dinosaure serait-il emplumé ? Ou bien les deux groupes ont-ils développé séparément des structures semblables, mettant peut-être à contribution un patrimoine génétique commun plus ancien ?
Par ailleurs, la diversification des ptérodactyles, et en particulier du sous-ensemble des Ptérodactyloïdes, se marque aussi par la variété des formes du crâne, de la mâchoire et de la denture : les premiers ptérosaures, de taille modeste, auraient été majoritairement insectivores (p. ex. Anurognathus, figure 20). Au contraire, la denture et la forme du bec des ptérodactyloïdes indiquent que certaines espèces étaient carnivores, ou piscivores, d'autres probablement herbivores et certaines filtreuses de petits crustacés à la façon des flamands roses[4] (figures 18 et 19).
Source - © 2017 D'après Zhou et al. [33], modifié
L'aspect général des animaux est schématisé par les deux silhouettes en gris.
Le mode de vie de nombre de ces ptérosaures reste néanmoins énigmatique ou controversé. Par exemple celui des Azhdarchidés, des Ptérodactyloïdes du Crétacé de grande taille, au cou long mais rigide, et à l'envergure proportionnellement assez modeste comparée à leur taille totale : ils ont été interprétés comme des piscivores, volant au ras de l'eau la gueule ouverte pour capturer leurs proies, mais leur anatomie serait peu adaptée à la nage ou au barbotage et d'autres chercheurs préfèrent les voir comme des animaux opportunistes carnivores et charognards vivant à l'intérieur des terres [29]. C'est aussi à ce taxon des Azhdarchidés qu'appartiennent les plus grandes espèces connues, dont la taille et l'envergure restent conjecturales. Les plus gigantesques, comme Quetzalcoatlus, auraient atteint la taille d'une girafe, avec une envergure de dix mètres ou plus. Pouvaient-ils encore voler ? Le débat, qui tourne autour de l'estimation de leur masse, compte tenu de leurs os creux, n'est pas tranché.
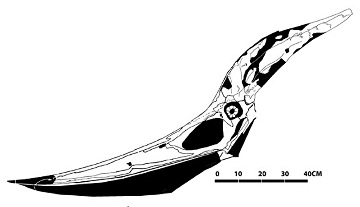
Chez plusieurs espèces de Ptérodactyloïdes, qui plus est, on observe un allongement du crâne, qui arbore souvent des extensions ou une longue crête (comme chez le fameux Pteranodon du Crétacé, figure 16). Les paléontologues discutent toujours des fonctions qu'ont pu avoir ces expansions : assuraient-elle l'équilibre de la tête ? Soutenaient-elle, elles aussi, une membrane de peau (ce qui est observé sur quelques fossiles) ? Jouaient-elles alors un rôle dans le vol, que la queue disparue n'assurait plus, à la manière d'une voile ? Dans le groupe des Nyctosauridés, par exemple (figure 14), ces expansions présentent une taille et une forme extravagantes, rappelant les bois d'un cervidé, qui semblent peu propices à la survie de l'animal. Peut-être s'agit-il du résultat d'une sélection sexuelle, comme celle qui explique la queue du paon mâle ?
Source - © 2011 reptileevolution.com Figure 16. Crâne de Ptéranodon | Source - © 2012 Julio Lacerda Figure 17. Tentative de reconstitution de Nyctosaurus gracilis L'envergure de l'animal atteignait ~2m. Certaines reconstitutions ajoute une membrane entre les crêtes, mais cette solution paraît peu fonctionnelle. |
Les figures 18 à 20 montrent trois spécimens de Ptérodactyles découverts dans les calcaires lithographiques jurassique supérieur de Solnhofen [2].
Source - © 2015 D'après Arratia et al. [2] | Source - © 2015 D'après Arratia et al. [2] |
Source - © 2015 D'après Arratia et al. [2] Figure 20. Anurognathus ammoni, petit ptérosaure (9 cm de long) semblable à une chauve-souris Malgré sa queue courte, il n'appartient pas aux Pterodactyloïdes, mais à leurs plus proches parents. | |
Malgré la fragilité de leurs squelettes, l'exceptionnelle préservation des fossiles disponibles, associée aux techniques d'études modernes, permet d'avoir une image relativement détaillé de ces animaux et de leur histoire. On comprend désormais que les ptérosaures ont constitué un groupe très particulier, qui a développé des structures anatomiques et morphologiques originales par lesquelles il a investi des niches écologiques variées. L'apparition des oiseaux, à la fin du Jurassique, a-t-elle pu constituer une nouvelle concurrence ? L'hypothèse a été avancée, le nombre d'espèces de ptérosaures connus paraissant décliner au cours du Crétacé. Mais le Jurassique supérieur correspond aussi à une diversification du groupe, avec l'apparition des Ptérodactyloïdes à queue courte et cou long. Et l'étude du registre fossile disponible déjà citée plus haut conclut que si le nombre total d'espèces retrouvées a diminué entre le Crétacé inférieur et le Crétacé supérieur, la diversité des ptérosaures est néanmoins restée supérieure à celle des oiseaux [12].
Quoi qu'il en soit, ces grands ou très grands ptérosaures semblent également avoir compté parmi les derniers : la majorité des taxons de ptérosaures disparait du registre fossile bien avant la limite Crétacé-Paléogène, à l'exception de deux groupes, les Azhdarchidés et les Nyctosauridés (figures 12 et 15). Après la limite Crétacé-Paléogène, le ciel ne contenait plus aucun ptérosaure, ni dinosaures à membranes, et même les effectifs et la diversité des oiseaux s'étaient fortement réduits. Au Tertiaire, ce sont alors les mammifères qui viennent tenir compagnie aux oiseaux, alors que certains oiseaux de l'Éocène, les Gastornithidae, cessent de voler pour devenir de grands marcheurs herbivores terrestres.
Source - © 2019 Cyril Langlois / données Paleobiodiversity Database Figure 21. Répartition mondiale des spécimens de ptérosaures enregistrés dans la Paleobiodiversity Database Les chiffres entre parenthèses indiquent le nombre d'entrées dans la base pour chaque période géologique. | Source - © 2019 Cyril Langlois / données Paleobiodiversity Database |
Les mammifères planants et volants
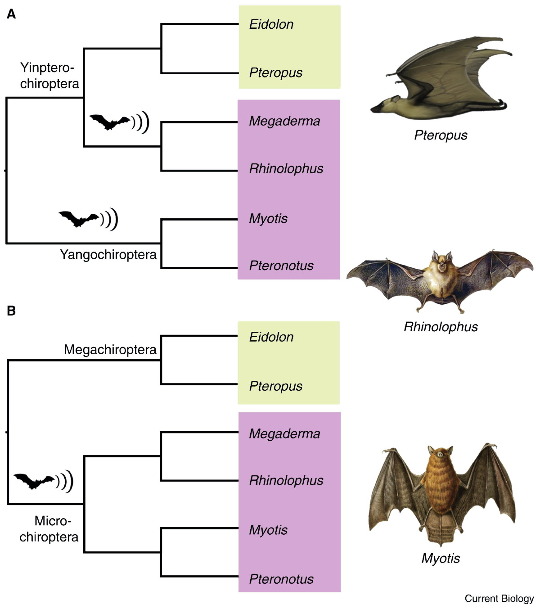
Les chauve-souris posent aujourd'hui aux paléontologues un problème similaire à celui des insectes : leurs plus anciens représentants connus ressemblent déjà énormément aux formes récentes. Il est donc difficile de reconstituer l'acquisition des différentes spécificités du groupe (ses apomorphies), pourtant nombreuses et remarquables : l'hypertrophie des doigts, le patagium, l'écholocalisation[5], l'expansion du sternum en un bréchet…, une série de spécificités qui soutiennent sans ambigüité la monophylie de ce taxon. Les phylogénies moléculaires réalisées sur les représentants actuels du groupe l'ont confirmé et ont remis en question les relations entre les différents taxons de Chiroptères : morphologiquement, les deux sous-groupes majeurs, les microchiroptères et les mégachiroptères, sont considérés tous deux comme monophylétiques et groupes-frères. Dans ce cas, l'une de leurs caractéristiques majeure, l'écholocalisation, serait donc apparue une seule fois, chez leur ancêtre commun.
Les phylogénies moléculaires sont venues remettre en question ces relations. Une étude de 2005 [25] soutenue par d'autres ensuite [26], a réaffirmé la monophylie de l'ensemble des Chiroptères, mais en a modifié les relations internes : il y aurait bien deux sous-groupes monophylétiques de chauve-souris, mais qui ne correspondent pas à la division micro-/macro-chiroptères ; les seconds restent monophylétiques, mais associés à certaines familles de microchiroptères dans le clade des Yinpterochiroptera, les autres microchiroptères constituant un second sous-ensemble monophylétique, les Yangochiroptera; le groupe des microchiroptères seraient donc paraphylétique et l'écholocalisation serait présente dans deux clades distincts : elle aurait donc été perdue par certaines familles de chauves-souris, à moins qu'elle ne soit apparue de manière convergente dans les deux groupes (figure 23).
Source - © 2013 D'après Springer [23], modifié
Figure 23. Phylogénie moléculaire (A) contre phylogénie morphologique (B) des chauves-souris
Les rectangles regroupent les animaux à écholocalisation (en violet) ou non (en vert). Sur la figure A, l'écholocalisation est représentée comme une convergence évolutive plutôt que comme une perte chez les mégachiroptères.
Par les méthodes d'horloges moléculaires, contraintes par quelques fossiles bien datés, cette même étude proposait des dates de divergences de ces taxons, mais en posant comme hypothèse que l'ancêtre commun à l'ensemble du groupe remonterait à 64 Ma [25]. Elle suggérait aussi que les principaux ensembles de microchiroptères, capables d'écholocalisation, seraient apparus entre 52 et 50 Ma. Ces dates correspondent au début de l'Éocène, une période de climat chaud où l'on observe un pic de paléo-biodiversité des insectes. Ainsi, la diversification des chiroptères pourrait être liée à celle de leurs proies, les insectes, et à l'occupation consécutive d'un plus grande nombre de niches écologiques. Ce serait aussi pour esquiver la concurrence des oiseaux que les chiroptères auraient adopté un mode de vie nocturne. Cette diversification se traduit aujourd'hui par la distinction de 21 familles de Chiroptères, comprenant plus de 1260 espèces.
Enfin, en prenant en compte les spécimens fossiles, Teeling et coll. [25] concluent que le groupe des Chiroptères serait apparu dans les terres de l'hémisphère Nord de la Laurasia plutôt que dans les masses continentales issues du Gondwana.
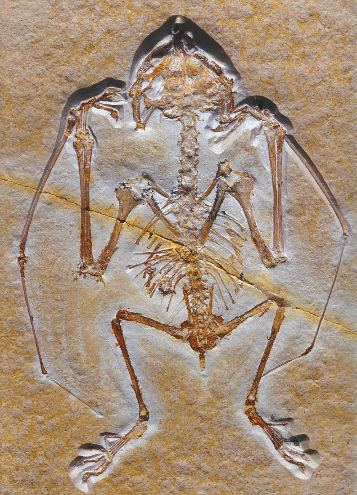
Qu'en est-il, justement, du côté des fossiles ? En 2008, un article paru dans la revue Nature décrivait un nouveau chiroptère fossile exhumé dans la formation fossilifère de Green River, dans l'état du Wyoming, aux États-Unis. Daté du début de l'Éocène (52,5 Ma), ce spécimen, attribué à un nouveau genre, Onychonycteris (la “chauve-souris à griffes”), serait l'un des chiroptères les plus archaïques trouvés à ce jour [21]. Il vient concurrencer à ce titre une autre espèce trouvée dans la même région (mais aussi en Europe, et notamment en France) et nommée une quarantaine d'années plus tôt, Icaronycteris (la “chauve-souris Icare”, la première envolée… les paléontologues sont parfois poètes !). Le nom Onychonycteris vient de ce qu'elle présente des griffes à tous les doigts de la main, un caractère considéré comme archaïque car les chauve-souris plus récentes n'en ont plus qu'à deux ou trois doigts.
Ces deux animaux avaient manifestement des ailes, mais encore une queue assez longue, contrairement aux espèces plus récentes (figure 24). L'intérêt principal d'Onychonicteris, hormis son âge, était l'éclairage qu'il semblait apporter sur une question simple : laquelle des deux capacités les plus typiques des chiroptères, le vol et l'écholocalisation (en la supposant perdue ensuite), est apparue la première ? Dans son commentaire de la publication d'Onychonycteris, le biologiste John Speakman [22] synthétisait les arguments de ce débat : certains auteurs considèrent l'écholocalisation comme un préalable au vol ; elle se rencontre aussi chez des petits mammifères insectivores non-volants (sans être aussi sophistiquée que chez les chauve-souris), et l'on peut imaginer des chiroptères archaïques repérant les insectes par ce moyen avant d'utiliser leurs doigts allongés, éventuellement déjà palmés, pour les capturer. Selon Speakman, un argument en faveur de l'hypothèse opposée – l'adaptation au vol avant l'apparition de l'écholocalisation – est d'ordre énergétique : l'émission d'ultrasons par les chauve-souris au repos, maintenues au sol ou immobiles, leur demande beaucoup d'énergie. Au contraire, elle serait beaucoup moins coûteuse pour les chauve-souris en mouvement, en raison d'une association entre les muscles mobilisés dans le battement des ailes, la ventilation pulmonaire et la production des ultrasons par leur système vocal : les muscles participant à l'écholocalisation étant déjà mobilisés par le vol, le surcout énergétique de l'écholocalisation serait beaucoup plus faible chez l'animal en vol. Les deux spécimens d'Onychonycteris disponibles plaideraient en faveur de cette hypothèse, car leur morphologie suggère bien qu'ils pouvaient voler, mais ils n'auraient pas été capables d'écholocalisation : chez tous les chiroptères qui en disposent, la cochlée, dans l'oreille interne, est hypertrophiée ; or ce n'était pas le cas chez Onychonycteris. Mais des travaux ultérieurs, fondés sur des arguments anatomiques différents, ont néanmoins remis en doute l'absence d'écholocalisation chez cette espèce.
Source - © 2014 D'après Benton [4], modifié
Autre énigme posée par les chiroptères, l'acquisition de leurs bras et leurs doigts hypertrophiés. Là encore, les paléontologues ne disposent pas pour les chiroptères d'un registre fossile aussi conséquent que celui des oiseaux, qui permet de documenter partiellement la transformation du membre antérieur allongé de petits dinosaures coureurs en une aile aux os fusionnés. Ils peuvent seulement proposer que ces transformations ont eu lieu au cours des dix à douze millions d'années qui séparent l'ancêtre commun des chiroptères (supposé vers 64 Ma) aux plus anciens fossiles du Wyoming (vers 52 Ma). Par contre, la génétique du développement apporte quelques informations : ainsi, une étude de 2008 [10] a identifié une séquence génétique (Prx1) codant pour un facteur de transcription impliqué, chez la souris, dans la croissance des os longs au cours du développement du membre. Elle a montré ensuite que la séquence homologue de ce gène chez une espèce de chauve-souris est surexprimée dans le membre du chiroptère ; cette surexpression est elle-même liée à une séquence génétique régulatrice située en amont de Prx1 [10]. Introduit dans le génome d'une souris à la place de son homologue murin, la séquence de chiroptère induit le surdéveloppement du membre. Ainsi, la transformation du membre antérieur des chiroptères par rapport à leurs proches parents parmi les mammifères aurait pu s'effectuer assez rapidement par un changement d'expression de quelques séquences génétiques-clés [14]. Mais seuls de nouveaux fossiles pourront montrer précisément par quelles morphologies et quels modes de vie a pu s'effectuer le passage de petits mammifères, probablement arboricoles, aux chauves-souris.
Source - © 2019 Cyril Langlois / données Paleobiodiversity Database | Source - © 2019 Cyril Langlois / données Paleobiodiversity Database Les chiffres entre parenthèses indiquent le nombre d'entrées dans la base pour chaque période géologique. |
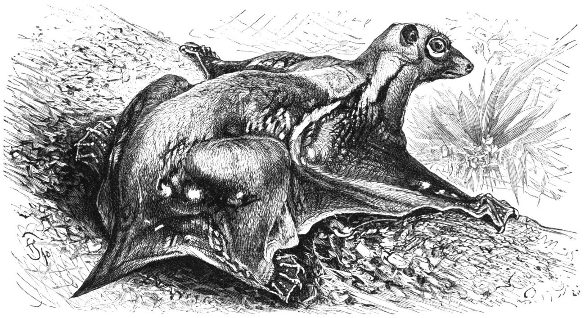
Qu'en est-il enfin des dermoptères, sans parler des autres mammifères planeurs ? Les connaissances sur ces groupes sont encore plus parcellaires, d'autant plus qu'à l'inverse des précédents, l'acquisition du vol plané ne semble pas avoir induit chez ceux-là une radiation évolutive qui les aurait rendu plus fréquents dans le registre fossile. Les actuels dermoptères (ou galéopithèques, ou lémurs volants en français, flying lemurs en anglais) ne sont représentés que par un genre, Cynocephalus (“à tête de chien”) et ne vivent que dans les forêts d'Asie du Sud-Est (figure 27). Ce sont des animaux herbivores et frugivores nocturnes qui utilisent le vol plané pour passer d'arbre en arbre [16]. Leur registre fossile se limite à des dents et des mâchoires fossiles, retrouvées surtout dans les terrains d'âge éocène du Pakistan, du Myanmar et de Thailande [4], notamment par des chercheurs français de l'université de Montpellier [17]. Des fossiles du Paléocène d'Amérique du Nord et de France pourraient aussi s'y rattacher [16]. Les dents des dermoptères actuels sont très reconnaissables, ce qui peut faciliter l'identification de leurs fossiles, mais ces éléments parcellaires ne disent pas si ces animaux disposaient d'un patagium et usaient déjà du vol plané. Les données moléculaires, de leur côté, suggèrent que les actuels dermoptères partagent un ancêtre commun très récent.
Source - © 1927 Friedrich Specht
Conclusion
Le déplacement dans les airs, en dépit des difficultés apparentes qu'il semble poser, a pourtant été expérimenté plusieurs fois au cours de l'évolution des organismes vivants. Cet article n'a abordé que le cas des vertébrés, en laissant de côté les insectes (même si ceux-ci, en tant que source de nourriture, ont été l'un des principaux “intérêts” qu'ont eut ces animaux à gagner le milieu aérien). On peut noter d'ailleurs que si les Arthropodes n'ont colonisé les airs qu'à une seule occasion, avec les insectes (groupe monophylétique) à l'Ordovicien (il y a 400 Ma), ce sont plusieurs groupes de vertébrés distincts, à des moments différents (Trias, Jurassique, Paléocène ou Éocène ancien), qui les y ont suivis. Peut-être l'extraordinaire diversification des insectes, premiers arrivés dans ces niches écologiques nouvelles, a-t-elle empêché d'autres arthropodes de les concurrencer ensuite ? Tandis que les vertébrés, pour la plupart initialement prédateurs des insectes ou d'autres animaux, donc forcément moins nombreux (puisque de plus haut niveau trophique), ont pu se partager les ressources (entre ptérosaures et oiseaux, puis oiseaux et chiroptères) en différenciant leurs modes de vie (chauve-souris nocturnes et oiseaux principalement diurnes, par exemple). Le plan d'organisation des vertébrés, avec leur squelette interne et leur respiration pulmonée, a peut-être aussi été plus “malléable” que celui des arthropodes et donc des insectes.
Quoi qu'il en soit, et exactement comme chez les vertébrés aquatiques, les fortes contraintes physiques que posent la locomotion aérienne ont nécessité des solutions convergentes, aboutissant à des morphologies semblables au premier abord. Mais les histoires évolutives distinctes de ces groupes leur ont procuré aussi des originalités propres et des solutions particulières aux problèmes déjà surmontés par leurs prédécesseurs (en mettant peut-être à profit des voies de développement partagées avec d'autres animaux volants à travers un lointain ancêtre commun). C'est cette capacité de bricolage évolutif, gage de survie et de “succès”, que l'actuelle diminution rapide de la biodiversité sauvage, l'expansion des monocultures et l'exploitation de variétés hyper-sélectionnées, génétiquement appauvries, vient restreindre aujourd'hui.
Références
B. Andres, J. Clark, X. Xu, 2014. The earliest pterodactyloid and the origin of the clade, Current Biology, 24, 9, 1011–1016
G. Arratia, H.-P. Schultze, H. Tischlinger, G. Viohl, 2015. Solnhofen – Ein Fenster auf die Jurazeit Vol. 2e Munich, Verlag Dr. Friedrich Pfeil, 296p. ISBN : 978-3-89937-085-0
S.C. Bennett, 2015. New interpretation of the wings of the pterosaur Rhamphorhynchus muensteri based on the Zittel and Marsh specimens, Journal of Paleontology, 89, 5, 845‑869
M.J. Benton, 2014. Vertebrate Palaeontology, 4th ed., Wiley-Blackwell, 480p. ISBN : 978-1-118-40764-6
S.L. Brusatte, 2017. Comment les plumes sont venues aux dinosaures, Pour la Science, 475, 54‑62
S.L. Brusatte, 2017. A Mesozoic aviary, Science, 355, 6327, 792‑794
S.L. Brusatte, J.K. O'Connor, E.D. Jarvis, 2015. The Origin and Diversification of Birds, Current Biology, 25, 19, R888‑R898
E. Buffetaut, J.-M. Mazin, 2003, Evolution and palaeobiology of pterosaurs, Geological Society, London, Special Publications, 217, n°1, 1‑3
S. Chatterjee, R.J. Templin, 2004, Posture, Locomotion, and Paleoecology of Pterosaurs, Geological Society of America Special Paper 376, 1-64 [pdf]
K.L. Cooper, C. J. Tabin, 2008. Understanding of bat wing evolution takes flight, Genes Dev., 22, 2, 121‑124
S.A. Czerkas, C. Yuan, 2002. An arboreal Maniraptoran from Northeast China, Feathered Dinosaurs and the Origin of Flight, The Dinosaur Museum Journal, 1, 63-95 [pdf version abrégée]
G.J. Dyke, A.J. Mcgowan, R.L. Nudds, D. Smith, 2009. The shape of pterosaur evolution: evidence from the fossil record, Journal of Evolutionary Biology, 22, 4, 890‑898
P. Godefroit, A. Cau, H. Dong-Yu, F. Escuillié, W. Wenhao, G. Dyke, 2013. A Jurassic avialan dinosaur from China resolves the early phylogenetic history of birds, Nature, 498, 7454, 359‑362
R.L. Honeycutt, 2008. Small changes, big results: evolution of morphological discontinuity in mammals Journal of Biology, 7, 9
D. Ksepka, M. Habib, 2017. Pelagornis, les géants du ciel, Pour la Science, 471, 55‑61
G. Lecointre, H. Le Guyader, 2017. Classification phylogénétique du vivant – Tome 2 – 4e édition, Paris, Belin, 832p - ISBN : 978-2-410-00385-7
L. Marivaux, L. Bocat, Y. Chaimanee, J.-J. Jaeger, B. Marandat, P. Srisuk, P. Tafforeau, C. Yamee, J.-L. Welcomme, 2006. Cynocephalid dermopterans from the Palaeogene of South Asia (Thailand, Myanmar and Pakistan): systematic, evolutionary and palaeobiogeographic implications, Zoologica Scripta, 35, 4, 395‑420
D.M. Martill, D.M. Unwin, 1989. Exceptionally well preserved pterosaur wing membrane from the Cretaceous of Brazil, Nature, 340, 6229, 138-140
R. Prum, A. Brush, 2003. Les plumes de dinosaures, Pour la Science, 305, 24‑32
P. Senter, D.M. Klein, 2014. Investigation of claims of late-surviving pterosaurs: the cases of the winged dragons of Belon, Aldrovandi, and Cardinal Barberini, Palaeontol. Electron., 17, 3, 1‑19 [pdf]
N.B. Simmons, K.L. Seymour, J. Habersetzer, G.F. Gunnell, 2008. Primitive Early Eocene bat from Wyoming and the evolution of flight and echolocation, Nature, 451, 7180, 818‑821
J. Speakman, 2008. Evolutionary biology: A first for bats, Nature, 451, 7180, 774‑775
M.S. Springer, 2013. Phylogenetics: Bats United, Microbats Divided, Current Biology, 23, 22, R999‑R1001
P. Taquet, K. Padian, 2004. The earliest known restoration of a pterosaur and the philosophical origins of Cuvier's Ossemens Fossiles, Comptes Rendus Palevol, 3, 2, 157‑175
E.C. Teeling, M.S. Springer, O. Madsen, P. Bates, S.J. O'Brien, W.J. Murphy, 2005. A Molecular Phylogeny for Bats Illuminates Biogeography and the Fossil Record, Science, 307, 5709, 580‑584
G. Tsagkogeorga, J. Parker, E. Stupka, J.A. Cotton, S.J. Rossiter, 2013. Phylogenomic Analyses Elucidate the Evolutionary Relationships of Bats, Current Biology, 23, 22, 2262‑2267
A.H. Turner, P.J. Makovicky, M.A. Norell, 2007. Feather Quill Knobs in the Dinosaur Velociraptor, Science, 317, 5845, 1721
M. Wang, J.K. O'Connor, X. Xu, Z. Zhou, 2019. A new Jurassic scansoriopterygid and the loss of membranous wings in theropod dinosaurs, Nature, 569, 7755, 256
M.P. Witton, D. Naish, 2008. A Reappraisal of Azhdarchid Pterosaur Functional Morphology and Paleoecology, PLOS ONE, 3, 5, e2271
X. Xu, X. Zheng, C. Sullivan, X. Wang, L. Xing, Y. Wang, X. Zhang, J.K. O'Connor, F. Zhang, Y. Pan, 2015. A bizarre Jurassic maniraptoran theropod with preserved evidence of membranous wings, Nature, 521, 7550, 70‑73
Z. Yang, B. Jiang, M.E. McNamara, S.L. Kearns, M. Pittman, T.G. Kaye, P.J. Orr, X. Xu, M.J. Benton, 2019. Pterosaur integumentary structures with complex feather-like branching ». Nature Ecology & Evolution, 3, 1, 24-30
F. Zhang, Z. Zhou, X. Xu, X. Wang, C. Sullivan, 2008. A bizarre Jurassic maniraptoran from China with elongate ribbon-like feathers, Nature, 455, 7216, 1105‑1108
C.-F. Zhou, K.-Q. Gao, H. Yi, J. Xue, Q. Li, R.C. Fox, 2017. Earliest filter-feeding pterosaur from the Jurassic of China and ecological evolution of Pterodactyloidea, Royal Society Open Science, 4, 2, 160672
[1] Pour souligner cette monophylie, qui en font des groupes “naturels” au sens de l'évolution darwinienne, il devient fréquent de les écrire avec une majuscule, afin de les différencier des groupes constitués d'après la ressemblance superficielle de leurs membres mais souvent non-monophylétiques (p. ex. les reptiles, les poissons, les lézards).
[2] Faute de pouvoir rapprocher cet os d'un élément connu du squelette des vertébrés en général ou des dinosaures en particulier, les découvreurs de Yi qi et d'Ambopteryx le désignent simplement par « os styliforme ».
[3] Poursuivant un peu plus loin cette idée d'immenses animaux volants, l'écrivain de science-fiction Stephen Baxter imagine, dans Evolution, une forme de ptérosaure démesurée et ultra-légère, totalement inféodée au milieu aérien, planant à la hauteur d'un avion long courrier sans jamais redescendre vers le sol. Mais un tel animal aurait eu bien peu de chance de laisser la moindre trace fossile...
[4] C'est l'un de ces ptérosaures filtreurs qui fournit son titre (Le ptérodactyle rose) et sa couverture à la traduction française du livre du paléontologue américain Robert T. Bakker, The Dinosaur Heresies, publié en 1986. Ce chercheur iconoclaste y proposait une révision complète de la vision des dinosaures (et de leurs cousins ptérosaures), qu'il présentait comme des animaux homéothermes et actifs sur la base d'arguments écologiques et paléontologiques, bien avant que l'homéothermie de ces animaux ne soient argumentée par des études de géochimie isotopique et qu'on les affuble de plumes.
[5] Les deux termes “écholocalisation” et “écholocation” sont acceptés ; l'Encyclopædia Universalis, par exemple, utilise “écholocation”. Rappelons que cette capacité à se localiser, ou à localiser ses proies, en émettant des sons, existe chez les chiroptères mais aussi chez les cétacés et quelques autres mammifères. Sur le cas des cétacés, et plus précisément du cachalot, voir l'article de H. Le Guyader, Le bizarre sonar du cachalot, dans Pour la Science, 485, mars 2018.