Article | 19/09/2000
Cycle du carbone - Comment les continents neutralisent l'acidité atmosphérique
19/09/2000
Résumé
TD 1/3 - Étude de l'altération globale, à travers l'étude des eaux de rivières.
Table des matières
Introduction
Nous allons essayer de mettre en évidence dans ce qui suit le rôle important des réactions chimiques qui se produisent lorsque l'eau de pluie ou des sols réagit avec les roches. Du point de vue du chimiste, c'est une véritable réaction acide-base qui se produit. Géologiquement, ces réactions d'altération sont essentielles pour l'homéostasie terrestre. Nous étudierons l'altération de façon globale, à travers l'étude des rivières. Les rivières intègrent en effet l'ensemble des réactions d'altération qui se produisent sur leur bassin versant.
Nous prenons le cas simple de rivières drainant des basaltes à l'Île de la Réunion, avant de généraliser aux grandes rivières du monde.
L'Île de la Réunion
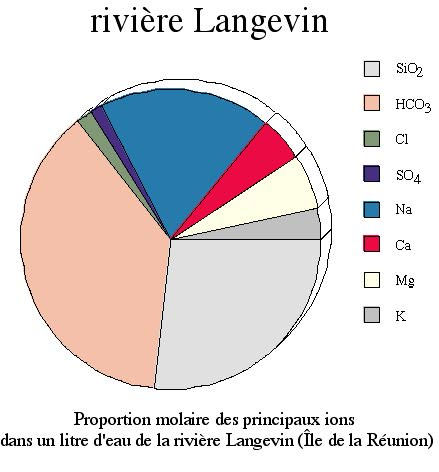
1- Composition moyenne d'une rivière de la Réunion : tableau 1 (pdf ou ods). Commentez ce tableau, représentez sous forme d'un camembert la proportion des différentes espèces chimiques dissoutes dans un litre d'eau de rivière. Quel est l'ion le plus abondant ? Réponse.
Tableau 1. Composition chimique d'une rivière de l'Île de la Réunion
rivière | pH | T°C | SiO2 (μM) | HCO3-(μM) | Cl- (μM) | SO42- (μM) | Na+ (μM) | Ca2+ (μM) | Mg2+ (μM) | K+ (μM) | Surface (km2) | Écoulement Spécifique (mm/an) |
rivière Langevin | 8 | 17,5 | 614 | 861 | 40 | 28 | 425 | 108 | 136 | 78 | 33 | 2 470 |
2- Une manipulation simple : déterminer l'alcalinité d'une eau. On suivra le pH lors de l'acidification avec de l'acide chlorhydrique d'une eau de rivière filtrée (Figures 1 et 2).
Figure 1. Agrandir l'image | Figure 2. Agrandir l'image |
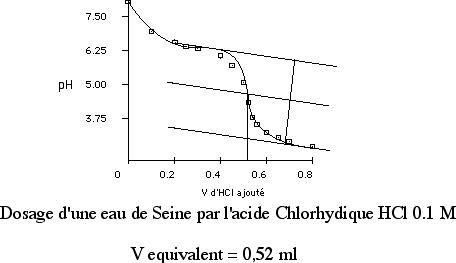
La courbe observée est typique de celle d'une titration acide-base classique avec un palier correspondant à la zone tampon. Plus une rivière est alcaline, plus elle est tamponnée. Réponse.
3- Calculez la quantité de l'ion HCO3- attendue dans une eaux de rivière en équilibre avec l'atmosphère. Plus simplement, dosez l'alcalinité d'une eau distillée du laboratoire qui s'est équilibrée avec l'atmosphère. Conclusion ? Réponse.
4- Écrivez la réaction d'altération d'un des minéraux les plus abondants du basalte, l'anorthite, de formule CaAl2Si2O8, donnant de la kaolinite, de formule Al2Si2O5(OH)4. Réponse.
5- Dans le cas de la rivière de l'île de la Réunion, calculer le flux annuel de consommation de CO2 par altération des roches. Comparer ce flux avec la production primaire sur l'île.Réponse.
6- Calculer la vitesse à laquelle ( en mol ou g/km2/an) le dioxyde de carbone atmosphérique est consommé sur le bassin versant de cette rivière. Réponse.
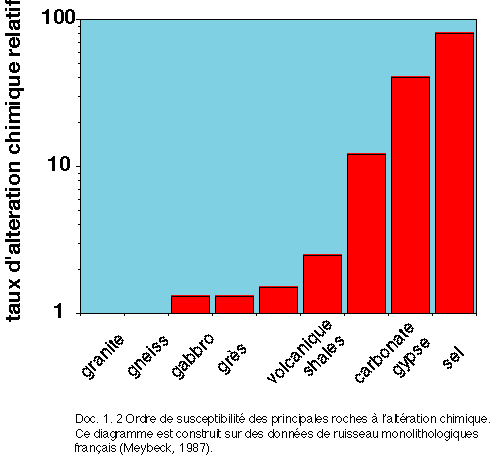
7- Sur la Figure 4, on compare (on a normalisé au granite), les vitesses d'altération chimique pour les divers types de roches. Réponse.
Figure 4. Agrandir l'image
Comment a t-on construit ce graphe ? Quels sont les types de roches les plus efficaces en terme de pompage de CO2 atmosphérique ?
Les grandes rivières mondiales
On donne le tableau 2 (pdf ou ods) résumant la composition chimique des plus grandes rivières mondiales ainsi que la surface de leur bassin, leur débit.
Figure 6. MacKenzie en amont. | Figure 7. MacKenzie à l'embouchure. |
Figure 8. Le Congo à son embouchure. | |
Figure 11. Le Huang He charrie le loess. | |
Figure 12. Le Daduhe | Figure 13. Le Brahmapoutre au Tibet. |
Les observations faites sur la rivière de la Réunion se généralisent-elles aux grands fleuves ? réponse
- Calculer la composition chimique de la « rivière mondiale », au moins pour l'ion HCO3- , sachant que le débit total aux océans est de 37 400 km3/an et la surface drainée de 100 millions de km2. Estimer le flux total de HCO3- apporté par les rivières aux océans. réponse
- Calculer la contribution (en % ) du flux d'alcalinité à l'Océan de chaque grand fleuve. réponse
- Calculer pour chaque fleuve la vitesse de consommation de CO2. Quelles sont les régions du monde les plus « efficaces » pour la consommation de CO2 ? Émettez des hypothèses sur les causes de cette géographie. réponse
- Le Tableau de la composition chimique des fleuves donne également la quantité de carbone dissous dans un litre d'eau pour chaque grand fleuve ainsi que la quantité de carbone particulaire exporté dans les sédiments. Quelle est l'origine de ce carbone ? Comparer les flux d'exportation de carbone organique et de carbone inorganique. réponse
Correction de la première partie : l'Île de la Réunion.
Composition chimique d'une eau
Le tableau 1 nous montre que seulement 8 espèces chimiques, ioniques (Na+, K+…) ou moléculaire (H4SiO4) participent significativement à la composition chimique de la rivière Langevin, sur l'Île de la Réunion. En imposant que la somme des de ces espèces fasse 360°, on peut calculer le secteur angulaire de chaque composant et représenter un camembert (figure 14) Visuellement, il est clair sur ce graphe que l'ion le plus abondant est l'ion hydrogénocarbonate (HCO3- ). Ceci est d'autant plus remarquable, que l'espèce chimique carbone n'est pas un élément chimique abondant dans les roches (essentiellement des basaltes d'île océanique). Cette observation simple pose donc le problème de l'origine du carbone dans les eaux de rivières.
Figure 14. Agrandir l'image
NB : On peut mettre en évidence que l'ion HCO3- est l'ion le plus abondant dans la plupart des rivières du monde. Toutefois, pour des raisons pédagogiques, il est important de tenir le raisonnement précédent sur une rivière ne drainant que des roches silicatées (granites, gneiss, schistes, basaltes) et pas de calcaire, dans lesquels le carbone est un composant majeur. retour
Une manipulation simple : déterminer l'alcalinité d'une eau.
On utilise de l'acide HCl dont on a préparé soigneusement le titre (Ca, entre 0,01 et 0,1 M). La manipulation (Figure 1) consiste à ajouter lentement l'acide dans un volume de rivière soigneusement mesuré (VO) et à noter, pour chaque volume ajouté, l'évolution du pH de la solution. Le pH de la solution initiale est compris entre 7 et 8 pour une eau suffisamment tamponnée. Le pH décroît lentement au début, ce qui signifie que la rivière tolère l'ajout d'acide sans que son pH ne varie fortement. Lorsqu'on approche du point d'équivalence, la diminution du pH s'accélère. Dans la première partie (plate) de la courbe, la réaction chimique qui consomme les protons H+ qu'on ajoute est la réaction totale suivante :
HCO3-+ H+ = H2CO3
Cette réaction a lieu jusqu'à ce que la totalité des HCO3- ait été consommée. Au point d'équivalence de la courbe (qui permet de déterminer VE), montrée sur la figure 3, on a la relation fondamentale
[HCO3-] x VO = VE x CA
Ainsi, si on connaît VO, CA et VE, on en déduit la « réserve alcaline » d'une eau (le pouvoir tampon), qui dans la plupart des cas (cas de toutes les eaux de rivières françaises se réduit aux seuls ions HCO3-. On détermine une concentration en mol/l, ou plus classiquement en micromol/l (µmol/l).
NB: il est nécessaire de travailler sur de l'eau filtrée et, bien entendu, d'étalonner le pH mètre auparavant. Typiquement, dans le cas de la Seine, qui représente assez bien les rivières en contexte sédimentaire, pour 200 ml de rivière, avec de l'acide à 0,1 M, le point d'équivalence se produit vers 5 ml d'acide ajouté, ce qui donne des teneurs en HCO3- de 2 500 µmol/l. Pour des rivières moins « alcalines », telles que les rivières granitiques ou basaltiques tempérées, il est nécessaire d'utiliser un acide moins concentré, sans quoi le pH vire immédiatement après ajout d'acide. retour
Équilibre d'une eau avec l'atmosphère
Bien entendu, ce calcul n'est pas du niveau de seconde, mais un élève de terminale doit pouvoir le faire. Nous détaillons le calcul et donnons ensuite une alternative « expérimentale ».
Calcul théorique :
Le dioxyde de carbone est un gaz qui a la caractéristique d'être très soluble dans l'eau. Sa dissolution dans l'eau obéit aux réactions suivantes :
CO2 + H2O = H2CO3 (la combinaison du gaz carbonique et de l'eau donne l'acide carbonique), et H2CO3 = H+ + HCO3- (l'acide carbonique libère immédiatement des protons dans l'eau et donne naissance en une base faible, l'ion bicarbonate ou hydrogénocarbonate)
Ces réactions chimiques sont caractérisées par des constantes de réaction qui dépendent de la température. A 25 °C, la constante de la dissolution du CO2 dans l'eau est appelée constante de Henry et vaut 10-1,5 (mol/l/atm) la constante de la deuxième réaction est 10-6,4.
On peut donc écrire :
10-1,5 = [H2CO3] /pCO2 ou les crochets désignent des concentrations (nous sommes en milieu dilué) et pCO2, la pression partielle de CO2 dans l'atmosphère (de 370.10-6 ppmV dans l'atmosphère moderne) et,
10-6,4 = [HCO3-].[H+] / [H2CO3],
soit 10-6,4 = ([HCO3-].[H+]) / (pCO2.10-1,5) (équation 1)
De plus, la neutralité électrique de l'eau pure dans laquelle le CO2 s'équilibre nous impose que:
[HCO3-] + [OH-] = [H+]
Nous négligerons la concentration en ions OH-, car nous savons que le pH (avant équilibre, de 7) va baisser sous l'effet de la dissolution du dioxyde de carbone, porteur d'acidité.
On a donc simplement que [HCO3-] = [H+] (équation 2)
Les équations (1) et (2) se combinent et permettent de déterminer la quantité de HCO3- formés dans la solution en équilibre avec le dioxyde atmosphérique.
On trouve que [HCO3-] = 10-3,95(pCO2)1/2 = environ 2 µmol/l
Remarque : on peut objecter à ce calcul que la pression de CO2 dans les sols (où se font les interactions eaux-roches) n'est pas celle de l'atmosphère, mais peut atteindre, dans les sols les plus actifs biologiquement, 100 fois la pression partielle de CO2 dans l'atmosphère. Dans ce cas, le calcul précédent donne environ 20 µmol/l de HCO3- attendus. Ce chiffre reste bien en deçà des valeurs observées dans les rivières.
Empiriquement, on peut faire le dosage de l'alcalinité décrit plus haut sur une solution d'eau distillée qu'on a laissé s'équilibrer (une journée) avec le CO2 atmosphérique (éviter l'ambiance des salles de classe, riches en CO2). On s'aperçoit qu'il est quasiment impossible de déterminer le point d'équivalence car le pH de la solution chute dès le premier ajout d'acide. Ceci confirme ce que le calcul théorique démontre : il n'est pas possible d'expliquer les concentrations de HCO3- mesurées dans les eaux de l'île de la Réunion par un simple équilibrage du dioxyde de carbone atmosphérique dans les eaux de surface. Il faut donc invoquer un mécanisme différent. Ce mécanisme, c'est l'altération des roches. retour
Réactions
Dans les basaltes, le plagioclase calcique (dont le pôle calcique est l'anorthite) sont avec l'olivine (dont le pôle magnésien est la forstérite) les deux seuls minéraux visibles à l'œil nu. Il est assez simple d'écrire et s'équilibrer les réactions chimiques d'altération de ces deux minéraux, pour peu qu'on se fixe l'état final. Dans le cas de l'anorthite, on considère ici que le minéral qui se forme est la kaolinite, qui est le phyllosilicate qui se forme classiquement en régime tropical humide (Figure 15). On distingue les réactions d'altérations congruentes lorsque la roche se dissous sans donner naissance à un résidu, des réactions incongruentes, lorsqu'un nouveau minéral (dit secondaire) apparaît. Sur Terre, la majorité des minéraux s'altèrent de façon incongruente. Ce qui est important pour ce qui nous concerne est de bien comprendre que des protons sont nécessaires pour casser les liaisons chimiques du minéral qui s'altère. L'eau, seule, n'altère pas. Ces protons proviennent de la dissolution du CO2 dans l'eau des sols. Ce CO2 n'est pas forcément directement d'origine atmosphérique, il peut provenir de la décomposition des êtres vivants dans le sol. Dans ce cas, il provient de toute façon de l'atmosphère. C'est la raison pour laquelle on dit que l'altération des roches neutralise l'acidité atmosphérique. Le carbone se retrouve ensuite dans les eaux du sol, puis des rivières sous la forme d'HCO3-. Cet anion est le principal compensateur des charges des cations Na+, Ca2+… provenant de l'altération des roches.
Figure 15. Réactions d'altération chimique
Remarque : lorsqu'on altère de la calcite (exemple d'une rivière qui ne drainerait que des calcaires, comme des résurgences karstiques), pour deux HCO3- mesurés dans la rivière, l'équation chimique montre qu'une seule mole de CO2 est d'origine atmosphérique, l'autre provient de la roche. Dans le cas de l'anorthite, l'ensemble du carbone est d'origine atmosphérique. retour
Flux de consommation de CO2
Ainsi, on a trouvé par quel mécanisme les rivières coulant sur des terrains ne contenant pas de carbone s'enrichissent en ion hydrogénocarbonate. On peut, toujours grâce aux rivières, calculer la vitesse à laquelle la consommation de dioxyde de carbone de l'air se fait.
On donne dans le tableau, la surface du bassin versant ainsi que le runoff, ou écoulement spécifique. L'écoulement spécifique, c'est le rapport du débit du fleuve sur la surface qu'il draine). Ici, il nous permet de calculer le débit, sachant que 2 470 mm/an signifient 2 470 mm3/mm2/an, soit encore 2 470.106 l/km2/an. Le débit est de 81 510.106 l/an.
Connaissant la concentration en ion hydrogénocarbonate en µmol/l, on peut en multipliant par le débit de la rivière, calculer un flux (par ex. en mol/an).
Pour la rivière Langevin, nous trouvons que ce sont 71.106 molCO2/an qui sont fixées.
NB : Le débit d'une rivière est une grandeur relativement facile à mesurer avec des élèves de lycée. Il suffit de mesurer la vitesse du courant à un endroit où le lit de la rivière est canalisé ou bien régulier, auquel cas, on peut déterminer simplement sa section. Le débit est le produit de la section par la vitesse du courant. Il existe des courantomètres capables de mesurer le débit, sinon, le bouchon qu'on chronomètre sur une distance donnée apporte un ordre de grandeur tout à fait suffisant. retour
Vitesse d'altération
En divisant le flux par la surface du bassin versant, on accède à un flux spécifique (en mol/km2/an), qui représente la quantité de CO2 fixé annuellement, par unité de surface dans le bassin fluvial. Cette grandeur ne dépend plus de la taille de la rivière et permet donc de comparer différents cours d'eaux entre eux. Pour la rivière Langevin, on trouve un flux spécifique de 2.106 mol CO2/km2/an, soit encore 24 tC/km2/an. A titre de comparaison, la productivité moyenne primaire d'un écosystème de forêt ombrophile tropicale est de 1000 t/km2/an. retour
Influence de la lithologie
Meybeck (Université de Paris 6), a prouvé que sous nos climats (ce diagramme a été construit grâce à des ruisseaux français non pollués), les roches s'altèrent à des vitesses différentes. Pour ce faire, il a sommé l'ensemble des ions dissous ainsi que la silice dissoute et calculé des vitesses d'altération par unité de surface et de temps. C'est le même calcul que celui que nous avons fait précédemment, mais tous les ions ont été pris en compte et non pas seulement l'ion HCO3-.
Il est important de remarquer que si les granites sont pris comme référence, les calcaires s'altèrent 10 fois plus vite. La dissolution des roches évaporitiques ne consomme pas de CO2 atmosphérique, il ne s'agit que d'une simple mise en solution dans l'eau.
L'influence de la lithologie sur la vitesse d'altération des roches et donc, la consommation de CO2 qu'elle implique est de loin le facteur le plus important, en comparaison avec le climat ou le relief (correction de l'atelier 3). retour
Correction de la deuxième partie : les grandes rivières mondiales
Les observations faites sur la rivière de la Réunion se généralisent-elles aux grands fleuves ?
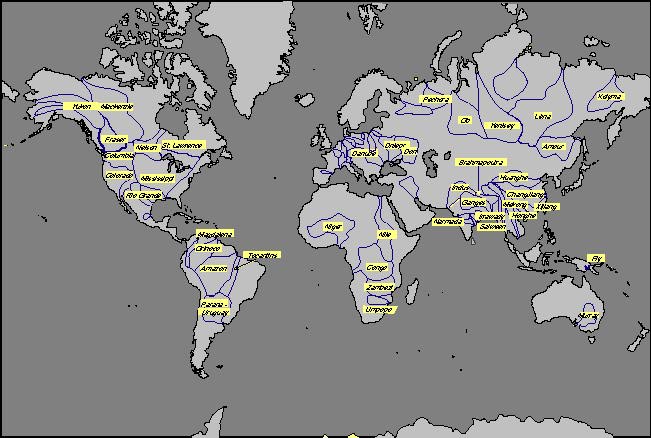
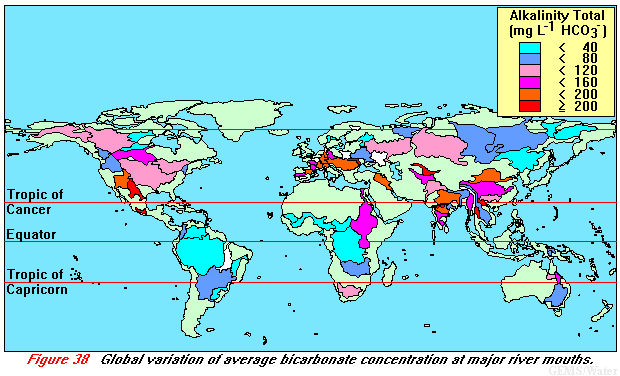
L'observation principale, que l'ion hydrogénocarbonate est l'ion le plus concentré dans l'eau de la rivière Langevin, se généralise au niveau global. Dans les 30 plus grands fleuves du monde, l'ion le plus abondant est d'origine atmosphérique et signe un des transferts majeurs du cycle du carbone. Les concentrations en HCO3- s'échelonnent de 200 µmol/l pour l'Orénoque et le Congo-Zaïre à 2 000-3 000 µmol/l pour le Danube et certains fleuves himalayens. La carte de l'alcalinité des grandes rivières est montrée sur la Figure 16. retour
Figure 16. Agrandir l'image
La rivière mondiale
On peut calculer, sur la base des 30 plus grands fleuves mondiaux, la composition chimique moyenne d'une rivière mondiale théorique par laquelle tous les transferts d'eau des continents aux océans s'effectueraient. Il est important de remarquer, qu'à elles seules, les 30 plus grandes rivières mondiales couvrent près de la moitié de la surface drainée aux océans ainsi que la moitié du débit d'eau aux océans. Il y a donc tout lieu de penser que leur composition chimique est représentative de l'ensemble des rivières du monde.
Nous calculons la moyenne pondérée des débits de HCO3-:
[Débit (Amazone)x HCO3-(Amazone) + Débit (Zaïre)x HCO3-(Zaïre) + …]/[ Débit (Amazone) + Débit (Zaïre) + …
On trouve ainsi que la rivière moyenne mondiale doit avoir une concentration en HCO3- de 897 µmol/l. Sachant que le débit total aux océans est de 37 400 km3/an, on en déduit qu'annuellement, ce sont environ 30.1012 molC/an qui sont apportés à l'océan. Ce flux représente le transfert de carbone des continents aux océans. retour
Part de chaque grand fleuve
On peut calculer alors quelle est la part de chaque grand fleuve dans l'apport de carbone inorganique à l'océan. Ce calcul est donné dans le tableau 3 (pdf ou ods). A elle seule, l'Amazone assure 7% du transfert mondial de carbone inorganique aux océans, suivi de près par le Changjiang (6,5%). retour
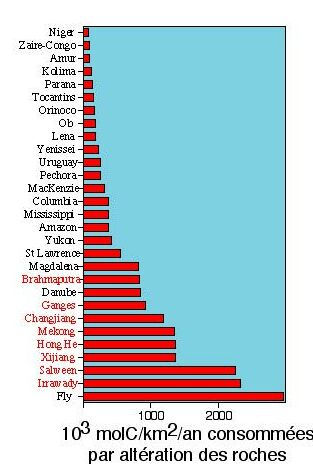
La géographie de la consommation de CO2
En divisant simplement les flux trouvés dans la question précédente par la surface du bassin versant, on aboutit à des vitesses de pompage de CO2 atmosphérique par altération chimique des roches, qui permettent de comparer les différents bassins. La figure ci-dessous montre sous forme d'histogramme que tous les grands bassins fluviaux n'ont pas le même impact sur la consommation de CO2. Certaines régions consomment peu : les grands bassins tropicaux humides (Congo, Niger), les grandes rivières sibériennes (100-200.103 molC/km2/an). D'autres régions au contraire sont très efficaces, ce sont les rivières péri-himalayennes et le Fly, une rivière de Papouasie. Ces résultats obtenus très simplement montrent donc clairement, que les taux de consommation de CO2 atmosphérique par altération des roches ne sont pas les plus élevés dans les régions chaudes et humides, comme on aurait pu s'y attendre, mais dans les zones de montagne. En effet, les chimistes savent que plus la température est forte, plus les vitesses de réactions augmentent (en particulier les vitesses d'altération chimique des roches). Nous reparlerons de ce qui contrôle la consommation de CO2 dans l'atelier 3. retour
Figure 17. Agrandir l'image
Le carbone organique
Jusque-là, il a été question de l'exportation de C inorganique des continents aux océans. Toutefois, l'analyse de certaines eaux montre qu'elles peuvent également contenir du carbone sous une forme organique. Ceci est particulièrement visible dans les eaux des régions tropicales humides. La couleur noire des eaux du fleuve Congo-Zaïre (figures 8 et 9) montre ces eaux cristallines, pauvres en matière en suspension, mais riches en matière organique complexe dissoute. Cette matière organique rentre dans la catégorie des acides humiques et fulviques. Ces acides sont produits dans les sols, souvent dans des zones marécageuses (podzols) et sont lessivés par les eaux de pluie. Les américains appellent ces rivières des « Coca Cola rivers ». Les rivières noires se rencontrent aussi dans les zones marécageuses subarctique et arctique. Ce carbone est un carbone d'origine biologique, qui échappe à la respiration dans les sols, se dégrade mal, et finit par être lessivé. C'est une « fuite » dans le sous-cycle biologique du carbone (photosynthèse/respiration). On dispose de peu de mesures systématiques. Pour avoir le carbone organique exporté par une rivière, il faut sommer la concentration de carbone organique dissous et la concentration de carbone particulaire (de la matière organique solide, plus ou moins dégradée). Pour quelques grandes rivières, le tableau 3 (pdf ou ods) montre que le rapport C inorganique sur C organique (en masse) va de 0,3 pour le Zaïre à 3-5 pour des rivières de montagne. Le flux de carbone organique qu'on peut calculer sur la base de ce tableau est du même ordre de grandeur que celui dû au carbone inorganique. Ceci est un résultat important, même si on ignore encore beaucoup de l'évolution du carbone organique d'origine fluvial une fois dans l'océan (minéralisation, consommation). retour
Vers l'Atelier 2 : Le cycle global du carbone.
Vers l'Atelier 3 : Climat, Tectonique et altération chimique des roches.