Article | 01/06/2004
Le méthane détruit-il l'ozone ?
01/06/2004
Résumé
Rôle du méthane comme précurseur d'ozone dans la troposphère et son influence sur la destruction de l'ozone dans la stratosphère.
Question
« L'ozone est-il détruit par le méthane ? »
Réponse
Pour répondre à cette question, il faut distinguer ce qui se passe dans la troposphère et dans la stratosphère.
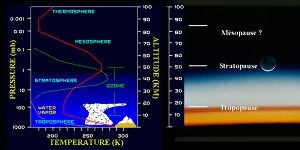
Figure 1. Température, vapeur d'eau et ozone dans l'atmosphère terrestre
Schéma montrant les différentes couches de l'atmosphère ainsi que les variations de la température (en rouge), de la teneur en ozone (en vert, à titre indicatif, la valeur maximale d'ozone dans la stratosphère est de l'ordre de 30 mPa sur ce schéma) et de la teneur en vapeur d'eau en fonction de l'altitude.
Dans la troposphère
Il est admis que le méthane (CH4) va plutôt produire de l'ozone (O3) dans la troposphère. C'est pour cette raison qu'il est appelé « gaz précurseur de l'ozone ». Pour qu'il produise de l'ozone, il faut que plusieurs conditions soient réunies. En particulier, il faut que les oxydes d'azote soient présents en concentration suffisamment élevée (supérieure à quelques dizaines de millièmes de milliardièmes (10-12), conditions généralement rencontrées) et que l'insolation soit suffisante.
Il s'en suit alors un cycle de production :
- RO2• + NO• → NO2 + RO•
- NO2 + hν → NO + O•
- O• + O2 → O3
où RO2• est un radical issu de l'oxydation du méthane (ou d'autres hydrocarbures) (CH3O2 dans le cas du méthane).
où RO2• est un radical issu de l'oxydation du méthane (ou d'autres hydrocarbures) (CH3O2 dans le cas du méthane).
Dans la stratosphère
Le problème est différent dans la stratosphère. Dans la stratosphère, deux processus aboutissent à la destruction de l'ozone.
Le premier processus fait intervenir le rayonnement lumineux de longueur d'onde inférieur à 320 nm :
- O3 + hν (<320 nm) → O• + O2
- O• + O3 → 2O2
Le second processus fait intervenir les cycles X +O3, où X• est un catalyseur pouvant être un radical libre •OH, Cl•, Br• ou NO• :
- X• + O3 ↔ XO• + O2
- XO• + O• ↔ X• + O2
- soit O• + O3 ↔ 2O2
Dans le second processus, on remarque en particulier que le radical OH• participe à ce cycle catalytique de destruction de l'ozone. Or le méthane en s'oxydant produit de la vapeur d'eau (H2O). Cette source est négligeable dans la troposphère. Mais dans la stratosphère, région sèche, elle est importante. La vapeur d'eau produit des radicaux OH (H20 + O•(1D) → 2OH). Donc, plus de méthane, plus de H2O, plus de OH et plus de destruction de l'ozone. Cet effet n'est cependant pas dominant : diminution de O3 de 5 à 10% au-dessus de 50 km pour un doublement du méthane.
Le rôle du méthane dans la troposphère est par contre une composante majeure de la chimie à prendre en compte.
Remarque. Un radical libre porte sur sa couche externe un ou plusieurs électrons célibataires (non appariés à un électron de spin opposé). C'est cette configuration qui explique sa haute réactivité chimique : le radical libre cherche à capturer un électron pour compléter sa couche électronique.
Pour en savoir plus
Vidéo conférence de Didier Hauglustaine sur le site de la Cité des Sciences : « Le cycle du carbone et autres gaz à effet de serre » et « Ozone et particules ».
Cours sur la photochimie atmosphérique de l'Université du Québec à Chicoutimi.