Article | 10/04/2019
Le lithium (Li) : aspects géologiques, économiques et industriels
10/04/2019
Résumé
Salars, saumures, pegmatites à spodumène… : gisements, exploitation et usages du lithium.
Table des matières
- L'élément lithium : origine, découverte, abondance, propriétés
- Ressources et réserves
- Production
- Formes finales du lithium
- Références
Février 2011, Le Figaro titre : Lithium, la ruée vers l'or blanc. De quoi raviver des souvenirs aux plus anciens d'entre nous (1848-1852 n'est pas si loin) et aux amateurs de Charlie Chaplin (The Gold Rush, 1925). Depuis le début des années 2010, le métal le plus léger du tableau périodique de Mendeleïev attise les convoitises, nourrit les imaginaires, se place sur le devant de la scène, propulsé par sa notoriété nouvellement acquise grâce au développement sans précédent du stockage électrochimique de l'électricité et du potentiel lié à la mobilité « bas carbone ». Les voitures deviennent électriques, les bicyclettes ont suivi, les trottinettes assistées envahissent les trottoirs des grandes villes. À en croire l'objectif affiché par nombre de gouvernements[1] de reléguer les véhicules thermiques au rang de lointain souvenir, tout le monde roulera « vert »[2] dans un futur plus proche qu'on n'ose le croire. Or, toute cette effervescence autour du transport du futur est fondée sur le stockage électrochimique de l'électricité dont la technologie éprouvée et approuvée est elle-même fondée sur une batterie dont le lithium est l'un des composants principaux[3]. Sans lui, pas de batterie pour nos smartphones ni de transition vers un parc automobile « bas carbone ».
L'occasion est bonne, en ces temps où la transition énergétique est au cœur du débat, de revenir sur la géologie de ce métal et sur les origines de cet attrait renouvelé pour le lithium, un élément utilisé pourtant depuis bien longtemps dans l'industrie, mais dont les applications “invisibles” au grand public n'intéressaient à vrai dire pas grand monde jusqu'ici.
Qu'en est-il vraiment ? Qu'est-ce que le lithium ? Où et comment se sont formés les gisements exploités aujourd'hui ? Y en a-t-il en France ? Comment sont-ils exploités ? À quel prix (écologique, économique, politique) ? Quels sont les processus industriels permettant la transformation des matières premières exploitées en produits finis utilisables dans l'industrie ? Quelles sont les routes commerciales des matières premières une fois exploitées ? Quelles conséquences géopolitiques a cette distribution géographique ? Doit-on craindre une raréfaction des ressources ?
Autant de questions auxquelles nous tenterons de répondre ici. La démystification d'une nouvelle ruée vers l'or – blanc – mérite bien ça !
L'élément lithium : origine, découverte, abondance, propriétés
Le lithium est présent depuis le Big Bang et la naissance de l'Univers. Il fait partie, avec l'hélium et l'hydrogène, des trois seuls éléments engendrés à cet instant.
En fait, le lithium est un élément unique en son genre. Il a trois “caractéristiques génétiques” qu'il est le seul à posséder en même temps.
- Il a été synthétisé lors du Big Bang avec l'hydrogène et l'hélium. 1H et 4He représentent 99% des isotopes formés, 2H et 3He représentent quasiment le 1 % restant, le 7Li n'ayant été synthétisé qu'à l'état de trace (10−10 des noyaux formés).
- Ses deux isotopes (6Li et 7Li) ne sont pas synthétisés par les réactions de fusion nucléaire ayant lieu dans les étoiles ; au contraire, comme les deux éléments suivants sur la table périodique des éléments, le béryllium (9Be) et le bore (10B et 11B), il est détruit dans les cœurs de ces étoiles où ont lieu ces réactions de fusion.
- Une majorité du lithium (sauf le lithium issu du Big Bang) et la totalité du béryllium et du bore de l'univers sont obtenus par des réactions de spallation, réactions où des rayons cosmiques de très haute énergie cassent des noyaux de masse atomique 12 à 16 (carbone, azote, oxygène) en fragment plus petits.
Ces mécanismes de formation font que le lithium est un élément rare dans l'Univers (en nombre d'atomes, environ 10−10 par rapport à l'hydrogène et 10−4 par rapport au silicium, la référence pour les planètes telluriques), beaucoup plus rare que les autres métaux alcalins légers que sont le sodium (Na) et le potassium (K).
Découvert sous forme de sel en 1817 par Johan August Arfwedson dans des minéraux de pétalite (LiAlSi4O10), il a fallu attendre que les procédés électrochimiques soient bien maitrisés pour qu'il soit isolé par William Thomas Brande et Humphry Davy l'année suivante. Il tire son nom du grec “lithos”, la pierre, ayant été découvert dans des minéraux, à la différence des autres alcalins connus à l'époque, le potassium et le sodium, qui, eux, avaient été découverts dans des organismes végétaux, en particulier dans leurs cendres. Sa découverte et son isolement n'ont pas été rendus facile par sa haute réactivité avec l'oxygène et l'eau. Dans la nature, il n'est ainsi jamais présent dans sa forme native mais toujours sous forme de sels, ou d'oxydes, dans des minéraux.
Source - © 2005 W. Oelen – CC BY-SA 3.0
Figure 1. Échantillon de lithium métal
Le lithium métallique ne peut être stocké que dans l'huile et sous atmosphère protectrice car il est trop réactif pour être stocké dans l'eau ou l'air. Il est si peu dense qu'il flotte dans l'huile.
La croute terrestre en contient environ 20 ppm (10−6), les océans environ 17 ppm. C'est le 33ème élément le plus abondant de la croute. Des accumulations naturelles en Amérique du Sud contiennent jusqu'à 0,16 % Li (1600 ppm, soit 1,6 kg/tonne) ; et certaines en Australie jusqu'à 4 % (40 000 ppm, soit 40 kg/tonne).
Tableau 1. Abondance du lithium dans l'Univers et dans la croute terrestre – Comparaison avec les autres alcalins légers
Élément | Abondance atomique cosmique normalisée à Si = 106 atomes | Abondance atomique dans la croute terrestre normalisée à Si = 106 atomes | Teneur massique dans la croute (ppm) |
|---|---|---|---|
Silicium (Si) | 106 | 106 | ≈ 280 000 |
Lithium (Li) | 102 | 103 | ≈ 20 |
Sodium (Na) | 3.104 | 105 | ≈ 23 000 |
Potassium (K) | 5.103 | 5.104 | ≈ 20 000 |
L'abondance cosmique est supposée équivalente à l'abondance dans l'atmosphère solaire, les chondrites primitives et donc la Terre globale.
On voit que le lithium (en masse) est environ 1000 fois moins abondant que le sodium et le potassium dans la croute, mais 10 fois plus abondant dans la croute que dans la Terre globale. La croute montre déjà un enrichissement en lithium d'un facteur 10 par rapport à la Terre globale. Les minerais de lithium sont enrichis d'un facteur 100 par rapport aux roches “crustales” usuelles.
Le lithium, comme les autres éléments alcalins sodium, potassium…, possède deux propriétés chimiques à l'origine de ses minerais : (1) il est très soluble dans l'eau sous forme de sels, d'hydroxydes…, (2) il est “incompatible”, mot qui a plusieurs synonymes, dont hygromagmaphile ou hygromagmatophile, et qui renvoie à la propriété qu'ont certains éléments à être difficilement intégrés dans les silicates qui cristallisent à partir d'un magma silicaté et qui se concentrent donc dans la phase fluide résiduelle. Inversement, les éléments incompatibles sont les premiers à quitter le réseau cristallin des silicates pour gagner le magma lors d'une fusion partielle. Rien que cette deuxième propriété explique la surabondance des alcalins (dont le lithium) dans la croute par rapport à la Terre globale.
Enfin, et pour commencer à répondre à la question de l'intérêt suscité par le lithium dans l'industrie, il est le plus léger des alcalins. Sa légèreté et son fort potentiel électrochimique en font un élément de choix dans les applications de stockage de l'électricité dans les batteries.
Ressources et réserves
Rappel de quelques définitions
Quand la géologie naturaliste entend généralement “ressources”, l'industrie minière, elle, s'intéresse plus particulièrement aux “réserves”. Ces deux notions, dont la distinction est identique en anglais (resources vs. reserves), méritent d'être éclaircies pour éviter tout malentendu.
Les ressources désignent l'ensemble des volumes d'une matière première contenue dans le sous-sol (terrestre aujourd'hui, qui sait où la technologie et les velléités consuméristes nous emmèneront demain). Un calcul grossier permet d'établir rapidement une estimation des ressources : ressources = concentration moyenne × volume, où le volume correspond à la zone étudiée. Toutes les ressources ne sont pas encore connues à ce jour, quelle que soit la matière première considérée. On parle de “ressources ultimes” pour désigner la quantité théorique d'une matière contenue dans un volume étudié.
Quant à la notion de réserves, elle regroupe non seulement des aspects géologiques (concentration, zone étudiée, couche géologique…) mais aussi et surtout des contraintes techniques, économiques, temporelles…
Les réserves désignent en effet les volumes d'une matière première récupérables, à un instant donné, aux conditions techniques, économiques, environnementales, politiques… ou en passe de l'être. Ainsi, les réserves ne constituent qu'une partie seulement des ressources (environ un tiers en ce qui concerne le lithium d'après la Deutsche Bank, un quart pour le pétrole d'après les données de l'Agence Internationale de l'Énergie).
Dans l'industrie minière, les réserves dépendent de nombreux éléments.
- Le rythme d'exploitation des gisements connus, qui, assez logiquement, conduit à une diminution des réserves si l'on ne tient pas compte des nouvelles découvertes.
- Les ressources. Les nouvelles découvertes issues des campagnes d'exploration menées par l'industrie minière amènent un accroissement des réserves.
- La teneur des gisements de la matière première considérée.
- La profondeur du gisement et les conditions d'exploitation (mine à ciel ouvert ou souterraine) dont dépendent en partie les couts d'exploitation et donc la rentabilité d'un projet.
- L'évolution des techniques mises en œuvre pour exploiter un gisement. Les techniques évoluent au cours du temps et permettent d'exploiter des gisements aujourd'hui qui n'étaient pas accessibles hier. Entre autres exemples spectaculaires, la congélation des sols à grande échelle dans certaines mines d'uranium au Canada situées à plus de 400 m de profondeur.
- L'évolution des techniques et procédés physico-chimiques mis en œuvre pour extraire l'élément de son minerai. Par exemple, les oxydes, carbonates, sulfures… de fer constituent des réserves de fer, pas les silicates comme la fayalite (Fe2SiO4) car le fer est trop difficile (donc trop couteux) à extraire de la maille silicatée.
- Les éléments économiques au sens large (le cours des matières premières, les taux de change…). Ainsi, plus le prix auquel est vendue la matière première considérée augmente, plus il est possible d'exploiter des gisements plus faiblement concentrés, ou plus profonds… et plus les réserves augmentent. À l'inverse, plus le prix décroit, moins les réserves sont importantes.
Parmi ces éléments, certains évoluent dans le temps, notamment les nouvelles découvertes, les techniques et les couts d'exploitation, et le prix. C'est la raison pour laquelle il est important de préciser, dans la définition des réserves, la période considérée.
Un gisement est quant à lui défini comme une accumulation de matériau dont l'exploitation fait sens, à un moment donné. Ainsi, il se peut qu'un même gisement soit exploitable à un temps donné mais plus à un autre. De même, il se peut qu'à un temps donné, un gisement soit exploitable dans une région du monde quand un gisement similaire ne le soit pas dans une autre (instabilité politique locale, préoccupations sociale ou environnementale…).
À l'échelle d'un gisement, les réserves sont définies comme la masse de matière première à récupérer dans une masse totale de matériaux à déplacer, concasser, séparer, traiter, enrichir… L'exploitation de ces réserves est organisée en général dans le but d'optimiser la rentabilité du projet minier, c'est-à-dire les flux financiers (recettes − dépenses) sur la durée du projet.
Alors que les règles de définition des réserves sont très strictes dans le domaine pétrolier où les réserves subissent une relecture assidue de la SEC (US Securities and Exchange Commission – équivalent de l'Autorité des Marchés Financiers, ou AMF, en France), les standards sont plus divers dans l'industrie minière. On trouve, entre autres : le standard australien JORC, le standard sud-africain SAMREC, le standard canadien CIM.
Cela dit, dans l'industrie minière, l'usage veut qu'une compagnie minière déclare ses réserves à un niveau optimal pour assurer un taux de renouvellement suffisant couplé à une rémunération juste de ses actionnaires. Bien que les chiffres déclarés par l'industrie soient en général fiables, certaines sociétés prennent des libertés par rapport à ces standards, parfois pour attirer des investisseurs, parfois aussi pour conserver une place dans le “top z” mondial…
Les deux grands types d'accumulation géologique de lithium
Les concentrations utiles de lithium sont dues principalement aux deux propriétés déjà signalées ci-dessus : (1) c'est un élément dont sels et hydroxydes sont solubles, (2) c'est un élément incompatible. Il existe donc des minerais sédimentaires sensu lato qui ont pour origine la solubilité, des minerais magmatiques sensu lato qui ont pour origine l'incompatibilité, et des minerais hydrothermaux sensu lato qui ont pour origine les deux propriétés à la fois. Les deux principaux types de gisements se trouvent (1) dans des saumures de lacs salés, gisements dus à la solubilité, et (2) dans des pegmatites et certains granites, gisements dus à l'incompatibilité.
Les ressources de lithium sont évaluées par l'USGS en 2017 à 53 Mt (la Bolivie, de façon assez surprenante, n'étant pas prise en compte dans le calcul). Dans cet article, nous prendrons en compte les données de la Deutsche Bank qui paraissent plus réalistes et qui donnent des ressources mondiales en 2017 de 273 Mt Li.
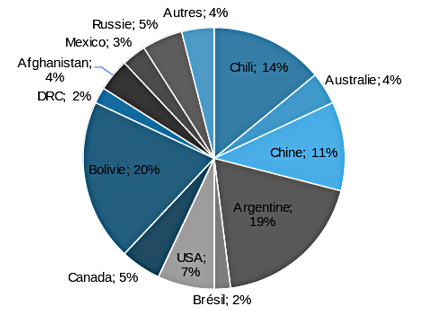
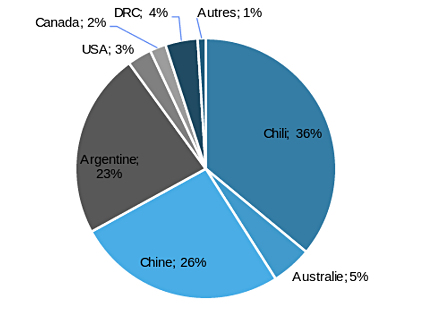
Comme le montre la figure 2, les ressources de lithium sont concentrées d'abord en Amérique du Sud avec plus de 53 % des ressources mondiales. Suivent la Chine, avec 30 Mt Li, les États-Unis avec 19 Mt Li. L'Australie n'est pas en reste avec 11 Mt Li de ressources. Le reste du monde se partage les 25 % restants.
Les réserves, quant à elles, présentent une distribution significativement différente (figure 3). On retrouve l'Amérique du Sud avec plus de 59 % des réserves mondiales de lithium (60 Mt). La Chine suit toujours mais les États-Unis sont loin derrière alors que l'Australie conserve une place prépondérante dans le classement. La Bolivie disparait des écrans radars, étant donné qu'aucune des ressources ne sont économiquement exploitables aux conditions techniques, économiques et politiques actuelles.
Quelles sont les conséquences de tels classements ? Il y a de toute évidence une mainmise des pays du triangle du lithium (Argentine, Bolivie, Chili) sur les ressources, et donc sur le potentiel de développement de projets miniers visant l'exploitation du lithium à long terme. De même, la Chine, qui détient des réserves en lithium significatives ainsi qu'un tissu industriel très développé de la transformation du lithium en produit fini, participe de la concentration de l'exploitation du lithium.
Pourquoi est-ce si important ? Nos économies sont fondées sur la croissance du PIB, qui n'est ni plus ni moins que la conséquence d'une transformation d'une matière première en un produit fini consommé, parfois recyclé, souvent jeté. L'énergie, et plus précisément l'accès à une énergie bon marché, est au cœur de nos principes de développement. Or, la transition générale à laquelle on assiste aujourd'hui, d'une économie carbonée fondée sur l'exploitation des ressources énergétiques fossiles, à une économie “électrique”, nécessite le stockage de l'électricité (pallier l'intermittence des renouvelables, rendre possible le transport routier électrique…). Étant donné que la technologie plébiscitée est le stockage électrochimique dans des batteries au lithium, cela pourrait entrainer une dépendance forte de notre développement économique au lithium, comme il l'a été par le passé au pétrole. L'expression largement partagée d'« or blanc » ne vient pas de nulle part… Le contrôle de la production de lithium et de sa transformation par un petit nombre pourrait alors représenter un risque pour des pays ou régions dépourvus d'une telle chaine d'approvisionnement comme l'Europe dont les ressources et réserves en lithium sont très limitées.
Pour clarifier les ordres de grandeurs mis en jeu, prenons l'exemple des automobiles. Avec les batteries actuelles, il faut environ 10 kg de lithium pour une batterie “classique” d'automobile de 50 kWh (environ 1 kg de carbonate de lithium par kWh de capacité dans la cathode et dans l'électrolyte). Un parc mondial d'un milliard de voitures électriques en service nécessitera 10 milliards de kg, soit 10 millions de tonnes, soit 10 % des réserves telles qu'indiquées à la figure 3.
Le lithium dans les saumures
Les saumures d'Amérique du Sud
Le « triangle du lithium » en Amérique du Sud, qui s'étend sur trois pays (Chili, Argentine et Bolivie par ordre d'importance actuelle dans l'économie du lithium), représente à la fois la première région en ce qui concerne la production de lithium (45 % de la production mondiale en 2017, selon l'USGS) mais aussi les ressources/réserves (53 % des ressources, 60 % des réserves en 2017, selon la Deutsche Bank).
Les gisements de lithium sont situés dans des salars, nom donné à des grands lacs salés partiellement ou totalement asséchés en altitude (~2000 à 4000 m) dans la cordillère des Andes. Les plus importants sont le salar d'Uyuni en Bolivie, le salar d'Atacama au Chili et le salar de l'Hombre Muerto en Argentine.
Le lithium est contenu dans des saumures (des eaux fortement chargées en éléments solides dissouts) situées dans la porosité des formations sédimentaires, entre 1,5 et 60 m de profondeur dans les exploitations actuelles, jusqu'à 600 m dans un proche avenir.
Six caractéristiques communes distinguent les gisements de lithium de type « saumure ».
Les conditions climatiques arides qui :
- contribuent à la formation des salars dans un contexte de bassin fermé ;
- sont un facteur déterminant de la concentration naturelle en sels des eaux par évaporation ;
- sont essentielles à la concentration artificielle du lithium en vue de son exploitation industrielle.
- La localisation dans un bassin clos résultant de conditions tectoniques et climatiques, contenant un salar (lac salé asséché) ou un lac salé. Les lacs non asséchés ne sont pas exploités à cause de leur concentration plus faible en lithium.
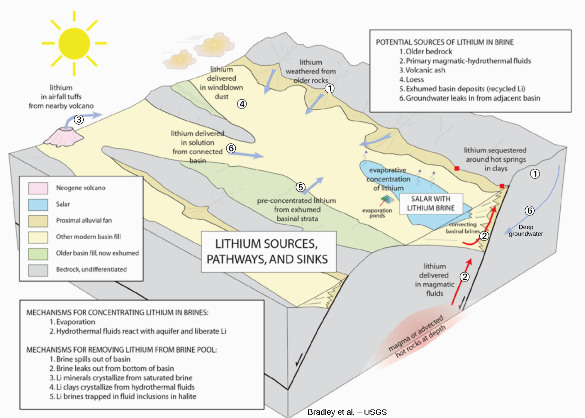
La présence d'une activité hydrothermale souterraine qui participe vraisemblablement :
- au lessivage du lithium des roches régionales déjà riches en lithium (en particulier des rhyolites et autres roches magmatiques acides différenciées et riches en alcalins) vers l'aquifère salin par les mouvements de fluides chauds souterrains ;
- à l'arrivée de lithium supplémentaire provenant des saumures magmatiques et de l'activité volcanique plus profonde que l'aquifère salin quand ce magmatisme actif existe ;
- à l'accumulation du lithium par distillation des eaux thermales de subsurface ;
- au mouvement du lithium d'un aquifère à un autre à l'échelle régionale et donc à son accumulation dans certains aquifères salins ;
- à la formation d'un minéral argileux riche en lithium, l'hectorite, qui, à son tour, peut jouer un rôle dans l'apport supplémentaire de lithium dans les aquifères salins.
- Le bassin est en subsidence tectonique.
- La présence d'une source de lithium conséquente. Celles-ci varient en fonction de l'aquifère salin considéré. Le lithium peut provenir de fluides magmatiques, d'hectorite (minéral argileux riche en lithium), de roches silicatées volcaniques (généralement acides), d'anciennes accumulations de sels. Ces sources sont encore aujourd'hui sujettes à caution. De nombreux travaux ont été et sont entrepris pour comprendre en profondeur quelles sont les sources originelles de lithium mais n'ont pas encore abouti à une conclusion générale très claire.
- Enfin, ce sont des environnements où le temps a pu faire son œuvre. À l'instar des sources de lithium, le facteur temps est encore assez mal compris dans la littérature qui s'attache à étudier les gisements d'Amérique du Sud. Les gisements aujourd'hui exploités seraient datés du Néogène (−23 à −5 millions d'années). C'est la période durant laquelle les Amériques du Nord et du Sud se sont rejointes, c'est aussi la période d'assèchement puis de remplissage de la Méditerranée avec la fermeture du détroit de Gibraltar.
Dans le cas du salar d'Atacama, ces conditions sont nombreuses à être réunies, ce qui explique la richesse de ce salar :
- le climat du désert d'Atacama est l'un des plus arides du globe ;
- la tectonique “intra-andine” a engendré depuis quelques millions d'années de nombreux bassins en extension de type graben, qui, vu le climat, fonctionnent en bassin endoréique (sans exutoire vers la mer) ;
- ce secteur de la Cordillère des Andes est particulièrement riche en rhyolite et autres roches acides et riches en alcalins ;
- cela fait des millions d'années qu'un hydrothermalisme actif existe dans cette région. Le champ de geysers du Tatio est le témoin actuel visible de cet hydrothermalisme (cf Champ hydrothermal du Tatio, Andes chiliennes).
Source - © 2013 D'après D.C. Bradley et al. / USGS
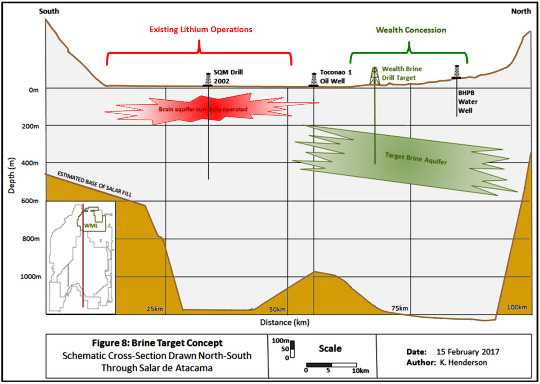
Source - © 2017 D'après J.E. Hiner – Wealth Minerals Ltd., modifié
Cette coupe Sud-Nord est dans la longueur du bassin. L'échelle verticale est exagérée d'un facteur 33 par rapport à l'échelle horizontale.
Figure 6. Vue globale de la dépression d'Atacama (Chili), contenant le salar d'Atacama Les zones blanches et plates sont majoritairement constituées de sels “propres” ; les zones marrons et plates sont constituées d'argiles et autres alluvions, ou de sels “sales”. On voit une chaine de volcans à l'Est (à gauche) de la dépression. Ces volcans ont une altitude allant de 5000 à 6000 m, le fond du salar est en moyenne à 2300 m. Les flèches indiquent les zones (artificielles) d'évaporation. La flèche jaune localise les bassins d'évaporation de la figure suivante. | Figure 7. Bassin d'évaporation dans le salar d'Atacama (flèche jaune de la figure précédente) Entre la plaine alluviale plus ou moins recouverte de sels sales et marrons et le désert ocre situé au pied des volcans, on voit les plaines de sels bien blancs. Parfois ces plaines sont bleues pâle quand elles sont recouvertes de quelques décimètres à mètres d'eau saturée en sels. |
Source - © 2010 W. Griem | Source - © 2019 googleuser Figure 9. Aspect d'une plaine de sels à mares résiduelles dont l'eau est recouverte d'une croute de sels Il serait intéressant de savoir si les “boules” situées au fond de l'eau sont faites de sels ou de carbonate de calcium. Elles auraient alors, dans ce dernier cas, une signification de stromatolites. D'autres photos du salar d'Atacama, de ses concrétions de sels et de ses curiosité biologiques sont à voir dans Micro-figures de dissolution dans du sel et dans Un exemple de salar : le salar d'Atacama, Chili.
|
Source - © 2018 D. Sherwood Figure 10. Bassins d'évaporation et tas de sels, salar d'Atacama (Chili) Au fond, la chaine volcanique d'altitude voisine de 5000 à 6000 m. Cette chaine de volcans arrête les pluies (ou plutôt les neiges) venant de l'Amazonie. C'est cette neige qui, en fondant, amène de l'eau au salar qui, à l'abri de ces montagnes, ne reçoit quasiment aucune pluie et constitue l'une des zones les plus arides au monde. | Figure 11. Champ hydrothermal du Tatio, Chili Dans cette zone volcanique du Tatio, l'hydrothermalisme a un rôle majeur dans la mobilisation du lithium. Le champ hydrothermal du Tatio montre que cet hydrothermalisme est actuellement bien actif. D'autres photos du Tatio sont visibles dans Champ hydrothermal du Tatio, Andes chiliennes. |
Les paramètres scrutés à la loupe lors de l'évaluation d'un projet “lithium-saumure” sont :
- le taux d'évaporation, dépendant des conditions climatiques locales, qui détermine en grande partie l'efficacité du processus d'enrichissement et de raffinage des saumures dans des “marais salants artificiels” (bassins d'évaporation), et donc la rentabilité des projets ;
- la teneur en lithium des saumures pompées dans les nappes phréatiques, l'un des paramètres principaux en vue de son exploitation, qui est au premier ordre responsable de la rentabilité d'un projet ;
- la présence et la teneur en co-produits, pour l'essentiel le chlorure de potassium, qui sont isolés lors du raffinage du lithium et sont ensuite vendus et permettent d'améliorer, parfois sensiblement, la rentabilité d'un projet ;
- la localisation, déterminante pour les couts logistiques du projet, et l'accès à un réseau de transport développé ou à la mer pour l'exportation des produits. Cette question est importante dans un environnement comme celui des salars : à haute altitude et isolés des grands axes de communication dans l'ensemble du triangle du lithium, éloignés des grands ports nationaux dans le cas de l'Argentine, sans accès à la mer dans celui de la Bolivie ;
- les niveaux d'impuretés (teneur et type), déterminants dans le cout du raffinage du lithium.
Les autres saumures
D'autres accumulations notables ont été découvertes dans des saumures géothermales, des saumures de gisement d'huile et de gaz. Ces accumulations sont marginales par rapport à leurs sœurs continentales en termes de lithium contenu.
Source - © 2017 D.C. Bradley et al. / USGS
Le lithium dans les pegmatites et les granites
Généralités
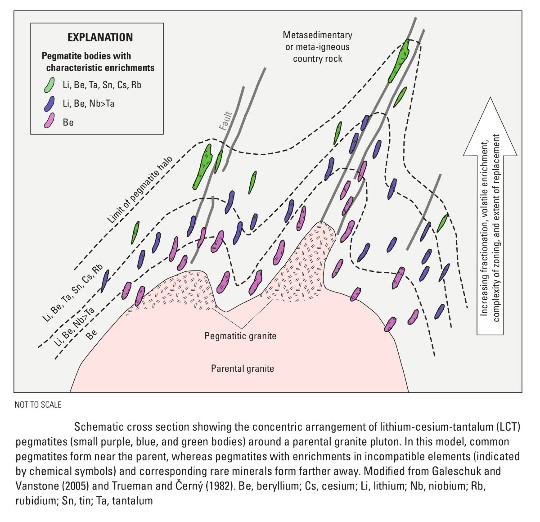
La deuxième catégorie de gisement de lithium est constituée principalement de certaines pegmatites et plus rarement de certains granites. Les granites proviennent d'une fusion partielle (de la croute continentale) plus ou moins poussée, de la différenciation d'un magma basique, de la fusion d'un manteau très métasomatisé/hydraté… Tous ces processus concentrent dans les liquides (magmas résiduels, fluides hydrothermaux) les éléments incompatibles que sont les alcalins. Dans certains cas, dont les causes sont encore discutées, certains granites sont beaucoup plus riches en lithium que les granites “ordinaires”.
Les pegmatites correspondent à des roches filoniennes (en général péri-granitiques) formées par la cristallisation des magmas les plus résiduels, très chargés en éléments incompatibles et en eau (cf. Pegmatites polies d'Afrique australe (Namibie et Afrique du Sud)). Rien d'étonnant à ce que les pegmatites soient les roches magmatiques les plus concentrées en lithium (et autres éléments incompatibles comme le bore, le béryllium, le fluor…), surtout autour des plutons déjà riches en lithium. Les deux principaux silicates contenant du lithium dans les pegmatites sont (1) le spodumène (figures 13 et 17), LiAlSi2O6, l'un des trois pyroxènes alcalins classiques (les autres étant l'aégyrine, NaFeSi2O6, pyroxène alcalin magmatique, et la jadéite, NaAlSi2O6, pyroxène métamorphique), et (2) du lépidolite (figures 14 et 15), un mica riche en lithium et en fluor, K(Li,Al)3(Si,Al)4O10(F,OH)2. On peut y rajouter un troisième minéral moins important, mais significatif : la pétalite (figure 16), phyllosilicate ou tectosilicate selon les sources, LiAlSi4O10.
Source - © 1904 U.S. Geological Survey Le mineur, à droite, donne l'échelle des cristaux géants de spodumène. | |
Figure 15. Monocrisal de lépidolite (origine inconnue), vue “normale” et par transparence Par transparence, on voit les stries de croissance qui forment des motifs hexagonaux. |
Les pegmatites et granites d'Australie
Les gisements de lithium australiens n'ont pas grand-chose à voir avec les gisements de type saumure du triangle du lithium d'Amérique du Sud. Loin d'être négligeable, l'exploitation du lithium est responsable de plus de 47 % de la production mondiale en 2017 !
La faible médiatisation des gisements de lithium australiens tient au fait que les projets les plus récents ont été développés en Amérique du Sud pour des raisons économiques, les investissements étant plus faibles dans le triangle du lithium qu'en Australie à capacité de production égale (ceci étant susceptible de changer dans les années à venir étant donné l'importance grandissante de l'hydroxyde de lithium face au carbonate de lithium dans la manufacture de batteries – l'hydroxyde de lithium étant moins couteux à produire à partir de “lithium spodumène” qu'à partir du “lithium saumure”).
En Australie, on trouve des accumulations de lithium dans plusieurs minéraux différents, dont le principal est le spodumène, LiAlSi2O6. On en trouve aussi mais dans une moindre mesure, dans des minéraux de pétalite (phyllosilicate ou tectosilicate selon les sources, LiAlSi4O10), ou de lépidolite (phyllosilicate de la famille des micas).
Ces minéraux sont présents dans les pegmatites australiennes (issues de la cristallisation finale de liquides riches en eau, liquides résiduels de cristallisation d'un magma granitique), qui ont une origine très ancienne.
Source - © 2018 Benchmark Minerals Figure 17. Spodumène d'Australie de l'Ouest | Source - © 2017 D'après M.T. Sweetapple |
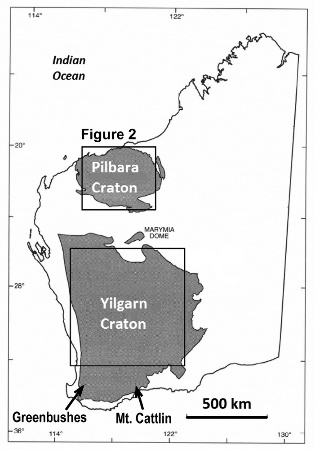
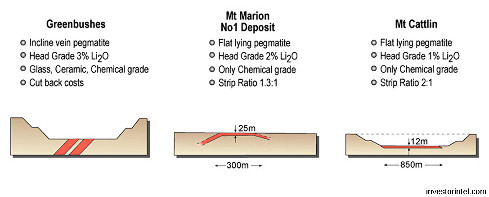
Les gisements pegmatitiques de Greenbushes, Mount Marion et Mount Cattlin sont tous les trois situés en Australie de l'Ouest, au Sud du craton de Yilgarn. Les pegmatites ont été datées autours de 2,65-2,60 Ga. Elles seraient issues de granites (2,65-2,62 Ga), dont le magmatisme a perduré au moins jusqu'à 2,61 Ga.
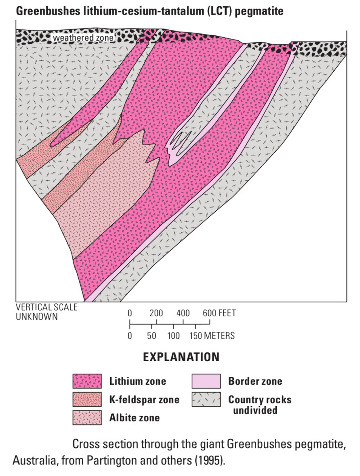
Les pegmatites de Greenbushes ont une histoire un peu particulière à l'origine de la minéralisation que l'on connait aujourd'hui et à la teneur en lithium induite. Situées au Sud-Ouest du carton de Yilgarn, elles sont datées de 2525-2610 à 2589 Ma, soit après tous les événements tectoniques et magmatiques qui ont affecté l'Est du craton. La zone a été le théâtre de transformations (cisaillement, déformation tectonique) et les pegmatites finissent dans un large corridor tectonique qui leur donne leur minéralisation particulière (fort pendage). La cristallisation semble avoir eu lieu à plus haute pression et plus haute température que plus à l'Est. Ainsi, on trouve une teneur allant jusqu'à 4 % Li2O à Greenbushes, beaucoup plus importante que dans les gisements de l'Est, Mount Marion et Mount Cattlin.
De même, alors que les granites sources de Mount Marion et Mount Cattlin ont été identifiés, celui (ceux ?) des pegmatites de Greenbushes manque(nt) toujours à l'appel.
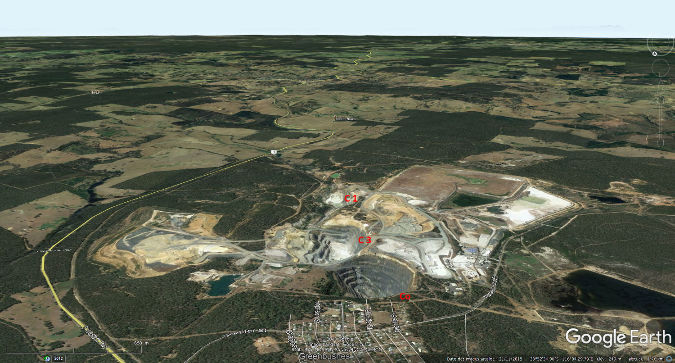
Figure 19. Vue aérienne des mines de Greenbushes, Australie-Occidentale Il y a 3 mines principales Cornwall Pit (Co), C3 Pit et C1 Pit. | |
Source - © 2016 InvestorIntel Figure 20. Vue sur la paroi Sud-Est de la mine à ciel ouvert Cornwall Pit, Greenbushes On voit très bien un filon clair étroit en haut et d'autres plus larges en bas (pegmatites) recouper l'encaissant beaucoup plus sombre. | Source - © 2010 D.C. Bradley et al. / USGS Figure 21. Coupe schématique du gisement de Greenbushes, Australie-Occidentale On ne connait pas le(s) granite(s) d'où proviennent les filons de Greenbushes. |
Les gisements pegmatitiques de Pilbara sont situés dans le craton du même nom. Ici, les pegmatites sont datées de 2,88-2,83 Ga. Elles ont des associations géochimiques et géochronologiques avec les monzogranites de la Split Rock Supersuite (2,85 Ga) dont elles seraient issues.
Comme le montrent les figures ci-dessous, la minéralisation du lithium varie d'un gisement à l'autre. Ces variations ont logiquement pour origine les différents contextes géologiques historiques décrits ci-dessus. Et comme conséquence une variation des couts d'exploitation des gisements, ceux-ci étant liés, entre autres paramètres, à la teneur en lithium, à la profondeur de la minéralisation (qui détermine la quantité de stérile à dégager avant d'atteindre le gisement caractérisé par le strip ratio, égal au ratio [volume de stérile / volume de minerai] – plus le strip ratio est important, plus les couts seront importants).
Source - © 2017 D.C. Bradley et al. / USGS Plus l'on s'éloigne du granite source, plus la concentration en éléments incompatibles (Li, Be, Ta, Ce...) est importante. | Source - © 2017 InvestorIntel |
Les autres gisements dans des pegmatites et granites
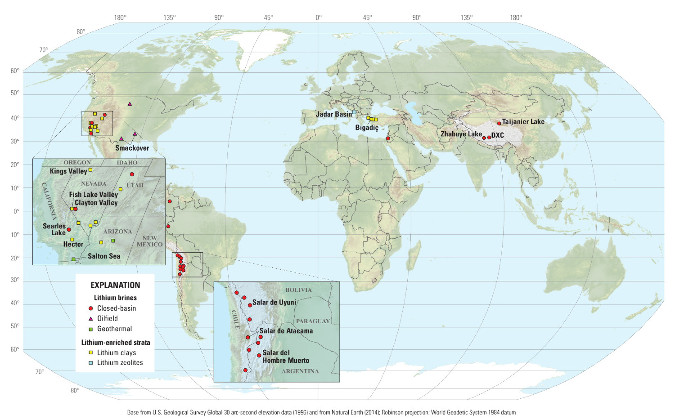
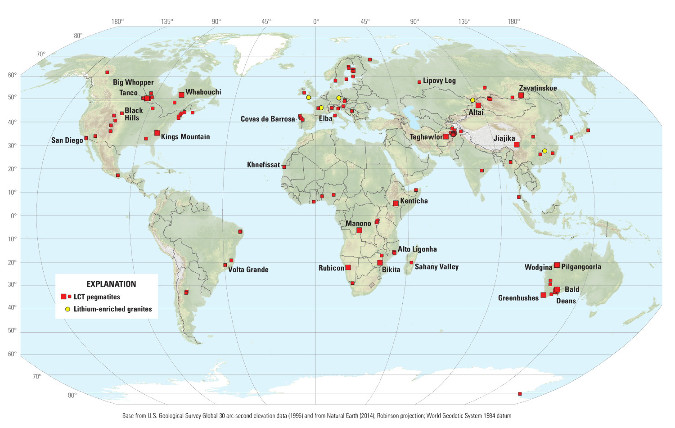
Comme le montre la figure suivante, les ressources de lithium contenues dans des pegmatites et des granites dépassent largement le cadre australien et sont bien réparties géographiquement. Contrairement aux saumures, on en trouve sur tous les continents, chose assez rare (dans l'industrie minière) pour être remarquée.
Source - © 2017 D.C. Bradley et al. / USGS
Figure 24. Répartition des pegmatites à lithium-césium-tantale (LCT) et granites à lithium
On peut noter que deux gisements sont signalés en France : les pegmatites des Monts d'Ambazac et le granite d'Échassières.
Autres sites et types de gisements
D'autres gisements de lithium existent, souvent passés sous silence du fait de leur importance moyenne en termes de production actuelle. En voici une petite revue.
En Chine
La Chine détient une bonne partie des réserves de lithium mondiales (26 % selon la Deutsche Bank), dans des gisements de type “saumure” et des gisements de type “roche”.
Les principaux gisements connus à ce jour sont les suivants.
Les gisements de saumures continentales regroupent 80 % des ressources chinoises de lithium. Les lacs salés sont localisés en majorité dans les provinces du Qinghai et au Tibet. Parmi les plus importants, on trouve :
- le lac salé de Zhabuye au Tibet. Selon la compagnie exploitant le gisement, Zhabuye Lithium, les réserves seraient de 1,53 Mt Li, mais de nombreux observateurs et analystes mettent en doute ce chiffre qui serait largement surévalué ;
- les lacs salés de Taigener Est et Ouest dans le Qinghai (au Nord-Est du Tibet) ;
- … il y aurait plus d'une trentaine de lacs salés pouvant présenter un intérêt économique à l'exploitation minière du lithium.
Les gisements de pegmatites, dans les provinces du Xinjiang (Nord-Ouest de la Chine, au Nord du Tibet) et du Sichuan (à l'Est du Tibet), et ceux de lépidolites, dans la province du Jiangxi, renferment les 20 % restants des ressources chinoises de lithium. Les gisements les plus importants sont :
- le gisement de Jiajika, détenu par la société Sichuan Mineral Industry ;
- le gisement de Maerkang détenu par Sichuan Ni and Co ;
- les gisements de Daoxian et de Lushi détenu par Sterling Group Ventures ;
- la mine de Jumehuan détenue par Sichuan Dexin.
Les gisements chinois sont en partie déjà en cours d'exploitation. Cependant, à court et moyen termes, il semble qu'il y ait peu de chance qu'ils soient exploités à grande échelle pour les raisons suivantes :
- la technologie chinoise n'est pas encore parfaitement au point pour l'exploitation des gisements de saumures continentales ;
- les ressources de spodumène sont substantielles mais les teneurs sont faibles, entrainant des couts d'exploitation plus élevés et donc un ajournement du développement des projets. D'autre part, les projets rencontrent la résistance des populations locales dans la province du Sichuan ;
- Les ressources de lépidolite ont les mêmes inconvénients que leurs camarades de spodumène. S'y ajoute le fait que peu de co-produits sont disponibles, avec moins de “crédit” à la clé d'une exploitation potentielle.
Aux États-Unis
Des gisements de pegmatites existent, ainsi que des gisements de type “saumures” continentales et géothermales. Certains d'entre eux étaient exploités jusqu'à ce que le triangle du lithium entre en production, entrainant une baisse générale des prix du lithium, et la fermeture des sites nord-américains pour raisons économiques. Les réserves états-uniennes de lithium sont estimées à 3,2 Mt Li, les ressources à environ 19 Mt Li.
Au Canada
Des gisements de pegmatites importants existent, certains sont en cours de développement. Les entreprises sont à plusieurs stades de développement selon les projets : exploration pour certaines, usine pilote de traitement pour d'autres, recherche de financement, enfin, pour celles qui restent.
Les réserves canadiennes sont aujourd'hui limitées (1,7 Mt Li) mais les ressources sont comparables à celles de leur voisin (14 Mt Li).
En Europe (France non comprise)
Un petit mot sur l'Europe qui, malgré des niveaux de réserves et de ressources loin d'être significatifs sur le plan mondial, présente l'intérêt d'être sur un territoire proche des centres de consommation finaux (et non des centres de consommation intermédiaires qui restent encore aujourd'hui très asiatiques).
Le développement de projets miniers de production de lithium sur le sol européen participerait à la localisation de la partie amont de la chaine de transformation de la matière première en produit fini utilisé par les citoyens européens, et donc d'une partie de la valeur ajoutée. L'Europe, consciente des enjeux de dépendance économique liés au développement de la mobilité électrique, tente de développer une filière industrielle intégrée de la batterie. La localisation des mines de lithium en Europe bénéficierait directement à cette filière.
Deux gisements ont attiré l'attention des observateurs ces dernières années.
- Le gisement de Jadar, en Serbie (projet de la multinationale minière Rio Tinto). On trouve le lithium dans les minéraux de jadarite, LiNaSiB3O7(OH), à 1,8 % Li2O et 13,1 % B2O3.
- Au Portugal, la société britannique Savannah Resources, espère ouvrir en 2020 la “première” mine de lithium européenne. La société portugaise Lusorecursos espère aussi pouvoir développer une mine de lithium. Ce qui semble être des accumulations de lithium ne sont pas encore déclarées comme réserves. Ces deux compagnies sont toujours en phase d'exploration mais la délivrance de permis par l'Etat portugais est de bon augure pour un développement potentiel d'un approvisionnement local en lithium.
Source - © 2005 T. Cabral / phys.org | Source - © 2005 T. Cabral / phys.org |
Les ressources françaises sont détaillées plus bas.
Gisements potentiels dans des roches volcaniques
Les recherches de lithium continuent. Des bruits courent, de vraies comme de fausses nouvelles sont propagées, faisant état de nouveaux gisements et même de nouveaux types de gisements. Par exemple, la compagnie Plateau Energy Metals Inc. est une compagnie qui possède de larges ressources en uranium au Pérou et qui s'est focalisée sur des anomalies en lithium extérieures aux zones à uranium. Au Pérou, dans des ignimbrites récentes équivalentes aux leucogranites français de par leur chimisme peralcalin, cette compagnie a annoncé le 4 mars 2019 (cf. globenewswire.com) avoir trouvé un gisement qui pourrait être le sixième gisement mondial dans des roches dures (hors salars donc). L'avenir dira ce qu'il en est.
Le lithium en France
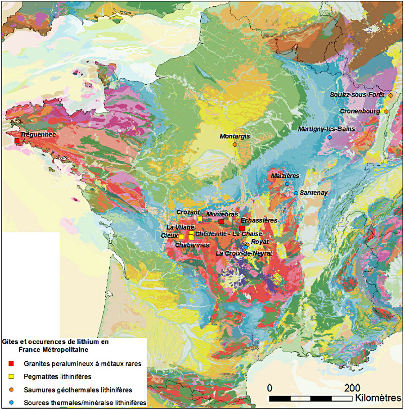
Il existe en France des gisements de lithium, mais qui n'ont jamais eu une grande importance économique. Les réserves sont négligeables, mais les ressources potentielles importantes. Tous les renseignements ci-dessous viennent d'un rapport public du BRGM, Panorama 2011 du marché du Lithium (BRGM/RP61340-FR, juillet 2012, J.F. Labbé et G. Daw).
Source - © 2012 J.F.Labbé et G.Daw / BRGM
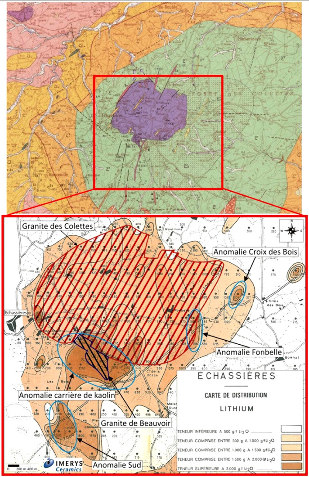
Figure 27. Carte des indices lithinifères de France métropolitaine
On trouve des filons de pegmatites dans l'Ouest du Massif Central, trois granites (Bretagne et Ouest du Massif central), des sources minérales (Massif Central, Vosges occidentales) et des eaux de forages géothermiques (Massif Central, Bassin Parisien, Alsace).
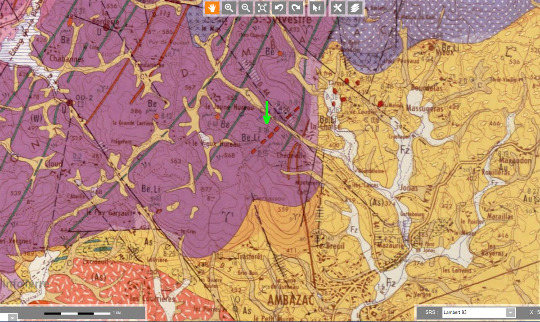
C'est surtout les pegmatites lithinifères du Limousin (dont les pegmatites de Chédeville associées aux leucogranites de la région d'Ambazac, Haute-Vienne) et un granite de la Creuse, le granite de Montebras, qui ont fourni du lithium à la fin du XIXe et au début du XXe siècle. Le granite d'Échassières, qui n'en produisait pas, en fournit maintenant comme sous-produit de l'exploitation du kaolin.
On exploitait les feldspaths des pegmatites de la région d'Ambazac pour l'industrie de la porcelaine (on est près de Limoges). Les pegmatites de Chédeville (près d'Ambazac) ont été exploitées par Saint Gobain qui a récupéré 7000 tonnes de lépidolite pour la verrerie. Les filons de Chédeville contiendraient encore de la lépidolite, représentant 1,4 kt de lithium. Ces ressources ne sont pas valorisables dans le contexte actuel.
Le lépidolite, mica lithinifère, a une belle couleur mauve violacé. | Échantillon récolté en 1972. |
Échantillon récolté en 1972. |
Actuellement, le groupe Imerys exploite (pour l'industrie des céramiques) les feldspaths d'un leucogranite complexe et riche en pegmatites et filons divers, le granite de Montebras dans la Creuse. Ces roches contiennent des minéraux lithinifères (principalement amblygonite (Li,Na)AlPO4(F,OH) et montebrasite LiAl(PO4)(OH)) qui ne sont pas valorisés. Historiquement, le gisement de Montebras a fourni de l'étain (cassitérite, SnO2), de l'amblygonite et du lépidolite. Au début du XXe siècle, Montebras était l'une des principales sources de lithium du monde. Il resterait 3,5 kt de lithium dans le gisement, non valorisable dans les conditions économiques actuelles.
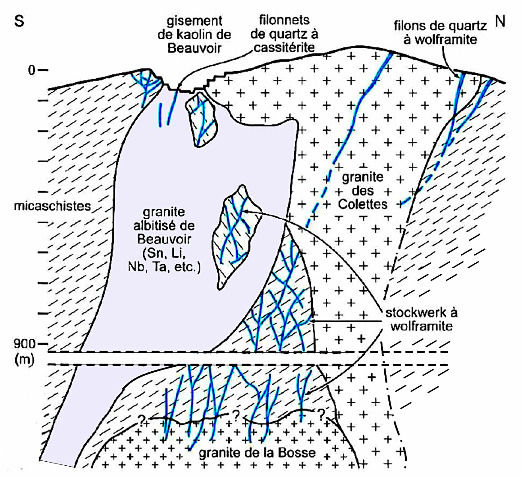
Le complexe granitique dit d'Échassières, dans l'Allier (juste à la limite du Puy de Dôme) est un ensemble de trois granites tardi-hercyniens intrusifs dans une série métamorphique et s'interpénétrant : les granites de la Bosse, des Colettes et de Beauvoir. Historiquement, le complexe granitique d'Échassières a été exploité pour la cassitérite, le minerai d'étain (SnO2), en particulier à l'époque romaine. Il a aussi été exploité pour le tungstène (wolframite, (Fe,Mn)WO4) entre 1913 et 1962, et pour le kaolin depuis 1852, kaolin encore exploité de nos jours par la société Imerys. Imerys valorise un sous-produit de l'exploitation du kaolin, un sable issus de la partie non argileuse du granite altéré, qui est un sable lithinifère. Il produit 15 kt/a de sable à 0,9 % de Li et 20 kt/a de roche broyée à 0,5 % de Li. Ces produits lithinifères sont destinés à la verrerie. Les ressources d'altérite lithinifère seraient de 24 kt de lithium.
Le granite de Beauvoir contient la majorité du lithium du complexe d'Échassières. Le granite sain, très riche en albite, contient 0,35 % de Li surtout sous forme de lépidolite disséminé dans la masse du granite. Cela représenterait une ressource de 130 kt de lithium. Ces ressources ne sont pas valorisables dans les conditions économiques actuelles. Elles pourraient cependant le devenir en cas de très forte tension sur le marché du lithium. Il est à noter qu'en 1979, ces ressources représentaient 4 % des réserves mondiales connues. Échassières était alors considéré comme un gisement potentiel majeur de classe mondiale. Ces 130 kt ne représentent plus maintenant que 0,05 % des 273 Mt des réserves connues en 2017.
De ce complexe sortent 15 kt/a de sable à 0,9 % de Li et 20 kt/a de roche broyée à 0,5 % de Li, sous-produit valorisé de l'exploitation du kaolin. | |
Source - © 2013 IMERYS CERAMICS FRANCE Les mesures en lithium ont été faites avec des prélèvements à 1 m de profondeur au fond de 345 petits forages. Les teneurs peuvent dépasser 2000 g/t de Li2O (1 kg/t de Li). Le hachuré rouge correspond au granite des Collettes, le hachuré violet au granite de Beauvoir. | Source - © 2012 J.F.Labbé et G.Daw / BRGM, modifié Figure 35. Coupe interprétative du complexe granitique d'Échassières Les ressources importantes de lithium se trouvent au sein du granite de Beauvoir (0,35 % de Li). |
Réflexion sur la notion de réserves
Dans l'industrie minière, la diversité des standards utilisés pour la définition des réserves entraine parfois des confusions, ainsi que des marges d'erreur qu'il s'agit de considérer avec précaution. De même, pour des raisons géopolitiques, certains pays ou certaines institutions peuvent avoir tendance à surestimer leurs réserves.
Ceci étant, le chiffre de 100 Mt Li de réserves est assez partagé et donne une idée générale des réserves de lithium déclarées aujourd'hui.
Les ressources de lithium n'étant pas renouvelables, d'aucuns auront le réflexe de calculer rapidement le ratio [réserves / production annuelle] pour avoir une idée de la date fatidique marquant l'exploitation du dernier gramme de lithium. À en croire ce calcul de coin de table, il semblerait qu'il y ait assez de lithium pour subvenir aux besoins de l'humanité pendant plusieurs centaines d'années.
Mais ce n'est pas aussi simple que cela. En effet, au fur et à mesure que le temps avance et que les réserves de lithium sont exploitées, les paramètres économiques évoluent aussi, de nouvelles découvertes de gisement potentiel sont faites… Le ratio [réserves / production] ne veut donc pas dire grand-chose.
L'exemple du gaz et du pétrole est frappant : l'industrie pétrolière déclare des réserves qui augmentent au moins aussi rapidement que la production. Ainsi, cela fait 10 ans que le ratio [réserves / production annuelle] est d'environ 50 ans (figure ci-dessous). Certes, l'Agence Internationale de l'Énergie vient de déclarer que le pic pétrolier pourrait arriver en 2025 et que le monde devrait s'y préparer. Mais pour en revenir au lithium, gare à ceux qui crient au loup trop vite, qui sait, de nouveaux gisements se cachent peut-être sous nos pieds !
Source - © 2018 D'après BP Statistical Review
Production
Route latino-américaine
Processus “minier”
La première étape de l'exploitation des saumures continentales consiste en leur pompage à la surface. Contrairement à un gisement pétrolier conventionnel où les fluides sous pression remontent assez souvent “naturellement” à la surface en suivant le chemin des pressions décroissantes, il est ici toujours nécessaire d'utiliser des pompes (et donc de dépenser de l'énergie) pour remonter les fluides à la surface.
Évaporation
Une fois la saumure pompée à la surface, elle est épandue pendant plusieurs mois dans des bassins artificiels (visibles depuis l'espace ! Pour une vue d'avion, voir la figure ci-dessous). C'est de loin l'étape la plus longue et la plus contraignante dans le traitement des saumures. Le trop-plein d'eau s'évaporant, la teneur des saumures, qui initialement tourne autour d'une fraction de pourcent (0,16 %), grimpe pour atteindre en général 6 % Li.
Source - © 2015 Ivan Alvarado/Reuters sur International Business Times
Figure 37. Bassins chiliens d'évaporation de saumures
L'environnement joue ici un rôle primordial. Un climat où les précipitations sont faibles et les températures élevées sera privilégié. Ça tombe bien, les salars d'Amérique du Sud à haute altitude présentent généralement ces caractéristiques. Cependant, les conditions météorologiques optimales n'étant pas tout le temps au rendez-vous, les résultats (de production et financier) des industriels présents dans les salars pâtissent parfois des années plus riches en précipitations ou pauvres en ensoleillement.
Précipitation
Durant l'évaporation, et compte tenu de l'enrichissement en ions des solutions épandues, des éléments précipitent. Le chlorure de sodium est le premier d'entre eux (mais celui-ci n'est pas exploité économiquement). Suit le chlorure de potassium qui est le principal produit des mines concernées. Au fur et à mesure de leur précipitation, ces sels sont “moissonnés” à la surface des bassins puis traités.
La concentration en chlorure de lithium des saumures augmente jusqu'à atteindre son optimum (6 % Li).
Filtration
La saumure enrichie est ensuite transférée par pipeline ou par camion dans une usine de transformation (qui peut être située à plusieurs centaines de kilomètres des salars) dans laquelle elle subit plusieurs étapes de filtration pour isoler les impuretés comme le magnésium ou le bore.
Transformation et production de carbonate et d'hydroxyde de lithium
Le chlorure de lithium est attaqué avec une solution de carbonate de sodium (Na2CO3) pour précipiter le carbonate de lithium. L'hydroxyde de lithium est lui préparé par réaction du chlorure de lithium avec de la chaux (Ca(OH)2).
Après une dernière étape de filtration et séchage, le carbonate / hydroxyde de lithium est prêt pour la livraison au client final. En fonction de l'application dans laquelle le carbonate ou l'hydroxyde de lithium sera utilisé, différentes qualités sont attendues. Les batteries requièrent une haute pureté du carbonate ou de l'hydroxyde de lithium.
Source - © 2018 Benchmark Minerals
Couts (financier / environnemental /politique)
Nous l'avons vu, l'exploitation des saumures riches en lithium requiert un certain nombre d'étapes de transformation pour obtenir le produit final (carbonate ou hydroxyde de lithium). À chacune de ces étapes, et comme dans de nombreux processus industriels, la transformation du lithium requiert de l'énergie, de l'eau, du travail humain, de l'espace…
L'eau. Deux sources d'eau sont nécessaires à l'exploitation du lithium dans les saumures : l'eau contenue dans les saumures, d'une part, et l'eau de traitement du minerai, d'autre part. L'eau contenue dans les saumures s'évapore, elle est donc “perdue”. Quant à l'eau de traitement, elle est en général pompée dans un aquifère proche des sites, traitée pour être utilisée dans le process de traitement du lithium. Or, les salars sont par essence dans des zones désertiques ou subdésertiques où l'eau est rare. Mais les hauts sommets des Andes très proches reçoivent de la neige et peuvent donc fournir de l'eau. À la fin du traitement, cette eau est recyclée au maximum. Malgré cela, et du fait qu'une partie de l'eau de traitement est perdue au cours de celui-ci, la transformation du lithium nécessite une source externe d'eau douce permanente. Il n'existe pas de chiffre général de consommation d'eau par unité de lithium produit qui pourrait s'appliquer à tous les projets. Cela dit, l'exemple d'Orocobre, une entreprise minière qui exploite du lithium dans le salar de Olaroz, dans le Nord de l'Argentine, permet de donner un ordre de grandeur : ils annoncent consommer environ 41 m3 d'eau par tonne de lithium produite (eau de traitement uniquement). D'autres sources évoquent des consommations allant jusqu'à 1900 m3 par tonne de lithium produite (500 000 gallons, toutes eaux confondues). Des chiffres à mettre en perspective face aux capacités de production de plusieurs milliers, voire dizaines de milliers de tonnes par an de ces sites industriels. Les États ont mis en place dans leurs codes miniers des quotas pour réguler le prélèvement d'eau dans l'environnement et préserver les communautés locales afin de leur assurer l'accès à l'eau potable. Plusieurs entreprises participent d'ailleurs au financement et à la maintenance des circuits de distribution d'eau potable aux communautés dans les alentours de leur projet.
Cette problématique centrale de l'eau a incité une entreprise minière française à élaborer un processus de traitement qui ne nécessite pas ou très peu d'eau douce externe. Processus qui devrait être testé à l'échelle industrielle dans le courant des années 2020.
L'énergie. La transformation du lithium en produit fini nécessite de l'énergie. Solaire d'abord pour l'évaporation de l'eau des saumures. Puis électrique pour permettre le fonctionnement du site industriel. La même société Orocobre déclare une intensité énergétique (hors solaire) de 2153 kWh/tonne de lithium produit, en amélioration constante. Un élément de comparaison : un habitant français consomme en moyenne 7000 kWh par an.
L'environnement. Comme toute activité industrielle, le risque existe d'un déséquilibre de l'environnement local, avec comme conséquence une atteinte aux personnes et à la biodiversité. Certains membres des communautés locales et certaines associations de protection de l'environnement dénoncent l'apport externe d'eau douce, les rejets parfois mal maitrisés, le développement du transport routier dans des zones sensibles comme les salars. Et, de plus, les lacs salés sont parfois des biotopes très riches.
Le niveau de gouvernance de l'État dans lequel a lieu l'extraction détermine le degré de contrôle sur les activités industrielles, en particulier minière. Ainsi, au Chili, pays traditionnellement minier (premier producteur mondial de cuivre par exemple), le code minier est strict et appliqué. Certes, des négociations ont lieu régulièrement entre les sociétés exploitantes et les instances régulatrices mais il est reconnu que l'application des lois est en général rigoureuse. En Bolivie et en Argentine, il semble que le débat est plus ouvert…
Route sino-australienne
Processus minier et enrichissement australien
L'extraction de lithium à partir des gisements de type “roche”, essentiellement australienne, est un processus minier classique, beaucoup plus court en temps (pas de phase aussi longue que l'évaporation de l'eau des saumures), mais en général plus couteux compte tenu de l'énergie nécessaire tout au long du processus.
La première étape consiste en l'exploitation minière du gisement, à ciel ouvert ou en souterrain. Le terrain est abattu à l'explosif, puis transporté au moyen de pelles et de camions de tailles imposantes (voir ci-dessous, les équipement de la mine de charbon canadienne étant de taille comparable à ceux de Greenbushes) vers l'usine de traitement.
L'usine de traitement reçoit le minerai dont la teneur en Li2O tourne autour de quelques pourcents. Grâce à des étapes successives de concassage, de séparation physique ou chimique, de flottation, le minerai est enrichi jusqu'à atteindre 6 % Li2O (on parle alors de SC6 pour Spodumene Concentrate 6%). Des teneurs de concentrés plus élevées peuvent être atteintes mais sont réservées à des applications plus contraignantes, comme les céramiques.
Source - © 2016 Avec l'aimable autorisation de Talison Lithium | |
Figure 42. Camion minier, mine de charbon, Canada | Figure 43. Chargeuse, mine de charbon, Canada |
Transport jusqu'en Chine – traitement chimique
Le concentré de spodumène à 6 % de Li2O est ensuite traité physiquement et chimiquement pour produire du carbonate ou de l'hydroxyde de lithium. Ce traitement était effectué quasi-exclusivement en Chine jusqu'en 2017. L'intérêt grandissant pour le lithium a poussé certains acteurs à localiser en Australie le traitement du concentré, en développant des usines de transformation du SC6 en produit fini à la sortie même de la mine.
Deux voies d'obtention du carbonate ou de l'hydroxyde de lithium peuvent être distinguées.
Dans la voie acide, le concentré de spodumène est soumis à une température de 1050-1100°C. Durant la calcination, le spodumène subit un changement de phase, de la phase α à la phase β. Étant donné la différence de masse volumique des deux phases (3,2 pour la phase α contre 2,35 pour la phase β – soit 27 % de différence), les grains de matière éclatent, on parle de décrépitation, entrainant une hausse significative de la surface de contact potentielle, et par voie de conséquence une amélioration significative du traitement chimique qui suit. Les grains éclatés sont attaqués à l'acide sulfurique concentré à 95-97 %, le mélange est soumis à nouveau à des températures de ~200°C. Passé 170°C, une réaction exothermique a lieu, le lithium est extrait des minéraux de spodumène, on obtient du sulfate de lithium, soluble dans l'eau. Refroidi autour de 90-100°C, le mélange est traité à l'eau chaude pour en extraire la pulpe qui est filtrée pour en retirer les impuretés (Mg, Fe, Al, Ca…). Enfin, l'ajout de carbonate de sodium permet la précipitation du carbonate de lithium.
Dans la voie basique, la calcination initiale est effectuée en présence de chaux, ce qui résulte en la formation de silicate de calcium et d'oxyde de lithium. Une lixiviation à l'eau chaude permet la cristallisation d'hydroxyde de lithium, finalement séché.
Formes finales du lithium
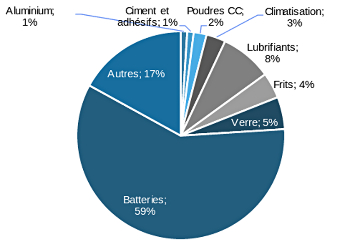
Le lithium est utilisé depuis longtemps dans de nombreuses applications industrielles. En 2017, la demande était répartie comme le montre la figure suivante, les systèmes de stockage électrochimiques de l'électricité occupant une place de plus en plus importante dans le “mix” de la demande mondiale.
Source - © 2018 D'après données SQM
Ces différentes applications n'appellent pas forcément les mêmes produits finis de lithium. On en distingue trois principaux qui sont détaillés ci-après : le carbonate de lithium, l'hydroxyde de lithium, et le lithium métal.
- Le carbonate de lithium est, par exemple, utilisé dans l'industrie du verre (baisse de la température de fusion et amélioration de la résistance physique), dans les céramiques (abaissement du point de fusion), le raffinage de l'aluminium (une fois encore, abaissement du point de fusion, car le carbonate de lithium abaisse la température de fusion de l'alumine, ce qui se faisait avant avec de la cryolite Na3AlF6 dont l'utilisation entrainait la libération de di-fluor, gaz très irritant et réactif) et la construction.
- L'hydroxyde de lithium, quant à lui, est utilisé dans les lubrifiants (le lithium agit comme un “savon” métallique lorsqu'il a réagi avec un acide gras) ou dans les colorants. On utilise pour les batteries les deux formes, carbonate et hydroxyde de lithium.
- Le lithium métal est, lui, utilisé en pharmacie (dans la lutte contre les troubles bipolaires), dans certaines industries chimiques très spécifiques (nucléaire militaire avec la bombe H ou civil avec le projet ITER).
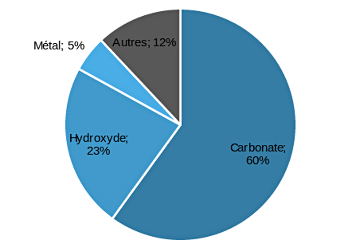
La répartition des produits finis de lithium en 2017 par type de produit fini est présentée dans la figure ci-dessous. Le carbonate de lithium est de loin le produit fini le plus répandu parmi les différentes applications du lithium dans l'industrie, suivi par l'hydroxyde de lithium et le lithium métal. Les autres formes de produits finis sont, chacune à leur place, assez peu significatives. On y trouve le chlorure de lithium (utilisé notamment pour obtenir la couleur rouge des feux d'artifices et des fumigènes, ou encore dans la préparation de nanotubes de carbone), et le butyl-lithium utilisé dans l'industrie chimique des polymères.
Source - © 2018 D'après données SQM
Carbonate et hydroxyde de lithium dans les batteries
Les trois formes principales, carbonate, hydroxyde et métal, sont utilisées dans les batteries.
- Dans les matériaux de cathode des batteries rechargeables, on utilise les carbonate et hydroxyde de lithium. Le matériau de cathode est en fait un oxyde de lithium, cobalt, manganèse, aluminium, fer-phosphate et nickel dans différentes proportions. Tous nos équipements électroniques (téléphones, tablettes…) ont des batteries LCO (lithium cobalt). Les voitures électriques ont des batteries NMC (nickel manganèse cobalt), NCA (nickel cobalt aluminium – c'est le cas des véhicules de marque Tesla), ou LFP (lithium fer phosphate). Dans chacun de ces matériaux de cathode, on trouve du lithium. Ainsi, un téléphone contient entre 2 et 3 grammes-équivalent de carbonate de lithium, une perceuse électrique en contient 40 à 60 g, un véhicule 100 % électrique en contient entre 10 et 63 kg, soit 2 à 10 kg de lithium.
- Dans les batteries primaires (non rechargeables – les petites piles disponibles en supermarché), on utilise du lithium métal.
Aujourd'hui, on l'a vu dans le paragraphe précédent, le carbonate de lithium est la forme prépondérante de produit fini du lithium. Deux conditions expliquent cette prépondérance : d'abord, il est l'ingrédient de choix pour la manufacture des matériaux de cathode des batteries traditionnelles (les LCO de nos portables, les anciennes générations de NMC relativement riches en Mn et Co). Ensuite, il est facilement obtenu à partir des saumures sud-américaines.
Un mouvement intéressant de remplacement graduel du carbonate par l'hydroxyde de lithium pointe à l'horizon. Dans les dernières générations de batteries rechargeables utilisées dans les modèles de véhicules électriques les plus récents, le matériau de cathode est de plus en plus riche en nickel, et de moins en moins en cobalt. On est passé d'une chimie NMC 111 – nickel, manganèse et cobalt à parts égales – à des chimies NMC 622 puis NMC 811 – 8 nickel pour 1 manganèse et 1 cobalt. Or, lorsque le contenu en nickel atteint et dépasse 60 % dans le matériel de cathode, la température nécessaire pour synthétiser l'oxyde augmente elle aussi, d'autant plus avec le carbonate de lithium qu'avec l'hydroxyde de lithium, entrainant des dommages sur la structure cristallographique de l'oxyde, un changement du niveau d'oxydation du nickel et une baisse significative de ses performances. L'hydroxyde de lithium permet, quant à lui, une synthèse du matériau de cathode à plus basse température et plus rapide, évitant les complications liées à l'utilisation du carbonate de lithium. Ainsi, pour produire les dernières générations de batteries, l'hydroxyde de lithium est déjà et sera privilégié.
Conséquences géopolitique et économique directes : quand le carbonate est facilement obtenu à partir des saumures (Amérique du Sud privilégiée), l'hydroxyde est lui plus facilement obtenu à partir des gisements de spodumène (bienvenue en Australie). Le basculement de l'utilisation des carbonates vers l'utilisation de l'hydroxyde risque d'entrainer un rééquilibrage des forces en présence, en engageant une “bataille” industrielle entre l'Amérique du Sud et l'Australie. Affaire à suivre…
Le lithium et la fusion nucléaire
Produire de l'énergie par des réactions de fusion nucléaire contrôlée est un vieux rêve de l'humanité, du moins celle qui souhaite que la croissance exponentielle ne s'arrête jamais. Essayer de maitriser cette fusion et d'en extraire de l'énergie est le but du prototype expérimental ITER. Les “vulgarisateurs” parlent de reproduire un « Soleil en laboratoire ». Du point de vue de la physique nucléaire, cette expression est une erreur. Pour simplifier, la réaction nucléaire qui se passe dans le cœur des étoiles peut s'écrire 4 1H → 4He + énergie. La seule réaction actuellement envisageable (et non encore maitrisée) n'est pas celle qui se fait dans le Soleil. Il s'agit de la réaction 2H + 3H → 4He + 1n + énergie (deutérium + tritium → hélium 4 + neutron + énergie). Le problème est que si le deutérium se trouve dans la nature (33 g/m3 d'eau de mer), le tritium n'existe pas dans la nature, et il faut le fabriquer. Or, l'une des principales voix de synthèse du tritium utilise du lithium, comme par exemple la réaction 6Li + 1n → 4He + 3H.
Après avoir servi au stockage de l'énergie, le lithium servira peut-être à sa production.
Références
Liens consultés le 27 mars 2019.
Argus, 2019. Lithium hydroxyde demand to overtake carbonate: AABC, sur argusmedia.com
D.C. Bradley, L.L. Stillings, B.W. Jaskula, L. Munk, A.D. McCauley, 2017. Lithium, in Schulz, DeYoung, Seal, Bradley (éditeurs), Critical mineral resources of the United States—Economic and environmental geology and prospects for future supply, U.S. Geological Survey Professional Paper 1802
T. Cabral, 2018. Booming electric car sales drive lithium rush in Portugal, sur phys.org/
P. Epstein, 2017. Will New Technologies Replace Lithium Brine Solar Evaporation Ponds? sur epsteinresearch.com
Eramet, 2016. Processus d'extraction directe du lithium, sur eramet.com
R.K. Evans, 2008. An abundance of lithium, sur citeseerx.ist.psu.edu
GeoConsultancy Ltd, 2016. Greenbushes, sur portergeo.com.au
M. Hocking, J. Kan, P. Young, C., Terry, D. Begleiter, 2016. Lithium 101 - Welcome to the Lithium-ion age, Deutsche Bank Market Research, sur slideshare.net
IMERYS Ceramics France, 2013. Demande de permis exclusif de recherches de mines, dit « permis de Beauvoir » – Pour lithium, étain, tantale, niobium,tungstène, beryllium et connexes, 198p.
InvestorIntel, 2015. Lithium in Australia – the Tortoise Takes Flight, sur investorintel.com
D. Jimenez, 2018. Lithium market outlook, sur sqm.com
X. Jing, S. Fernandez, 2016. Tossed aside in the 'white gold' rush, Washington Post
A. Khalip, S. Goncalves, 2018. Exclusive: Portugal to launch tender of lithium exploration licenses this year, Reuters
J.F.Labbé, G.Daw, 2012. Panorama 2011du marché du lithium, Rapport public. BRGM/RP-61340-FR, 154p., 51fig., 29tab.
L'élementarium, 2019. Lithium – fiche complète sur lelementarium.fr
B. Leni, 2017. The lithium supply and demand story, sur mining.com
P. Lima, 2011. Lithium : la ruée vers l'or blanc, Le Figaro
Lithium Today, 2017, Lithium supply in China, sur lithium.today
A. Loquet, 2014. Corruption, pollution, consommation : les ravages du lithium en Argentine, sur reporterre.net
Orocobre, 2018. 2017 Sustainability report
SGS Mineral Services, 2010. Hard rock lithium processing, sur sgs.com
M.T. Sweetapple, 2017. A review of the setting and internal characteristics of lithium pegmatite systems of the Archean North Pilbara and Yilgarn cratons, Western Australia, Granites2017@Benalla – Extended Abstracts Bulletin n°65, Australian Institute of Geoscientists
[1] La Norvège s'est engagé à bannir les ventes de véhicules à moteur à combustion interne dès 2025 ; l'Irlande, les Pays-Bas et la Slovénie en 2030 ; l'Ecosse en 2032 ; le Royaume-Uni et la France en 2040. Le Sri Lanka et la Suède se sont même engagé à avoir une flotte vierge de véhicule à moteur à combustion interne d'ici 2040 et 2045 respectivement.
[2] Encore faut-il le prouver. L'utilisation d'un véhicule électrique sur plusieurs années permet-elle de réduire significativement les émissions de GES ? Cette question seule pourrait faire l'objet d'un article complet, ce n'est pas l'objet ici.
[3] Ceci est susceptible de changer. Cependant, les technologies alternatives (au sodium, à l'air…) ne proposent aujourd'hui pas de performance équivalente à la traditionnelle batterie lithium. Plusieurs années passeront sans qu'un remplacement de cette dernière soit significatif.






















![Ratio [Réserves / Production] pour le pétrole, au niveau mondial sur la période 1980-2017](https://planet-terre.ens-lyon.fr/planetterre/objets/Images/lithium-or-blanc/lithium-or-blanc-36-br.jpg)