Article | 23/02/2001
Changements de phases du soufre, analogie avec le métamorphisme
23/02/2001
Résumé
Utilisation du soufre pour réaliser des expériences permettant de comprendre le métamorphisme.
Table des matières
Introduction
Il existe plusieurs phases solides et liquides du soufre, permettant au moins deux types de manipulations simples et intéressantes pour montrer ce qu'est un changement minéralogique à l'état solide, ce qui est la définition du métamorphisme. Ces changements se font à pression constante (atmosphérique) ce qui est donc facile à réaliser en classe.
La théorie des transitions de phases du soufre
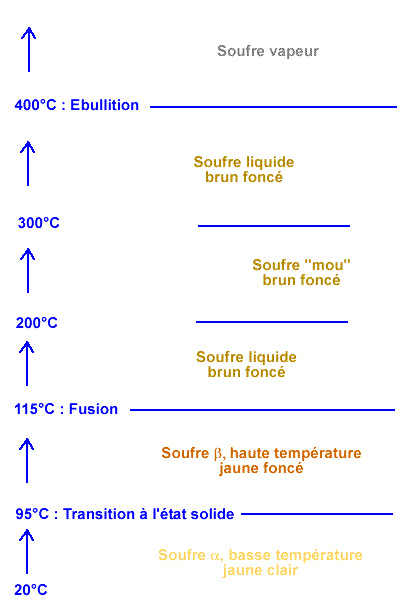
À pression atmosphérique, le soufre solide existe sous 2 phases cristallines différentes :
- la phase dite α, de basse température, cristallisant dans le système orthorhombique et formant des cristaux en forme de plaquettes ou de prismes assez massifs, et de couleur jaune clair ;
- la forme dite β, de haute température, cristallisant dans le système monoclinique et formant des cristaux en aiguilles, de couleur jaune assez foncé.
La transition de phase α→β se fait à environ 95,5°C, alors que le soufre fond aux environs de 115°C (ces 2 valeurs correspondent à une pression de 1 atmosphère). Quand du soufre cristallise à partir du liquide (à 115°C en général), il cristallise toujours la forme β, de haute température (même en cas de surfusion et de cristallisation à une température <115°C, voir plus loin). En se refroidissant, ce soufre β va devenir soufre α (réaction de changement de phase, de métamorphisme due à une baisse de température) mais relativement lentement du fait de la cinétique de la réaction. De nombreux problèmes d'interprétation viennent de cette lenteur.
La fusion du soufre donne un liquide orange foncé, très fluide à la température de 115°C. Si on continue à chauffer, vers 200°C, ce soufre très fluide devient brun foncé et pâteux. On appelle cette nouvelle variété du "soufre mou". Ce soufre mou résulte de la polymérisation des atomes, et est constitué de macromolécules S-S-S-S-. À partir de 300°C, il redevient très fluide, pour bouillir vers 400°C. Si on refroidit du soufre liquide initialement à 400°C, on observe les mêmes transitions, dans l'ordre inverse. En particulier, le soufre liquide devient soufre mou à partir de 300°C, puis devient fluide vers 200°C, pour cristalliser à 115°C.
Les changements de phases à basses températures
Dans un creuset
Le soufre, une fois solidifié, forme une surface lisse, de couleur homogène et jaune assez foncé à brun. C'est du soufre β. Une fois le refroidissement effectué (en quelques dizaines de minutes), rien ne se passe. La transition β → α qui aurait dû se faire a du retard. Puis, au bout de quelques heures, on voit apparaître sur la surface jaune foncée des taches plus ou moins circulaires jaunes clair : du soufre α apparaît.
Figure 2. Creuset avec soufre cristallisé, t=0 Soufre β brun sur toute la surface. | Figure 3. Creuset avec soufre cristallisé, t~1 h Quelques taches de soufre α jaune clair apparaissent. | Figure 4. Creuset avec soufre cristallisé, t~2 h Les taches de soufre α se développent. |
Figure 5. Creuset avec soufre cristallisé, t~3 h Les taches de soufre α se développent. | Figure 6. Creuset avec soufre β brun cristallisé, t~4 h Les taches de soufre α se développent, la progression est lente. | Figure 7. Creuset avec soufre β brun cristallisé, t~5 h Le soufre α recouvre une grande partie de la surface... mais du soufre β est encore présent au bout de 6 h. |
Au cours du temps, ces taches de soufre α grandissent, et en 1 à 2 jours, quasi-totalité de la surface est devenue jaune clair. Le changement de phase et la recristallisation en phase α commencent au niveau de germes de cristallisation, qui peuvent être soit des impuretés, soit une zone choquée.
Si par exemple on choque avec un agitateur un point particulier de la surface, c'est souvent à ce niveau que débutera le changement α → β et l'apparition de la tache jaune clair. Les réactions de recristallisation étant accélérées par la température, cette transformation va d'autant plus vite que cette température est élevée, tout en restant évidement inférieure à 95° (température de changement de phase). Si, donc, on laisse le creuset sur une plaque chauffante réglée "tiède" (60°C par exemple), la transformation α → β se fait beaucoup plus rapidement et est parfaitement visible dans le laps de temps d'une séance de TP.
Entre lame et lamelle
On fait cristalliser une goutte de soufre en lame et lamelle. Quand on observe au microscope ce soufre récemment cristallisé, on observe de superbes aiguilles de soufre β. Si on attend quelques heures à quelques jours, on voit que chaque aiguille se transforme en une mosaïque de petites plaquettes de soufre α.
Figure 8. Lame de soufre β (Grossissement x 5) | Figure 9. Lame de soufre α (Grossissement x 5) |
Figure 10. Lames montrant la transformation incomplète de soufre β en soufre α Il ne reste que une ou deux aiguilles de soufre β à gauche de l'image. (Grossissement x 10) | Figure 11. Lames montrant la transformation incomplète de soufre β en soufre α Une heure plus tard, l'aiguille de soufre β à gauche est entièrement transformée en agrégat de plaquettes de soufre α. On devine la trace fantôme de l'ancienne aiguille β. (Grossissement x 10) |
On peut, pour noter le changement, soit comparer ce néo-soufre α avec du soufre β récemment fait, soit photographier une zone précise de la lame et regarder cette même zone quelques jours plus tard.
Les problèmes dus à la surfusion et à la cinétique chimique
La surfusion
C'est un phénomène physique fréquent : un liquide ne gèle pas en se refroidissant, même s'il devient plus froid que sa température théorique de cristallisation.
Ce phénomène arrive très souvent dans la nature, par exemple dans les nuages, et est a l'origine de la grêle. Quand un nuage a une température inféreiure à 0°C, les fines gouttelettes d'eau du nuages gèlent et il neige. Mais parfois, bien que le nuage se refroidissent sous 0°C, les gouttelettes restent liquides, bien qu'à une température inférieure à 0°C. Quand finalement une première gouttelette gèle, elle va, en tombant, rencontrer d'autres gouttelettes surfondues. Au contact du cristal de glace issu de la première gouttelette gelée, toutes les nouvelles gouttelettes surfondues rencontrées vont geler à leur tour, grossir le premier cristal qui s'entourera d'une couche de glace… Au cours de sa traversée en descente du nuage, ce premier cristal va devenir un grêlon de glace (et non pas un flocon de neige) qui peut atteindre des dimensions considérables (plusieurs centaines de grammes), parce qu'il grossit très vite en croisant et capturant ces gouttes surfondues.
Souvent, en particulier entre lame et lamelle, le soufre reste surfondu, et il ne cristallise qu'à une température basse, inférieure à 115°C, et même inférieure à la température de changement de phase (95°C). Mais malgré cette cristallisation à basse température, il cristallise des aiguilles, forme β de haute température.
La cinétique de réaction
La réaction β → α est une réaction lente. Si on chauffe (en restant en dessous de 95°C), on accélère la réaction. Entre lame et lamelle, il faut souvent plusieurs jours pour que la réaction β → α se fasse. Mais si on place lame et lamelle dans une étuve vers 60 à 80°C, la réaction se fait en quelques heures.
Le couplage surfusion/cinétique
Cette association surfusion/cinétique peut être à l'origine de "canulars". À cause de la surfusion, le soufre liquide peut cristalliser à relativement basse température (on peut tenir la lame à la main), et on pourrait croire que l'on obtient la forme a de basse température, alors que l'on obtient malgré tout la forme haute température.
En chauffant dans une étuve, on observe un changement de phase (que l'on observait pas sans chauffer, faute d'attendre assez longtemps). On pourrait alors penser ce changement de phase observé, puisqu'on chauffe, est une transition basse température → haute température, alors que c'est le contraire ! En effet, ce qu'on observe, c'est le changement haute température → basse température, que l'on a accéléré en chauffant.
Faire cette manipulation en utilisant une étuve pour accélérer la réaction peut être pédagogiquement dangereux, car il faut expliquer à des élèves qui ne dominent pas les notions de cinétique chimique que l'on obtient la phase basse température en… chauffant !
Les changements de phases à hautes températures
Si on verse du soufre mou dans de l'eau froide, un phénomène de trempe se produit et le soufre refroidi reste mou et macromoléculaire pendant quelques minutes, au lieu de devenir instantanément soufre α basse température. Il y a là aussi un retard dans la cinétique de la réaction soufre mou → soufre α.
Source - © 2001 Pierre Thomas / Planet-Terre - ENS de Lyon
Transition de phase du soufre mou.
Troisième et quatrième expériences du film, à partir de 3min15s environ.
Ce soufre mou refroidi a alors un comportement voisin de celui d'un chewing-gum. Avec un retard de quelques minutes, ce soufre mou, de couleur brun foncé, se transforme directement en soufre α de basse température : il redevient jaune pâle et cassant. On accélère cette transformation en malaxant le soufre mou entre ses doigts. En effet, ce malaxage rompt les macromolécules S-S-S-S…, et il se forme directement et en accéléré le soufre α ordinaire.
C'est là une manière de montrer que les déformations, agent de rupture de liaison atomique, accélèrent la vitesse des réactions métamorphiques, ce que montre bien l'étude des chaînes de montagnes.
Figure 12. Granulite (grenat, plagioclases et pyroxènes) traversée par une zone de déformation en son milieu Au niveau de la déformation, la granulite est devenue partiellement schiste vert (plagioclases partiellement transformés en chlorite et épidote -minéraux verts-) et, ce, uniquement dans la zone déformée. Granulite du Val Strona, Italie. | Figure 13. Gabbro océanique ayant subi la subduction alpine La déformation a été hétérogène et n'a affecté que le bas de l'échantillon. La partie non déformée a gardé les minéraux initiaux du gabbro (plagioclases et pyroxènes). Dans la partie déformée, les pyroxènes sont devenus glaucophanes (faciès schiste bleu). Métagabbro du Queyras, Hautes Alpes. |