Article | 10/12/2008
Sélection naturelle, VIH, pinsons : ce que Darwin ne pouvait pas savoir
10/12/2008
Résumé
Le VIH (virus du SIDA) et les pinsons des Galapagos : exemples concrets de sélection naturelle.
Table des matières
Ce texte a été relu et validé par Ludovic Orlando (IGFL, équipe Paléogénétique et évolution moléculaire, CNRS-ENS de Lyon).
En 2009, nous fêterons les deux cent ans de la naissance de Charles Darwin, et les cent cinquante ans de la parution de son ouvrage fondateur De l'Origine des Espèces. Afin de soutenir ses idées révolutionnaires sur l'évolution, Darwin s'est appuyé sur une masse de données d'observation gigantesque (collectées entre autres lors de son voyage autour du monde à bord du navire britannique HMS Beagle, 1), mais il ne connaissait ni l'origine des variations phénotypiques, ni le support de l'hérédité. Avec les progrès de la science et la découverte des acides nucléiques 2) comme support de l'hérédité (3), nous pouvons aujourd'hui aller beaucoup plus loin que Darwin dans l'analyse des mécanismes qui sous-tendent la sélection naturelle et l'évolution des êtres vivants. C'est ce que nous nous proposons de faire en nous intéressant aux exemples du virus de l'immunodéficience humaine (VIH) et des pinsons des îles Galapagos.
Le VIH
Le VIH (4) est un rétrovirus qui infecte et tue les cellules immunitaires (plus particulièrement les lymphocytes T cd4+), rendant les porteurs vulnérables aux maladies opportunistes. Il a été identifié en 1983 par l'équipe du professeur Luc Montagnier de L'institut Pasteur (découverte récompensée par le prix Nobel de médecine 2008 partagé avec Françoise Barré-Sinoussi mais sans Jean-Claude Chermann) (5), et cause l'épidémie de SIDA qui touche le monde entier depuis la fin des années 1980. Ce virus est caractérisé par un taux de mutation très élevé (3.10-5 substitutions/site/génération, 6), ce qui lui confère d'importantes capacités d'adaptation. Le cycle viral comprend plusieurs étapes clefs (7), l'entrée dans la cellule hôte et la retrotranscription étant les cibles les plus fréquentes des thérapies anti-VIH.
L'entrée du virus dans la cellule hôte implique la protéine d'enveloppe virale env. La région du génome viral codant cette protéine est utilisée pour discriminer les différents variants viraux. L'analyse de cette région chez de multiples patients indique l'existence d'une grande diversité des variants viraux, chaque patient étant infecté par un variant différent (figure 1). Chez un même patient plusieurs souches virales peuvent aussi coexister, en compétition les unes avec les autres ; de plus, au cours de la progression de la maladie, les souches virales sont répliquées, mais pas toujours de manière fidèle, entraînant l'apparition de souches plus ou moins divergentes les unes des autres : sur la figure 2, le cas du patient K a été développé, montrant clairement une augmentation de la diversité virale après l'infection. Cette augmentation est corrélée avec une amélioration de la survie du virus (échappement au système immunitaire) et de sa capacité de réplication (8).
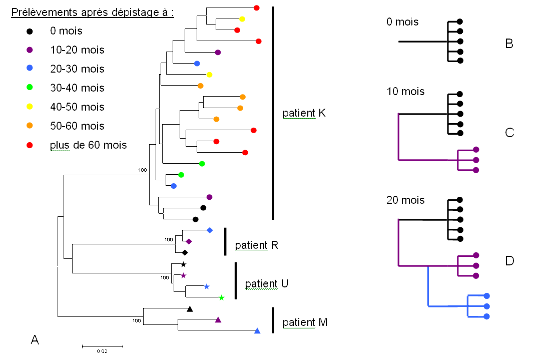
Figure 1. Diversité du VIH entre patients et au sein d'un même patient
A- Arbre phylogénétique simplifié construit à partir des séquences de variants viraux de 4 patients (K, R, U et M), à différents moments après le dépistage. Chaque patient possède des variants viraux qui lui sont propres, et chez un même patient plusieurs variants coexistent. pour plus d'information, voir figure 2.
B, C, D- Arbres théoriques obtenus pour un patient X au moment du dépistage (B), 10 mois après (C) et 20 mois après (D). Pour le patient K de la partie A, cet ordre théorique n'est pas matérialisé sur l'arbre, la proximité génétique des différents variants apparus ne permettant pas l'obtention d'une topologie soutenue.
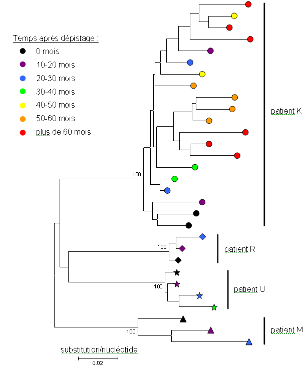
Figure 2. Diversité du VIH entre patients
Chaque patient possède des variants viraux qui lui sont propres, comme en atteste le regroupement des séquences par individu, soutenu par des valeurs de bootstrap maximales (les bootstraps signent la robustesse de la monophylie à un nœud). Plusieurs variants coexistent chez un patient à un instant donné, mais par soucis de simplicité, cette propriété n'a été illustrée que pour le patient K. Au cours du temps, de nouveaux variants apparaissent, certains étant plus efficaces et remplaçant ceux préexistants. Les derniers variants apparus possèdent les séquences les plus divergentes, comme en atteste la longueur des branches qui augmente avec le temps post-infection. Cet arbre phylogénétique a été obtenu par la méthode de Neighbour Joining à partir de 403 pb de la région env de l'ADN viral. Il a été généré grâce au logiciel MEGA à partir d'un sous-ensemble du jeu de données de la référence 8.
Cette extraordinaire variabilité du VIH est liée à son cycle de réplication très rapide (108 à 109 virions peuvent être produits chaque jour, 9) et à son taux de mutation et de recombinaison élevé (6). Au cours de la réplication, le VIH mute et de nouveaux variants dérivés apparaissent. Dans un environnement donné, les mutations qui apparaissent peuvent avoir trois types de conséquences (figure 3) :
- (i) la plupart des mutations sont délétères (dans le sens où elles conduisent à l'inactivation de gènes codant pour des protéines importantes du cycle viral, 10), les variants qui les portent sont donc rapidement éliminés par la sélection naturelle, faute de pouvoir à leur tour se multiplier ;
- (ii) certaines mutations sont bénéfiques, conférant un avantage (en terme de survie ou de reproduction) aux variants qui les portent, qui deviennent dominants dans la population ;
- (iii) d'autres mutations n'ont pas de conséquences et ne sont donc pas soumises à la sélection. Une modification de l'environnement (suite à la prise de molécules à effet thérapeutique) peut néanmoins changer la donne.
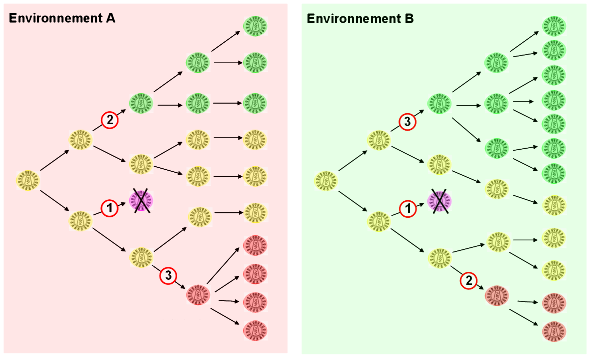
Figure 3. Effets de mutations et rôle de l'environnement
Les mutations du VIH peuvent avoir trois types d'effets. (1) Délétère : le variant affecté est contre-sélectionné et disparaît. (2) Neutre : le variant est différent au niveau génétique mais se comporte de la même façon que la souche mère dans l'environnement au sein duquel il apparaît. (3) Bénéfique : le variant est favorisé (meilleure capacité à combattre le système immunitaire du patient et donc à s'y multiplier) et se répand dans la population. L'effet d'une mutation est dépendant de l'environnement dans lequel elle apparaît : le variant rouge est favorisé dans l'environnement A mais pas dans le B, et inversement pour le variant vert. Pour une vision plus générale, consulter la figure 4.
Prenons l'exemple des traitements anti-rétroviraux visant l'étape de rétrotranscription, qui consistent à inhiber l'enzyme virale transcriptase reverse grâce à des analogues de nucléotides (INTI). Au début d'un traitement par un INTI, les souches infectant l'hôte sont sensibles à la molécule, qui freine leur réplication. Au cours des cycles de réplication de nouveaux variants apparaissent rapidement par mutation, certains étant par hasard résistants à cet INTI (11, 12, 13). Ces derniers ont un avantage et deviennent majoritaires dans la population virale. Néanmoins, en cas d'arrêt du traitement, la souche mutée perd son avantage. Dans certains cas même, la souche mutée résistante à un INTI est aussi plus sensible à d'autres INTI, ce qui la rend vulnérable à un changement d'environnement (11 ; voir aussi figure 4). C'est pour cette raison que l'emploi couplé de plusieurs anti-rétroviraux s'est généralisé dans la lutte anti-VIH, donnant naissance aux trithérapies (14).
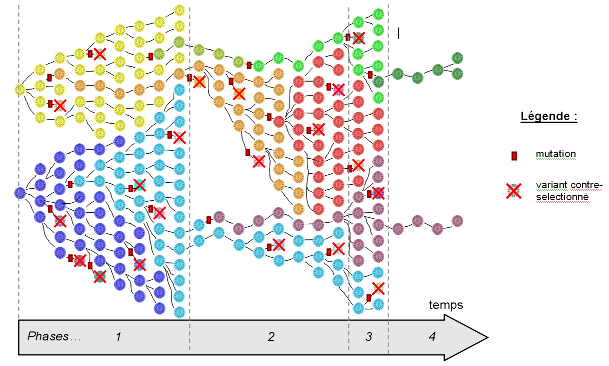
Figure 4. Évolution schématisée du VIH chez un patient au cours du temps
Les générations de virus se succèdent de gauche à droite, depuis l'infection du patient. De nouveaux variants apparaissent par mutation et chaque variant est caractérisé par une couleur sur le schéma. Cette figure doit être analysée séquentiellement pour une bonne compréhension. La phase 1 correspond à une phase d'expansion virale et de nombreuses mutations apparaissent chez les 2 souches qui ont infecté le patient au départ : la majorité sont délétères (les variants correspondants sont contre-sélectionnés), certaines sont neutres (exemple des variants orange et vert clair) et d'autres sont favorables (exemple du variant bleu clair qui remplace le variant bleu foncé). La phase 2 correspond à un changement d'environnement, le patient subissant alors un traitement anti-rétroviral à base d'AZT : certains variants disparaissent car ils sont incapables de survivre en présence d'AZT (exemple du variant jaune), certains subsistent mais se multiplient lentement (exemple des variants bleu clair et vert clair), d'autres sont favorisés car ils sont capables de se répliquer en présence d'AZT (exemple du variant orange qui devient majoritaire). Durant cette phase, le virus continue à muter et de nouveaux variants apparaissent ; à noter la mutation du variant orange, faisant apparaître une souche rouge encore plus résistante à l'AZT et qui devient à son tour dominante. La phase 3 correspond à un arrêt du traitement AZT. Dans ce nouvel environnement, la souche rouge est moins compétitive que les souches violette et verte qui se multiplient plus rapidement sans AZT, et perd son caractère majoritaire. Enfin la phase 4 correspond au début d'une trithérapie : seules 2 souches survivent, mais elles sont incapables de se répliquer rapidement et sont maintenus à un niveau basal.
Le VIH est un fléau qui a tué plus de trente millions de personnes (15) depuis sa découverte en 1983 (5), et malgré l'apparition de nouvelles approches thérapeutiques comme les trithérapies (14), aucun traitement définitif n'existe encore. Espérons que les nouvelles pistes de vaccination porteront leurs fruits (16). En tout cas, les effets des mutations et de la sélection sont visibles à une échelle de temps réduite chez le VIH (quelques années voir quelques mois), comme quoi en évolution, tout n'est pas affaire de fossiles et de millions d'années. Si la sélection est particulièrement évidente chez le VIH, c'est qu'il s'agit d'un organisme relativement simple et à multiplication rapide. Mais la sélection peut aussi être détectable sur des périodes plus longues et pour des organismes plus complexes, comme par exemple les pinsons des îles Galapagos.
Les pinsons des îles Galapagos
L'exemple de l'émergence et du développement de souches VIH-1 résistantes met donc en lumière un effet sélectif détectable sur une courte échelle de temps, grâce aux capacités réplicatives importantes de ce type de virus.
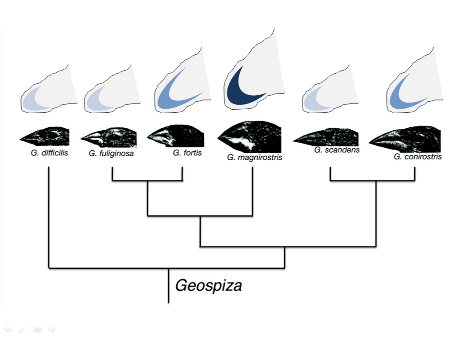
Cependant, des événements de sélection « naturelle » ont aussi été observés à des échelles de temps plus grandes et chez des organismes complexes. Un des exemples les plus classiques et sans doute le plus symbolique du travail de Darwin est celui des pinsons des îles Galapagos (17). Bien que le cas de ces oiseaux ne l'ait sans doute pas inspiré au départ pour sa théorie de l'évolution par la sélection naturelle, il a par la suite grandement alimenté ses réflexions, notamment concernant l'origine des espèces : la spéciation. En effet, les îles Galapagos abritent treize espèces différentes de pinsons appartenant à quatre genres (Geospiza, Camarhynchus, Certhidea, Pinaroloxias), qui se différencient par la taille de leur corps, ainsi que par la forme et la taille de leur bec. Ces trois caractères, et notamment la taille du bec, présentent une grande héritabilité d'une génération à la suivante (entre les parents et leur progéniture), comme l'ont montré certains travaux depuis les années 1980 (18, 19).
Peter et Rosemary Grant ont suivi l'évolution sur trente ans des populations de pinsons sur l'île de Daphne Major (20) et ont pu détecter sur cette période des événements sélectifs importants affectant différentiellement les deux espèces étudiées (G. fortis et G. spinoza). Ces épisodes de sélection ont pu être mis en évidence par la mesure annuelle de la moyenne de trois paramètres quantifiables et héritables chez les pinsons (la taille du corps, la taille et la forme du bec), et ont été corrélés à des variations des conditions environnementales. Par exemple, la fin des années 1970 a été marquée par une sécheresse importante sur l'île de Daphne Major, qui a coïncidé avec sélection très forte chez l'espèce G. fortis, favorisant les individus à gros bec. Chez cette espèce, la consommation de petites graines est préférée quand celles-ci sont abondantes, alors qu'en cas de sécheresse ce type de graine est plus rare et la consommation de graines plus grosses, accessibles uniquement aux individus à gros bec, est favorisée. L'épisode de sécheresse, en causant la raréfaction des graines de petite taille, a entraîné une mortalité plus importante chez les individus deG. fortis à petit bec, ce qui a déplacé l'équilibre de la population vers les individus à gros bec. En effet, ces individus, en bénéficiant de la manne des graines de grande taille, ont survécu en plus grand nombre que les individus à petit bec, et se sont donc en moyenne plus reproduits, ce qui a entraîné un déplacement de caractère à la génération suivante.
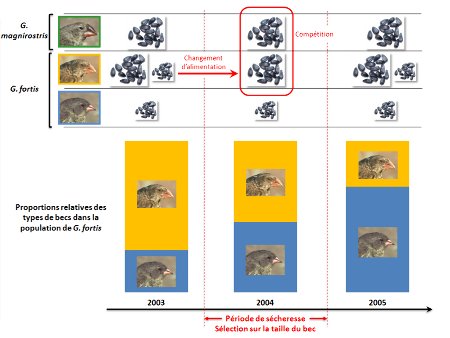
Comme l'exemple du VIH-1 l'avait déjà montré, les événements de sélection « naturelle » sont donc intimement liés aux modifications de l'environnement. De même, comme c'est le cas pour le virus du SIDA, d'autres études (21) ont indiqué que, chez les pinsons, un caractère bénéfique dans certaines conditions peut être contre-sélectionné dans d'autres. De cette façon, un autre événement de sécheresse sur l'île de Daphne Major a entraîné en 2004 une contre-sélection significative des individus de G. fortis à gros bec, représentant une situation exactement contraire à celle des années 1970. L'explication de ce phénomène tient à la colonisation de l'île en 1983 par une autre espèce de pinsons dont les individus sont plus imposants et présentent un bec plus gros que ceux de G. fortis : l'espèce G. magnirostris. Chez cette dernière, l'alimentation consiste quasi-uniquement en la consommation de graines de grosse taille, ce qui ne présente pas un problème pour les individus G. fortis en conditions normales, puisque la disponibilité en graines est suffisante pour approvisionner les deux espèces. En revanche, en période de sécheresse, la pénurie en graines induit une compétition directe pour les graines de grande taille entre les individus G. fortis à gros bec et les pinsons de l'espèce G. magnirostris. Cette compétition se fait au détriment des oiseaux de l'espèce la plus petite et résulte donc en une importante mortalité chez ceux-ci. Parallèlement, si les individus G. fortis à petit bec ne peuvent bénéficier des graines de grande taille, il a été montré que la consommation d'autres types de graines leur conférait une capacité de survie supérieure à celle des individus à gros bec, expliquant la sélection observée en 2004 (figure 5).
Le panneau supérieur représente le régime alimentaire (graines de petite et/ou de grande tailles) des trois populations de pinsons au cours des trois années. Le graphe inférieur représente les proportions relatives d'individus à gros bec et d'individus à petit bec dans la population de Geospiza fortis, en 2003, 2004 et 2005.
Les travaux réalisés sur les pinsons de Darwin aux îles Galapagos ont permis de montrer que des événements de sélection naturelle peuvent être détectés à une échelle de temps relativement courte sur des organismes complexes, et que ces épisodes de sélection sont intimement corrélés aux variations des conditions environnementales et à l'interaction avec d'autres espèces.
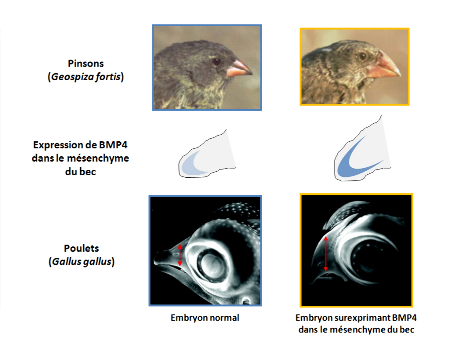
Les deux exemples présentés ici indiquent que les événements de sélection envisagés par Darwin sont détectables chez des organismes très variés et sur différentes échelles de temps. Ces événements de réduction de la diversité semblent, d'autre part, fortement corrélés aux conditions environnementales et à leurs variations, comme l'avait déjà observé Darwin il y a 150 ans. Si les mécanismes à l'origine de la diversité n'étaient pas appréhendables à l'époque, les connaissances actuelles en génétique permettent aujourd'hui une compréhension de ces mécanismes à l'échelle moléculaire, comme on a pu le voir avec l'exemple du VIH-1. De la même façon, des travaux récents ont permis de faire le lien entre la taille et la forme du bec des pinsons, et l'expression de facteurs-clés au cours du développement embryonnaire (22, figure 6, figure 7).
Chez les différentes espèces de pinsons, les becs de grande taille ont été corrélés à une expression forte et précoce du facteur BMP4 (en bleu) dans le mésenchyme présomptif du bec (en gris), durant le développement. Adapté de Grant et Grant, 2002 (19).
La surexpression spécifique de BMP4 dans le mésenchyme du bec chez le poulet induit la formation d'un bec plus large et plus haut que chez l'embryon contrôle. Cette situation rappelle les différences observées au sein de l'espèce G. fortis. Adapté de Grant et Grant, 2002 (19).
Références
Références :
Références partie VIH :
- 4- Le virus du SIDA
- 5- La découverte du virus du Sida en 1983
- 6- L. M. Mansky and H. M. Temin. 1995. Lower in vivo mutation rate of human immunodeficiency virus type 1 than that predicted from the fidelity of purified reverse transcriptase. J. Virol. 69 : 5087-5094.
- 7- Cycle du VIH
- 8- Troyer R. M., K. R. Collins, A. Abraha, E. Fraundorf, D. M. Moore, R. W. Krisan, Z. Toosi, R. L. Colebunders, M. A. Jensen, J. I. Mullins, G. Vanham and E.J. Arts. 2005. Changes in human immunodeficiency virus type 1 fitness and genetic diversity during disease progression. J.Virol. 79 : 9006-9018.
- 9- D.D. Ho, A. U. Neumann, A.S. Perelson, W. Chen, J.M. Leonard and M. Markovitz. 1995. Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection. Nature. 373 : 123-126.
- 10- Mutations
- 11- T. Shirasaka, R. Yarchoan, M.C. O'Brien, R.N. Husson, B.D. Anderson, E. Kojima, T. Shimada, S. Broder and H. Mitsuya. 1993. Proc. Natl. Acad. Sci. USA. 90 : 562-566.
- 12- H. Mohri, M.K. Singh, W.T.W. Ching and D.H. Ho. 1993. Proc. Natl. Acad. Sci. USA. 90 : 25-29.
- 13- M. Tisdale, S.D. Kemp, N.R. Parry and B.A. Larder. 1993. Proc. Natl. Acad. Sci. USA. 90 : 5653-5656.
- 14- Les trithérapies antirétrovirales
- 15- Quelques chiffres sur le VIH/sida
- 16- SIDA, zoom sur la recherche vaccinale
Retour à la partie VIH.
Référencespartie pinsons des îles Galapagos :
- 17- Carte des îles Galapagos
- 18- P.T. Boag. 1983. The heritability of external morphology in Darwin's ground finches (Geospiza) on Isla Daphne Major, Galapagos. Evolution 37(5) : 877-894.
- 19- L.F. Keller, P.R. Grant, B.R. Grant, K. Petren. 2001. Heritability of morphological traits in Darwin's finches: misidentified paternity and maternal effects. Heredity 87(Pt 3):325-36.
- 20- P.R. Grant, B.R. Grant. 2002. Unpredictable evolution in a 30-year study of Darwin's finches. Science 296 (5568) : 707-711.
- 21- P.R. Grant, B.R. Grant. 2006. Evolution of character displacement in Darwin's finches . Science 313 (5784) : 224-226.
- 22- A. Abzhanov, M. Protas, B.R. Grant, P.R. Grant, C.J. Tabin. 2004. Bmp4 and morphological variation of beaks in Darwin's finches. Science 305 (5689) : 1462-5.
retour à la partie pinsons des îles Galapagos.