Article | 23/10/2000
Météorites et formation du système solaire
23/10/2000
Résumé
Origine des météorites et formation du système solaire. Étude comparée de la chimie des météorites, des planètes du système solaire et du Soleil : modèle de condensation de la nébuleuse solaire et accrétion.
Table des matières
- Introduction
- Les chondrites : nature et comparaison chimique avec la Terre
- Les météorites différenciées: vers un modèle de formation des planètes telluriques
- Soleil, chondrite et chimie primitive
- Le scénario de condensation de la nébuleuse solaire : conséquence sur la chimie des corps du système solaire
Introduction
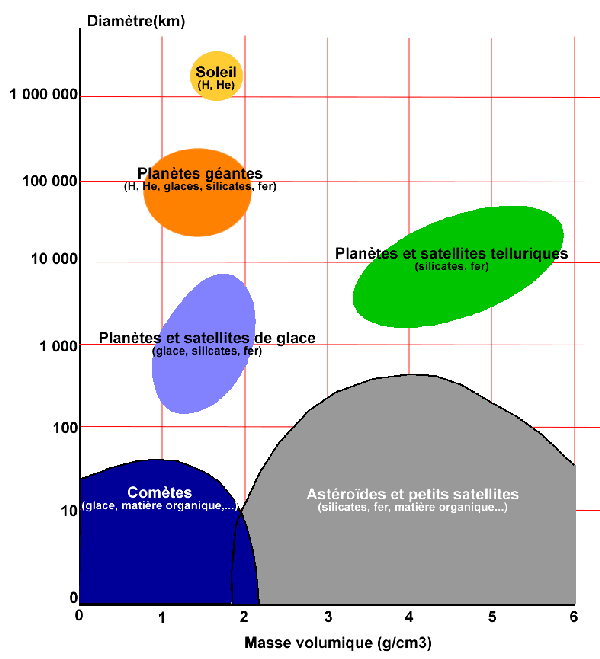
Le système solaire contient divers corps de nature chimique variée, qu'un diagramme diamètre en fonction de masse volumique permet de séparer:
- Le Soleil et les planètes gazeuses essentiellement constituée d'hydrogène et d'hélium,
- les planètes telluriques (faites essentiellement de silicates et de fer),
- les Planètes et satellites de glace (constitués d'eau sous forme solide, de roches silicatées et de fer ).
- On trouve par ailleurs les comètes, et aussi d'autres corps, regroupés essentiellement au niveau de la ceinture d'astéroïdes entre Mars et Jupiter, de même nature chimique que les planètes telluriques. Il arrive que quelques uns de ces corps arrivent sur Terre (lors du croisement de leurs orbites avec celui de la Terre): il s'agit des météorites.
Les météorites se répartissent en 2 grandes catégories:
- les chondrites (appelée aussi météorites indifférenciées)
- es météorites différenciées, subdivisées en achondrites, sidérites et pallasites.
Voir aussi LA CLASSIFICATION DES MÉTÉORITES avec les proportions de chacune d'entre elles: classification illustrée des météorites
Les chondrites : nature et comparaison chimique avec la Terre
Les chondrites sont des péridotites ferreuses (olivine, pyroxène et fer natif) de chimie homogène ; les différences chimiques entre les divers classes de chondrites n'apparaissent que sur des points de détail, non fondamental dans un premier temps.
Le nom de "chondrite" vient de petits grains sphériques, grains qui ont la même composition chimique et minéralogique que le reste de la chondrite. Minéralogiquement, les chondrites sont faites d'un mélange intime de fer métallique (10 à 20% du volume) et de silicates (olivines et pyroxènes parfois légèrement hydratés, serpentine, argiles et feldspaths en trace).
Figure 2. Chondrite du Maroc | Figure 3. Chondrite à inclusions Chondrite d'Allende à inclusions amiboïdes blanches. Ce type de chondrites est appelé "Calcium Aluminium rich Inclusion", ou CAI. |
La coexistence du mélange fer (masse volumique 8g/cm3) et de silicate (3g/cm3) montre que les chondrites n'ont jamais été fondues ou différenciées après leur formation, d'où le nom de météorites indifférenciées.
Leur âge, qui est celui de leur cristallisation, est mesuré et calculé : il est égal à 4,55 GA.
Leur chimie est reportée dans la première colonne de ce tableau:
Chimie moyenne : Chondrites | Chimie moyenne : Terre globale | |
O | 31% | 32.4% |
Fe | 27.4% | 28.2% |
Si | 18.5% | 17.2% |
Mg | 14% | 15.9% |
Ca | 3.5% | 1.6% |
Al | 2% | 1.5% |
Na | 0.6% | 1.25% |
K | 0.4% | 0.02% |
Autres éléments | 2.6% | 2.9% |
Comparons la chimie des chondrites avec celle de la Terre globale (deuxième colonne du tableau).
Cette dernière est déterminée en faisant la somme (pondérée) de la chimie des roches de surface, de celle du manteau (déduite entre autres à partir de fragments de manteau remontés par le volcanisme) et celle du noyau (estimée à partir de considérations physiques (astronomiques et sismiques entre autres...).
On constate que chondrites et Terre globale ont à peu près la même composition chimique. On peut donc faire l'hypothèse que la Terre est formée de matériel chondritique...
Cependant, contrairement aux chondrites, la Terre présente une différenciation chimique en enveloppes concentriques: elle n'est pas homogène chimiquement......
Comment expliquer la différentiation chimique de la Terre?
Les météorites différenciées: vers un modèle de formation des planètes telluriques
Pour comprendre pourquoi la Terre n'a pas préservé son homogénéité, considérons deux des trois types de météorites différenciées : les achondrites et les sidérites. Ces météorites présentent une chimie qui rappelle celle des diverses enveloppes de la Terre.
Figure 4. Achondrite basaltique Équivalent d'un gabbro. | Figure 5. Achondrite ultra-basique Équivalent d'une péridotite. | Figure 6. Sidérite (fer pur) |
Exemples de météorites différenciées :
Les achondrites et les sidérites sont interprétées comme étant issues de la fracturation d'un corps originel (appelé corps-parent) de plus grande taille ; ce dernier était constitué de diverses enveloppes (croûte, manteau, noyau) et serait similaire à la Terre, à la différence près que cette dernière (et les autres planètes telluriques) ne s'est pas fracturée...
Comme nous l'avons fait précédemment, il est possible d'estimer la composition chimique moyenne des corps-parents des achondrites et de sidérites en additionnant les trois compositions. Mais il faut aussi prendre en considération la taille du corps parent (déterminée à partir de considérations sur la taille qu'il faut atteindre pour qu'un corps silicaté se refroidisse rapidement) et la taille des diverses enveloppes (déterminée à partir de l'abondance des diverses catégories de météorites différenciées arrivant sur Terre).
On constate que, comme pour la Terre, la composition des corps-parents des achondrites et de sidérites est très proche de celle des chondrites; les corps-parents des achondrites seraient donc issus de matériel chondritique. Ces corps subiraient ensuite une différentiation chimique au cours d'une étape de fusion, avec migration des éléments les plus denses vers le centre de la protoplanète. C'est pour cela que ces météorites sont appelées "météorites différenciées" par opposition aux chondrites, qui n'auraient pas subi la fusion et la différenciation...
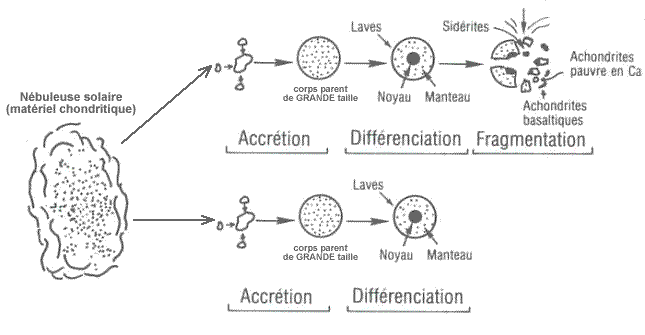
Ainsi, on peut élaborer un modèle de formation des planètes telluriques:
Figure 7. Modèle de formation des planètes telluriques du système solaire
Notez sur ce schéma qu'accrétion et différenciation sont géologiquement contemporains...
Un ensemble de poussières de chimie chondritique homogène s'agglomèrent (accrétion) pour former des corps de plus grande taille. Par collisions successives, ces corps forment un agglomérat de taille supérieure. Ce dernier se chauffe au cours de sa formation, à partir de la chaleur de désintégration des éléments radioactifs à courte durée de vie et surtout de l'énergie libérée au cours des impacts (énergie gravitationnelle). Cette énergie devient de plus en plus importante au fur et à mesure que le corps grossit par accrétion. À partir d'une certaine température (donc à partir d'une certaine taille...) , la protoplanète entre en fusion et la différenciation chimique se produit. La différenciation commence donc pendant l'accrétion, même si elle se continue quelques dizaines de millions d'année après la fin de cette accrétion.
Remarque: au cours du processus de différenciation, les éléments volatiles se seraient vaporisés, séparés de la roche et accumulés en surface, formant une proto-atmosphère (dégazage).
Quelle est la place des chondrites dans ce modèle de formation des planètes telluriques ?
Soleil, chondrite et chimie primitive
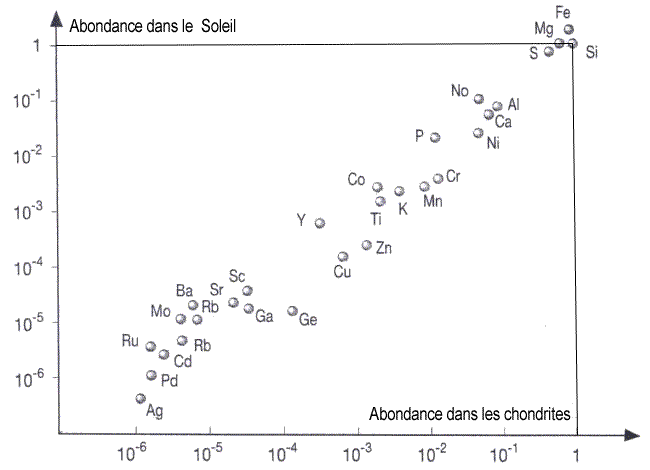
De manière à replacer les chondrites dans les processus de formation du système solaire, comparons la chimie de ces dernières à celle du Soleil.
La chimie du Soleil est déterminée à partir du spectre d'émission de ce dernier (il s'agit donc de la chimie de la photosphère). Nous ne travaillerons qu'à partir des abondances solaires corrigées de l'hydrogène, de l'hélium et autres éléments volatils (les abondances seront donc définies en ne prenant pas en compte ces éléments volatils dans la chimie solaire).
On constate alors que Soleil et chondrites ont les mêmes compositions chimiques (aux volatils près).
Abondances normalisées au silicium (Si).
Par ailleurs, le Soleil représentant environ 99% de la masse du système solaire, on peut admettre que sa chimie est représentative de la chimie moyenne du matériel primitif du système solaire. Par voie de conséquence, les chondrites également sont donc représentatives de cette chimie primitive et sont, en quelque sorte, des résidus de condensation du gaz nébulaire avant toute différenciation.
La chimie des chondrites est donc l'image des condensats formés à partir du gaz nébulaire.
Le scénario de condensation de la nébuleuse solaire : conséquence sur la chimie des corps du système solaire
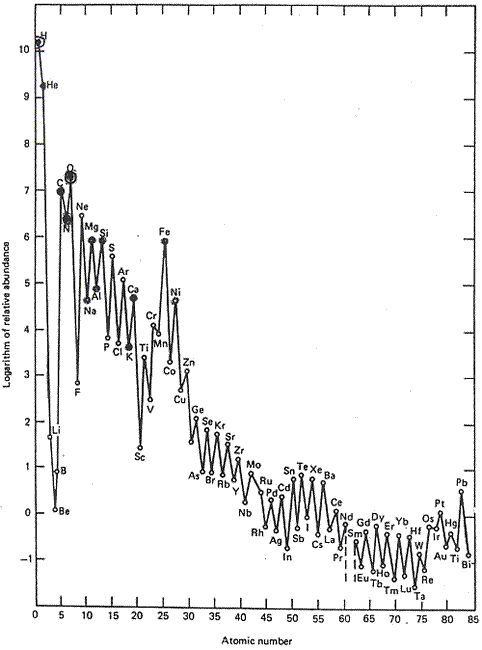
Le système solaire est initialement un vaste amas de gaz de chimie proche de celle du Soleil, c'c'est-à-dire, dominée par l'hydrogène et l'hélium (éléments formés lors de la nucléosynthèse primitive au cours du Big Bang), puis en proportion moindre C, N, O, Si, Fe, Mg ainsi que tous les autres éléments de la classification, dans des proportions que l'on retrouve dans la majorité des étoiles de type solaire.
Ces éléments sont issus du gaz éjecté par des étoiles mourantes et qui ont pollué la nébuleuse protosolaire. Ils ont servi de réacteur nucléaire assurant la fusion des noyaux d'hydrogène et d'hélium. Ce principe d'agglutination des nucléons explique notamment pourquoi les éléments de numéro atomique élevé sont peu abondants : à partir d'une quantité n d'hydrogène, on ne peut former que n/2 noyaux d'hélium, n/16 oxygène, etc...
Par ailleurs, comme ces synthèses se font les unes après les autres, et qu'il faut donc du temps, les éléments les plus lourds ne peuvent se former que dans les étoiles les plus anciennes. Or, toutes les étoiles n'atteignant pas l'âge critique de synthèse d'un élément lourd, la probabilité d'apparition de ces éléments est donc réduite.
Les éléments les plus légers sont donc les plus abondants dans la nébuleuse solaire.
Figure 9. Abondance relative des éléments dans l'Univers (et dans le Soleil)
Échelle logarithmique pour l'abondance relative, en fonction du numéro atomique.
Dans cet amas de gaz, les atomes ne restent pas libres et peuvent s'associer entre eux pour former des molécules. H et O vont former H2O. Si, O et Mg vont former SiO3Mg2 (pyroxène), etc...
Cet amas de gaz, sous l'action de son propre poids, se contracte. Ce faisant, il entre en rotation et s'aplatit pour ne former plus qu'une structure discoïde. En son centre, la pression et la température est maximale : lorsque les réactions nucléaires commenceront, cela donnera le Soleil...
En allant vers la périphérie du nuage, la température et la densité de gaz décroît. Il y a donc un profil radial de température dans le nuage de gaz nébulaire.
Source - © 2000 NASA
Ceci a une conséquence chimique fondamentale :
- Au cœur du nuage, les températures étant élevées, seuls les éléments et/ou molécules réfractaires se condenseront et deviendront poussières solides (fer, silicates). Les autres éléments et molécules resteront à l'état gazeux.
- Plus à la périphérie du nuage, les températures sont plus faibles et plus d'éléments ou molécules se condensent (glaces, fer et silicates). La température n'est jamais assez basse pour qu'H et He se condensent.
Il se met donc en place une variation radiale de la chimie des poussières nébulaires, en relation avec le caractère plus ou moins réfractaire des éléments et composés chimiques.
Des expériences de condensation de mélanges gazeux et surtout des calculs thermodynamiques ont permis de se faire une idée précise de la chimie des poussières nébulaires en fonction de la température. Un tableau récapitulatif présente les résultats obtenus:
Tableau 1. Série de condensation à l'équilibre d'un gaz de composition solaire
Températures (°K) | Chimie des condensats | |
1600 | Condensation des oxydes réfractaires (CaO, Al2O3, oxydes de titane, etc.) | Champ du Fer |
1300 | Condensation de l'alliage Fer-Nickel | |
1200 à 490 | Condensation de l'enstatite (MgSiO3, pôle magnésien de l'olivine) et réaction avec FeO pour donner de l'olivine (FexMg(1-x)SiO3) | Champ des silicates |
1000 | Na réagit avec Al2O3 et les silicates pour former Feldspaths et minéraux alcalins | |
520 à 425 | H2O se combine aux minéraux calciques (formation de trémolite) et à l'olivine (formation de serpentinite) | |
175 | La vapeur d'eau se condense en glace | Champ des glaces |
150 | NH3 gazeux réagit avec la glace et forme un hydrate solide (NH3,H2O) | |
120 | CH4 gazeux réagit avec la glace et forme un hydrate solide (CH4,H2O) | |
Moins de 120 | Condensation des derniers gaz résiduels (Ar, N2) | |
Moins de 20 (existe en laboratoire, pas dans la nature) | Condensation de l'H et l'He (n'arrivent jamais dans la nature) |
À une température donnée (donc à une distance donnée du centre de la nébuleuse), tout ce qui est au dessous de la température est solide, tout ce qui est en dessus est gazeux.
- Dans la partie interne de la nébuleuse solaire ne condensent que des poussières de nature silicaté (75% de silicates et 25% de fer) de composition proche de celle des chondrites, de la Terre et de toutes les planètes telluriques, poussières qui flottent dans un gaz (H2 + He).
- Lorsque l'on s'éloigne du centre du nuage, les minéraux commencent à s'hydrater (incorporation de molécules d'eau dans le réseau cristallin).
- A partir d'une limite de 175° K, la vapeur d'eau (ainsi que méthane et ammoniac) se condense en glaces. Les silicates et le fer sont toujours présents, mais se couvrent d'un givre glacé; il se forme alors un mélange fer-silicates-glaces dans les proportions 1/4/6. Toutes ces poussières flottent dans H2 + He.
DE TELLES OBSERVATIONS CONFORTENT A POSTERIORI LE MODÈLE DE CONDENSATION DU GAZ NÉBULAIRE...
La chimie des poussières internes du nuage reproduit la chimie chondritique.
La température d'apparition de la glace d'eau correspond à une distance au centre du système solaire d'environ 750.106 km, distance compatible avec la limite entre système tellurique (Mercure, Vénus, Terre, Mars) et système solaire externe (Jupiter, Saturne, Uranus, Neptune et leur satellites, Pluton, les comètes etc...).
Source - © 2000 NASA
Figure 11. Le système solaire
Ce modèle explique pourquoi Vénus, la Terre et Mars ont une atmosphère : leur position orbitale correspond à un lieu du système solaire où les silicates ont subi une importante hydratation et un fort enrichissement en éléments volatiles. À 150 millions de km du centre [distance Terre-Soleil] commence l'hydratation des silicates. Un peu avant [100 millions de km correspondant à la distance Vénus-Soleil] débute l'hydratation des minéraux calciques.
Une fois que le Soleil s'est formé, apparaît le vent solaire : il s'agit d'un flux de particules, issues du Soleil, et produites en continu par les réactions nucléaires internes. Ce vent va souffler le gaz nébulaire sans pouvoir toutefois affecter les protoplanètes qui entament leur accrétion. Les petits corps qui découlent de cette agglomération vont alors être concentrés en éléments relativement lourds et rares du gaz nébulaire (Si, Mg…) et appauvris en éléments légers et abondants tels que C, N ou H2O. Une fois l'accrétion terminée, le dégazage libère les gaz de la roche. Est alors libéré de la vapeur d'eau (les silicates se déshydratent par effet thermique), et un peu de diazote dans les proportions chondritiques. Au cours du dégazage, la faible quantité de matière organique (hydrocarbures) incorporé dans les météorites réagit avec les silicates (oxydation) pour former du dioxyde de carbone gazeux (il y a également libération des atomes d'azote organique et formation du diazote). L'atmosphère formée est alors dominée par la vapeur d'eau et le CO2, les deux volatiles les mieux fixés dans les poussières silicatées (par hydratation des silicates et incorporation des hydrocarbures).
Source - © 2000 Calvin J. Hamilton | Source - © 2000 Calvin J. Hamilton |
Ce modèle permet de comprendre la chimie des planètes géantes et la présence de satellites : au-delà de 750 millions de km du centre du nuage de gaz, la glace d'eau apparaît à partir d'hydrogène et d'oxygène, deux des éléments les plus abondants dans le gaz nébulaire. De ce fait, la glace, en se formant, domine la chimie des poussières (à 60% constituées de glace). Ces dernières sont riches en ammoniac et hydrocarbures. Ces poussières s'agglomèrent, forment des gros corps glacés. Ces gros corps glacés, dans un environnement froid où les molécules de gaz vont lentement, acquièrent alors une gravité suffisante pour commencer à retenir l'hydrogène et l'hélium de la nébuleuse. Quatre corps faits de fer, silicate et surtout glaces (les noyaux des futurs Jupiter Saturne, Uranus et neptune) s'entourent d'une énorme masse de gaz, et deviennent de ce fait les quatre planètes géantes.
Dans leur voisinage, les corps glacés sont trop petits pour capturer et retenir H2 et He, et deviennent satellite de glaces. La grosse masse de ces quatre géantes expulse sur des orbites extérieurs à Neptune tous les corps glacés qui n'ont pas été satellisé. Ainsi sont nés Pluton, les corps de la ceinture de Kuiper, et même les comètes.
Deux satellites de Jupiter sont particuliers: Io, purement ferro-silicatés, et Europe corps ferro-silicaté recouvert de seulement une centaine de km d'H2O. Deux hypothèses peuvent expliquer ces deux satellites exceptionnels:
- En se formant, Jupiter a reproduit dans son voisinage les conditions de hautes pressions et hautes températures que l'on retrouve à proximité du Soleil. Dans de telles conditions, il ne se forme uniquement que des poussières silicatées dans les environs du futur Jupiter. Ceci expliquerait entre autres pourquoi Jupiter est entouré d'un cortège de satellites telluriques comme Io puis, dans les parties les plus externes, par un ensemble de satellites de glace, comme Ganymède et Callisto.
- Les interactions de marées entre Jupiter et ses quatre satellites produisent sur ces derniers des marées importantes, très fortes sur Io (le satellite le plus proche), et de moins en moins forte avec l'éloignement. Ces marées dégagent de l'énergie qui chauffe le satellite. Très chauffé, Io a perdu toute son eau. Europe, moins chauffé, a presque perdu toute son eau, mais il en reste un peu. Ganymède et Callisto, peu chauffés, on garde l'intégralité de leur glace...
Enfin, ce modèle permet de comprendre la chimie des atmosphères de Titan (atmosphère dense) et de Triton (atmosphère très ténue), les seuls satellites assez gros et froid pour avoir pu garder une atmosphère: une fois agglomérées en un corps de grande taille, les poussières de glace se dégazent et libèrent les hydrocarbures qu'elles contiennent (les hydrates solides se décomposent sous l'effet de la montée en température). La faible proportion de silicates dans ce type de satellites ne permet pas l'oxydation des hydrocarbures qui atteignent ainsi la surface en restant à l'état réduit. Il n'y a donc pas de CO2 dans l'atmosphère. Et même s'il y en avait, la température à la surface de Titan (-180°C) empêcherait qu'il soit à l'état gazeux dans l'atmosphère (il serait sous forme de glace carbonique).
A cela s'ajoute la dissociation des hydrates d'ammoniac : NH3 au cours du dégazage forme du diazote qui vient dominer la chimie de l'atmosphère. Aux températures régnant sur les satellites de glace, l'eau reste à l'état solide et ne participe pas à l'atmosphère.
Enfin, un peu de gaz rares viennent s'ajouter à l'ensemble. L'atmosphère obtenue est alors proche de celle observée à la surface de Titan ou Triton.