Article | 18/03/2014
L'état supercritique en sciences de la Terre
18/03/2014
Résumé
Définition et visualisation de l'état fluide supercritique. L'eau et le CO2 supercritiques : atmosphère de Vénus, fonds océaniques proches des dorsales, métamorphisme et circulations fluides dans la croûte continentale.
Table des matières
- Qu'est ce que l'état supercritique ?
- À quoi ressemble un fluide supercritique ?
- Passage du point critique de SF6 à température critique par augmentation de pression
- Passage du point critique de SF6 à pression critique par augmentation de température
- Passage du point critique du CO2 supercritique à pression critique dans une enceinte thermostatée, par augmentation de température
- CO2 supercritique dans un tube de Natterer (volume critique)
- Les fluides supercritiques sur Terre et sur les planètes
- Conclusions et perspectives
- Références
Qu'est ce que l'état supercritique ?
Au-delà des trois états classiques de la matière que sont le solide, le liquide et le gaz, et au-delà des états « mystérieux » n'obéissant qu'à la physique quantique, existent deux autres états très peu connus que sont l'état plasma (gaz ionisé) et l'état supercritique. Ce dernier, découvert au début du XVIIème siècle par le physicien français Cagniard de Latour, se retrouve systématiquement lorsque l'on amène une substance chimique au-delà d'une pression critique et d'une température critique.
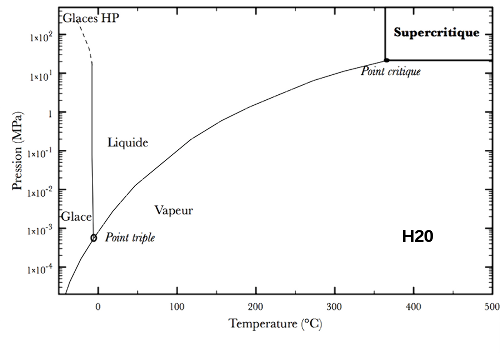
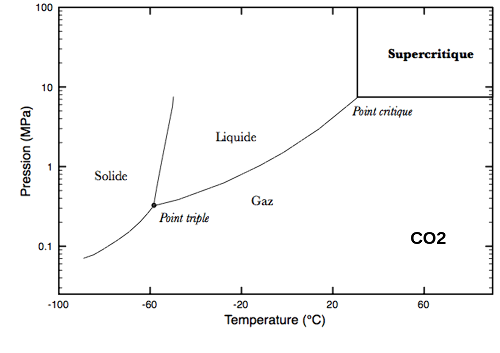
Dans le cas de l'eau, H2O (figure ci-dessous), nous pouvons observer l'état supercritique en portant la température à plus de 374°C et la pression à plus de 22 MPa (soit environ 220 fois la pression atmosphérique). Pour le dioxyde de carbone, CO2 (figure ci-dessous), le point critique est atteint à des conditions moins "extrêmes" : 31°C et 7,3 MPa (environ 73 fois la pression atmosphérique).
L'état supercritique de l'eau est atteint pour des pression et température supérieures à, respectivement, 22 MPa (pression critique) et 374°C (température critique). | L'état supercritique du dioxyde de carbone est atteint pour des pression et température supérieures à, respectivement, 7,3 MPa (pression critique) et 31°C (température critique). |
À quoi ressemble un fluide supercritique ?
Il n'existe aucun composé « courant » dont la pression et la température critiques sont dans des gammes usuelles de P et T (autour de 1 atmosphère, de -20 à +40°C). L'état supercritique n'existe pas dans la vie de tous les jours. On ne peut pas en « montrer » à des élèves, sauf si le lycée est bien équipé (avec des prépas PC, par exemple). À cause des fortes températures et pressions critiques de la plupart des molécules, cet état a été bien moins étudié, mais une difficulté se rajoute puisqu'il est difficile de l'observer. En effet, la plupart des propriétés d'une substance à l'état supercritique sont un intermédiaire entre l'état gazeux et l'état liquide. C'est le cas par exemple de la densité ou de la viscosité. Heureusement une propriété reste différente suivant les états et permet leur distinction dans certain cas : l'indice optique.
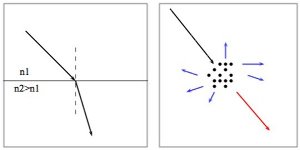
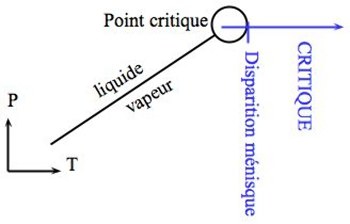
La plupart des substances chimiques possèdent des indices optiques différents entre la phase liquide et la phase solide. Si l'on amène une molécule juste au point critique, on peut avoir la coexistence de l'état liquide et l'état gazeux et la différence d'indice optique induisant la visibilité d'un ménisque caractéristique à cause de la réfraction de la lumière (que l'on peut prédire avec la loi de Snell-Descartes). Si la température ou la pression augmentent, nous entrons dans le domaine supercritique et il n'y a plus qu'une seule phase, le ménisque disparaît. À cela nous pouvons rajouter un phénomène que l'on retrouve parfois et qui s'appelle opalescence critique. Cette fois-ci ce n'est pas la réfraction de la lumière qui est en cause mais sa diffusion, phénomène qui est par exemple responsable de la couleur bleue du ciel. Cette diffusion appelée opalescence optique est caractérisée par une sorte de brouillard juste avant la disparition du ménisque lorsque l'on atteint le domaine supercritique. La figure suivant donne un petit rappel des deux phénomènes physiques observables.
Dans le cas de la réfraction, un rayon lumineux change d'angle au passage d'une interface entre deux milieux d'indices optiques différents, par exemple, gaz en haut et liquide en bas, ou bien deux liquides non miscibles. C'est le phénomène responsable de la visibilité du ménisque lorsqu'il y a coexistence des deux états liquide et gazeux.
La diffusion est provoquée par des particules qui "enlèvent" sélectivement les longueurs d'onde courtes vis-à-vis des longueurs d'onde les plus longues. Ce phénomène est responsable de l'opalescence optique avec l'apparition d'un brouillard sombre parfois bleuté si on le regarde « de côté » par rapport à la direction du rayon lumineux, rougeâtre si on regarde « à travers ».
Afin de mieux illustrer la théorie, plusieurs expériences ont été réalisées afin de « voir » un fluide supercritique.
Passage du point critique de SF6 à température critique par augmentation de pression
Protocole. La molécule utilisée ici est l'hexafluorure de soufre (SF6) qui a la particularité d'avoir un point critique à de faibles pression et température (TC = 45.5°C et PC = 3,7 MPa (environ 37 atmosphères), conditions assez facilement atteignables dans un laboratoire de lycée bien équipé. Pour cette première expérience, la température est fixée à la température critique et nous augmentons la pression via une colonne de mercure que l'on voit en gris dans la partie basse du tube.
Explications. Au début il n'y a qu'une phase vapeur. L'augmentation de pression jusqu'à point critique fait apparaître les deux phases et la limite entre les deux est marquée par un ménisque. En augmentant de nouveau la pression, le ménisque disparaît lorsqu'on passe dans le domaine supercritique : il n'y a alors plus qu'une seule phase et donc un seul indice optique. Lors de la disparition du ménisque, on peut remarquer une légère opalescence optique dans la partie supérieure du tube, caractérisée par un brouillard blanchâtre.
Source - © 2014 Planet-Terre - ENS de Lyon Passage de SF6 à l'état supercritique, à T constante (T=TC), par augmentation de pression | Figure 4. Chemin (en bleu) Pression-Température de l'expérience 1 Le passage au point critique impose la coexistence des états liquide et gaz soulignée par la présence d'un ménisque. Après avoir dépassé le point critique, il n'y a qu'un seul état, l'état critique, marqué par la disparition du ménisque. |
Passage du point critique de SF6 à pression critique par augmentation de température
Protocole. Le dispositif expérimental est identique à l'expérience 1 mais cette fois-ci nous nous plaçons à la pression critique et nous augmentons la température. L'expérience avec la coexistence de l'état liquide et gazeux, la température étant inférieure à la température critique.
Explications. Le ménisque au départ marque la transition optique entre le liquide et le gaz. L'augmentation de la température va transformer liquide (en bas) en gaz (en haut) en fluide supercritique, le ménisque disparaît donc du fait du passage à une seule phase.
Source - © 2014 Planet-Terre - ENS de Lyon Passage de SF6 à l'état supercritique, à pression initiale égale à PC, par augmentation de température | Figure 5. Chemin (en bleu) Pression-Température de l'expérience 2 En partant un peu en dessous du point critique (T < TC), il y a coexistence de deux états : liquide et gaz. En chauffant, on dépasse le point critique et il n'y a plus qu'un état, l'état super-critique avec disparition du ménisque. |
Passage du point critique du CO2 supercritique à pression critique dans une enceinte thermostatée, par augmentation de température
Protocole. Afin de mieux visualiser le phénomène d'opalescence optique, nous avons une cuve avec du dioxyde de carbone, une autre molécule avec un point critique proche de nos conditions de vie (TC = 31°C et PC = 7,3 MPa (environ 73 atmosphères). Le dioxyde de carbone est à la pression critique et présente les deux états liquide et gazeux.
Explications. En augmentant la température, on observe un phénomène similaire à l'expérience 2 avec la disparition du ménisque et le passage dans le domaine supercritique mais cette fois ci l'opalescence optique est caractérisée par un brouillard plutôt opaque et très facilement repérable.
Source - © 2014 Planet-Terre - ENS de Lyon
Passage de CO2 à l'état supercritique, à pression initiale égale à PC, par augmentation de température
CO2 supercritique dans un tube de Natterer (volume critique)
Protocole. Afin de mieux illustrer la disparition du ménisque et donc l'entrée dans le domaine supercritique, nous utilisons le même gaz utilisé lors de l'expérience 3, à savoir du dioxyde de carbone, mais il est cette fois contenu dans un long tube de verre fermé, donc à volume fixe "critique" maintenant le CO2 à pression critique (tube dit de Natterer).
Explications. La simple chaleur d'une main ou d'un sèche-cheveux permet un gain de température suffisant (TC = 31°C) pour le passage dans le domaine supercritique. À ce moment, le ménisque séparant les deux états liquide et gazeux disparaît puisqu'il n'y a plus qu'un seul d'état : l'état supercritique. L'approche de la température critique s'observe par un fort dégazage de la partie liquide. Dégazage "incomplet" et "interrompu" par le passage à l'état supercritique.
Source - © 2014 Planet-Terre - ENS de Lyon
Passage de CO2 à l'état supercritique dans un tube de Natterer (volume fixe), par augmentation de température
Les fluides supercritiques sur Terre et sur les planètes
L'état supercritique est un état bien moins étudié que les trois états principaux et même que l'état plasma, de part sa difficulté d'accès, sa difficulté d'observation et son intérêt pratique (encore que) plus limité. Pourtant, il y a une caractéristique très recherchée aujourd'hui qui est la forte capacité de solvatation et d'extraction d'un fluide supercritique, qui est due à la fois à une faible viscosité et à une forte diffusivité. Cette propriété de dissoudre très facilement de nombreuses substances est utilisée indirectement (et sans le savoir) par des millions de personnes chaque jour en France. Pour faire du café décaféiné, il faut trouver des solvants qui extraient la caféine des grains de café. Jusqu'à il n'y a pas si longtemps que cela, on utilisait le benzène. Il pouvait rester des résidus de benzène dans le café ; or cette molécule a des propriété cancérigènes certaines. Le benzène est maintenant remplacé par du CO2 supercritique. On extrait aussi souvent de cette manière, sans que ce soit indiqué sur les paquets, la caféine parfois présente dans d'autres plantes, comme le thé ou le cacao.
Des planètes à l'état supercritique et l'état supercritique sur les planètes
Alors que cet état supercritique est de plus en plus utilisé pour ses qualité d'extraction, il très encore très peu étudié dans le domaine des sciences de la Terre.
Pourtant nous savons depuis de nombreuses années que la surface de la planète Venus est essentiellement composée de dioxyde de carbone et que la température de surface est très chaude (proches de 400°C) pour une pression plus forte qu'à la surface terrestre (environ 90 fois la pression atmosphérique). L'atmosphère inférieure de Vénus est donc à l'état supercritique. Ceci impliquerait des vitesses de déplacement de l'atmosphère plus rapides et donc un style de convection différent [1]. Vénus n'est pas un cas unique puisqu'il est difficile d'imaginer les planètes géantes gazeuses, Jupiter et Saturne, sans état supercritique. Néanmoins, du fait de molécules de natures différentes (ces planètes sont principalement composées d'hydrogène et d'hélium), l'état supercritique se retrouve à l'intérieur des planètes et donc reste bien difficile à étudier. Enfin pour aller au-delà du système solaire, des compositions d'exoplanètes ont été modélisées et il se pourrait que certaines planètes (55 Cancri e et Gliese 876 d) possèdent un océan d'eau à l'état supercritique... mais ces données ne sont que très peu contraintes.
Source - © 26 fév. 1979 NASA - GSFC / NSSDC Photo Gallery
Figure 6. Une image de Vénus par Pioneer Venus Orbiter (1979)
Une atmosphère de dioxyde de carbone, une très forte température et une pression deux ordres de grandeur au-dessus de la Terre : l'atmosphère de Vénus est donc à sa base à l'état supercritique... et il ne s'agit pas d'un cas isolé.
Du supercritique dans nos océans
Il n'est pas nécessaire d'aller au-delà de notre atmosphère pour trouver un cas géologique du domaine supercritique. Bien que l'atmosphère de la Terre soit loin d'être dans cet état exotique, nous avons de l'eau et des océans avec une certaine profondeur, mais est-ce suffisant pour atteindre la pression critique ?
Dans l'eau, de masse volumique ρ = 1000 kg.m-3, la pression se calcule avec la loi P = ρ *g*h. Dans cette équation, g est l'accélération de la pesanteur, égale à 9.81 m.s-2 et h la hauteur d'eau. Il faut une pression de 22 MPa (voir figure 1) pour atteindre la pression critique de l'eau soit : hC = PC/ ρ *g = 22.106/(1000*9.81) = 2240 m.
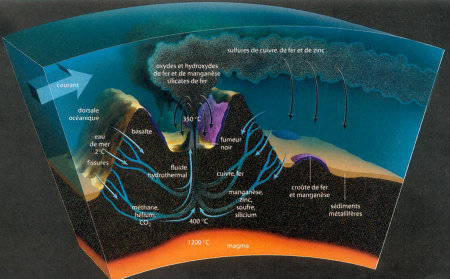
Donc, à partir de 2.2 km de profondeur, nous passons au-dessus de la pression critique même si cette estimation est approximative puisque l'océan possède de nombreux éléments qui peuvent modifier la position du point critique de l'eau pure. La profondeur moyenne des océans est de 3 à 5 km, donc une partie non négligeable du fond des océans dépasse cette pression critique. Le problème est que la température critique est de 374°C, une température bien supérieure à la température moyenne du fond des océans proche, elle, de 0°C. Cependant, au niveau des dorsales océaniques, arrivent des basaltes en fusion (qui vont d'ailleurs interagir avec l'eau pour former des pillow lavas). La profondeur moyenne des dorsales est de 2700 m, soit sous la « profondeur critique ». Ces basaltes sont à une température très élevée, au-delà de 1100°C donc nous pouvons très bien imaginer qu'une partie proche des dorsales actives est dans l'état supercritique de l'eau (même si encore une fois la présence d'éléments peut modifier la température critique). Mais surtout, l'eau circulant dans les fractures de la croûte océanique à proximité des dorsales (très fort gradient géothermique) doit atteindre les conditions supercritiques.
L'état supercritique de l'eau dans cette zone est encore loin d'être connu (étude de Koschinsky [3], par exemple) mais nous pouvons imaginer que les grandes capacités d'extraction d'éléments de l'état supercritique jouent un rôle puisque ces fluides qui circulent dans la roche sont capables de mettre en solution un grand nombre d'éléments chimiques, éléments libérés en sortie de cheminée (dépôt des éléments dissous lors du passage de l'état supercritique à l'état liquide et/ou lors du refroidissement rapide de l'eau à la sortie des cheminées... formées par la précipitation des éléments en solution dans l'eau "chaude" et/ou supercritique lors du rapide refroidissement de l'eau "chaude" à son contact de l'eau du fond de l'océan. La conséquence de la présence de cet état peut être un paramètre important puisque de nombreux métaux sont libérés au niveau de cheminées hydrothermales, des éléments d'intérêt économique que l'on pourrait prospecter. Ainsi, il serait peut-être plus propice de chercher de telles cheminées hydrothermales à forte profondeur (au-delà de la pression critique)... ce qui ne va pas facilité la technique d'exploitation.
Source - © 2002 D'après La Recherche, 355, 23
Figure 7. Schéma simplifié et idéal montrant l'interaction entre la roche et l'eau au niveau d'une dorsale
À cette interface eau-roche nous pouvons rajouter le rôle clé de l'eau supercritique (pour des fortes températures) qui permet une meilleure dissolution d'éléments et donc une extraction plus efficace de métaux vers la sortie des cheminées hydrothermales.
Des fluides supercritiques en profondeur
Il n'y a pas d'eau qu'à la surface de la Terre, il y en a aussi dans la Terre. Il est plus difficile de trouver de l'eau dans la Terre car elle est en majorité associée à des minéraux qui portent des groupes hydroxyles (le mica et l'amphibole, par exemple, sont des minéraux porteurs d'eau). Cependant, il y a un contexte particulier où il y a de l'eau : les zones de subduction. En effet, dans de telles zones, avec la pression, des minéraux porteurs d'eau comme la serpentine se déstabilisent et libèrent leur eau. Cette eau, ajoutée au manteau, permet d'ailleurs une diminution de la température du solidus et donc une fusion plus facile de ce manteau hydraté. La forme haute pression de la serpentine, l'antigorite, se déshydrate à une pression de 2000 MPa , une pression largement supérieure à la pression critique de l'eau. La température, elle, est de l'ordre de 600-700°C, nous sommes donc dans le domaine supercritique ce qui signifie que si nous avons de l'eau libre à ce niveau, c'est de l'eau à l'état de fluide supercritique.
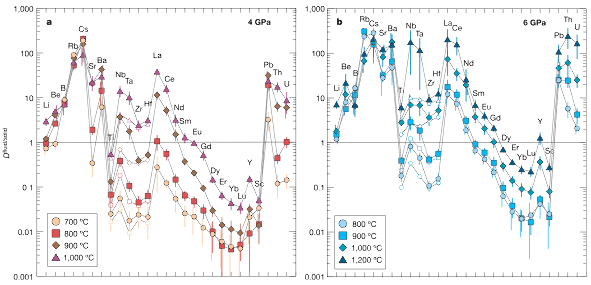
Un tel scénario devrait avoir des conséquences observables puisqu'un fluide supercritique aura une plus grande capacité d'extraction. Des expériences ([4], [2]) montrent qu'avec un fluide supercritique les coefficients de partage sont modifiés et la majorité des éléments vont plus facilement dans cette phase supercritique (ni liquide, ni gazeuse). De telles propriétés induisent une modification du bilan chimique au niveau des zones de subduction, et comme les fluides libérés sont aussi responsables de la fusion du manteau lithosphérique au-dessus de la plaque plongeante, on peut imaginer retrouver cette signature dans les laves en surface. Le problème pourrait être inversé, en partant de mesure chimique de laves nous pourrions retrouver la profondeur de celle-ci ou, du moins, attester de la présence ou non d'un fluide supercritique.
Source - © 2005 D'après Kessel et al., Nature [2]
Plus le coefficient de partage est élevé, et plus un élément à d'affinité pour le liquide ou le fluide supercritique. Nous voyons bien que l'état supercritique extrait plus facilement la plupart des éléments.
Les zones de subduction ne sont pas les seules régions où l’eau peut être sous forme libre dans la Terre. En effet, de l’eau circule dans la croûte continentale, une eau qui peut être rapidement à l’état supercritique. Le gradient géothermique moyen dans la croûte terrestre étant de 30 K/km, la température critique peut être atteinte vers 12 km de profondeur, la pression critique étant atteinte dès 2,2 km de profondeur en pression hydrostatique (eau "en connexion" avec la surface) et même à plus faible profondeur dans le cas d'une eau soumise à la pression lithostatique. L’épaisseur de la croûte continentale variant de 30 à 40 km, l’eau présente dans la croûte intermédiaire et inférieure est supercritique. Cet état permet un maintient en solution de nombreux éléments, comme Si et S, par exemple. Ainsi, lorsque de l'eau supercritique, fortement "chargées", remonte dans la croûte et quitte l'état supercritique du fait de la baisse de la température et/ou de la pression, les éléments dissous deviennent surconcentrés et se déposent alors dans la croûte supérieure sous forme de filons de quartz de sulfures divers. Ce processus est d’autant plus facile à obtenir dans les zones continentales où le gradient géothermique est plus fort, comme dans les chaînes de montagne ou dans les régions où il y a des remontées de matériel volcanique ou plutonique. Les zones de collision sont propices à ces formations de filons hydrothermaux car l’élévation de la pression et de la température peut amener certaines roches à subir du métamorphisme de haute pression et haute température (HP-HT), qui se caractérise souvent par la déshydratation de minéraux. Cette eau libérée est alors supercritique et peut dissoudre des éléments chimiques et les concentrer pour faire un dépôt minéralisé dans la croûte supérieure où le fluide n’est plus supercritique.
De nombreux minéraux sont caractéristiques de la circulation de fluides au sein de la croûte continentale, comme par exemple la barytine (sulfate de baryum) qui est très fortement soluble dans l’eau supercritique.
Les fluides supercritiques sont également à l’origine de la formation de laves carbonatitiques, puisque la mise en place du magma s’opère à très hautes pression et température, dans le manteau supérieur, où l’état supercritique permet la surconcentration de carbone pour former cette lave très particulière.
Figure 10. Coulée de carbonatite du volcan Oldoinyo Lengai (Tanzanie)
Ce magma particulier, majoritairement carboné, se forme à très fortes pression et température, dans le domaine supercritique.
Contexte et présentation du volcan dans Le Lengai et ses carbonatites.
Enfin, s’il n’est pas possible d’observer des fluides supercritiques dans la Terre autrement que par des expériences, il est possible de voir des traces de cet état, notamment via les inclusions fluides dans les minéraux. Lors de la formation de phases minérales, il est possible de piéger une partie du fluide qui circulait autour du minéral en formation. Parfois, il est possible d’observer des phases minérales en inclusion, notamment des sels dont la présence est dû au fait que les éléments de base des sels ont été surconcentrés lorsque le fluide était à l’état supercritique.
Source - © 2010 RLF / Univ. Rennes 1
Figure 11. Inclusion fluide dans un quartz hydrothermal du gisement de talc de Trimouns (Ariège)
Les petits cristaux translucides et jaunes sont respectivement du sel et de la calcite dont la présence et surtout la quantité est due à la présence initiale d’un fluide supercritique enrichie en ces éléments chimiques. Une bulle de gaz est aussi visible (tour grisé). Inclusion ~25µm.
Conclusions et perspectives
Ainsi, nous avons pu voir que l'état supercritique est de loin l'état le plus mystérieux des cinq états classiques de la matière, certainement à cause de la difficulté d'accès mais qu'il est possible de le « voir » à partir d'expériences assez simples pour être mise en place dans un lycée "bien équipé". La différence d'indice optique permet de suivre ce qui se passe autour du point critique et de toucher du doigt la transition vers cet état.
C'est certainement au niveau de la Terre qu'il y a de nombreuses recherches à faire, de par la présence certaine de cet état à la fois dans l'océan et dans l'intérieur même de la Terre. Bien sûr, nous pourrions nous intéresser aux propriétés physiques de cet état pour mieux comprendre la convection dans l'atmosphère de Vénus, par exemple, mais l'état supercritique est atteignable sur Terre à la fois directement dans les océans, et indirectement via les modifications chimiques induites par l'eau supercritique dans les parties profondes d'une zone de subduction. Au-delà de l'aspect scientifique, de nombreux intérêts économiques sont à prendre en compte. Grâce à des propriétés d'affinité des atomes et molécules de toutes sortes pour cet état, propriété déjà utilisée par l'industrie (processus d'extraction de la caféine), l'état supercritique pourrait être propice à la mise en solution et à la concentration de nombreux éléments à forts intérêts économiques.
Références
M.J.S. Belton, G.R. Smith, G. Schubert, A.D. Del Genio, 1976. Cloud patterns, waves and convection in the Venus atmosphere, Journal of the Atmospheric Sciences, 33, 1394-1417 [pdf]
R. Kessel, M.W. Schmidt, P. Ulmer, T. Pettke, 2005. Trace element signature of subduction-zone fluids, melts and supercritical liquids at 120-180 km depth, Nature, 437, 724-727
A. Koschinsky, D. Garbe-Schönberg, S. Sander, K. Schmidt, H.-H. Gennerich, H. Strauss, 2008. Hydrothermal venting at pressure-temperature conditions above the critical point of seawater, 5°S on the Mid-Atlantic Ridge, Geology, 36, 615-618
R. Stalder, P. Ulmer, A.B. Thompson, D. Günther, 2001. High pressure fluids in the system MgO-SiO2-H2O under mantle conditions, Contributions to Mineralogy and Petrology, 140, 5, 607-618 [pdf]