Article | 13/06/2018
Les extrémophiles dans leurs environnements géologiques - Un nouveau regard sur la biodiversité et sur la vie terrestre et extraterrestre
13/06/2018
Résumé
Les environnements volcaniques abritent des formes de vie originales, encore inconnues il y a une trentaine d'années. Leur découverte a bouleversé l'arbre phylogénétique en imposant un troisième domaine du vivant. Nous présentons les principaux extrémophiles présents dans les environnements volcaniques avant d'aborder les extrémophiles totalement indépendants du volcanisme. Dans de nombreux cas, nous verrons que l'humanité n'a pas tardé à utiliser ces extrémophiles à des fins pratiques. Enfin, la découverte et l'étude des extrémophiles nous ont amenés à regarder d'un œil nouveau les théories de l'apparition de la vie sur Terre, sur son maintien pendant les époques difficiles, et sur son existence possible ailleurs dans le système solaire.
Table des matières
- La découverte des extrémophiles et des archées (Archæa)
- Les extrémophiles dans leurs différents milieux
- Les intérêts pratiques et scientifiques des extrémophiles
- Les limites des conditions permettant la vie
- La vie primitive ne pouvait (probablement) être que thermophile, et les dernières formes de vie sur Terre, dans environ 2 Ga, le seront aussi
- La question de l'origine de la vie sur Terre
- Les épisodes de Snowball Earth (Terre « boule de neige »)
- La question de la vie extra-terrestre
- Conclusion
- Orientation bibliographique
Nous nous intéressons d'abord aux extrémophiles des environnements volcaniques qui développent souvent autour d'eux de nombreux environnements hors normes : haute température, souvent associée à une haute pression dans le cas du volcanisme sous-marin, pH très loin de la neutralité, salinité parfois très forte, potentiel rédox très variable, présence de sels métalliques concentrés… Les extrémophiles ont besoin pour se développer et se multiplier de ces conditions hors normes. Ces conditions environnementales étaient encore considérées comme létales il y a une quarantaine d'années (sauf les milieux hypersalés), avant de découvrir que certains organismes y réalisaient tout leur cycle de vie de manière optimale : les extrémophiles. Ces organismes non seulement tolèrent, mais requièrent des conditions extrêmes pour vivre. Les extrémotolérants viennent compléter le bestiaire des extrémophiles, mais si ces derniers n'ont pas besoin de conditions extrêmes pour vivre, ils les supportent.
Indépendamment du volcanisme mais mimant parfois ses caractéristiques, on peut retrouver certaines de ces conditions hors normes dans d'autres environnements : milieux sursalés de bord de mer ou de bassins endoréiques, pH très bas là où affleurent des roches riches en sulfures, métaux divers concentrés près des gisements métallifères… S'y rajoutent enfin quelques milieux extrêmes totalement indépendants du (et non reproduits par le) volcanisme : forte pression au fond des fosses océaniques, grand froid des zones polaires…
Ces organismes extrémophiles sont majoritairement, mais non exclusivement, des unicellulaires.
Et existe de nombreux organismes qui sont “pluri-extrémophiles” et se développent dans des environnements caractérisés par des valeurs extrêmes de plusieurs paramètres physico-chimiques. Dans les environnements volcaniques comme les lacs de cratère, les solfatares, les évents fumeroliens, les geysers, les fumeurs, les sources hydrothermales océaniques… on observe souvent des valeurs extrêmes de plusieurs paramètres comme la température et le pH. Les solfatares, par exemple, sont généralement à la fois chaudes et acides. De même, le gradient géothermique élevé y impose une augmentation de température au fur et à mesure que l'on s'intéresse à des couches profondes où concomitamment la pression va augmenter ; certains lacs y sont à la fois hypersalins et très alcalins ; le volcanisme dans l'océan profond est caractérisé par un environnement avec des températures en générale froides, mais localement très hautes, avec partout des pressions élevées… Tous ces réservoirs géologiques hébergent des biotopes constitués de populations de poly-extrémophiles diverses. On reconnaît ainsi de très nombreux organismes qui vivent dans des environnements géologiques singuliers où ils peuvent représenter une biomasse très importante.
Le Dallol est très représentatif de ce qu'est un milieu riche en extrémophiles. Il s'agit d'un champ hydrothermal dont les eaux chaudes (100°C) traversent des couches d'évaporites. On y trouve donc haute température, bas pH, haute salinité, forte concentration en métaux divers…
Dans un article nécessairement court, nous ne pouvons évidemment pas rendre compte d'un domaine aussi vaste que celui des extrémophiles, qui passionne une vaste communauté scientifique depuis 30 ans. Nous avons cherché à donner un aperçu tout en suscitant une curiosité. Nous avons ainsi été obligés de beaucoup simplifier tout en nous focalisant au début sur les environnements existant dans les régions volcaniques, même si de tels environnements existent aussi dans les régions non volcaniques.
Ensuite, nous parlerons des extrémophiles totalement indépendants du volcanisme (fosses océaniques, calottes glaciaires…). Nous avons également jeté les bases de quelques applications industrielles possibles liées aux extrémophiles, ainsi que de leurs intérêts purement scientifiques qui dépassent ceux de la seule biologie.
La découverte des extrémophiles et des archées (Archæa)
Les premiers organismes extrémophiles connus sont des halophiles (“qui aiment le sel”), découverts dans des environnements que beaucoup croyaient dépourvu de vie, comme la Mer Morte. En fait, cette mer, qui est plutôt un lac salé, était appelée morte par les anciens, car dépourvue de poissons. Mais de nombreuses bactéries, algues, crustacés… vivent dans ses eaux saturées en sel. Ces organismes halophiles sont souvent de couleur rose, ce qui donne parfois à ces lacs leurs belles couleurs.
Cependant, les chercheurs ne se sont vraiment intéressés aux extrémophiles que lors de l'identification, dans les années 1970, du troisième domaine du vivant, celui des archées (Archæa), auxquels ils appartiennent très souvent. En effet, les travaux réalisés par Carl Woese et Georges Fox [27] ont remis en cause la classification des organismes basée sur la dichotomie procaryotes/eucaryotes, proposée par Roger Yate Stanier et Cornelius Bernardus Van Niels dans les années 1960 [24].
En 1969, avant qu'on imagine l'existence des archées, le microbiologiste Thomas Brock [1] isole pour la première fois un “microbe” thermophile, Thermus aquaticus, à partir des sources d'eau chaude et acide du Parc national de Yellowstone aux États-Unis (ci-dessous). En approfondissant ses recherches, il isole, à partir de cette même source, un organisme encore plus thermophile, Sulfolobus acidocaldarius, qui peut supporter des températures de 90°C, et, de plus, associées à des pH très acides, entre 1 et 5.
Figure 4. Black Bassin (parc de Yellowstone) : tapis d'extrémophiles de 1 à 10 cm d'épaisseur Quand cette source est apparue (ou s'est déplacée) dans cette ancienne forêt, tous les arbres et autres organismes non extrémophiles sont morts et ont été remplacés par des bactéries ou des archées. | |
La découverte des organismes thermophiles remet en cause l'idée que les organismes meurent tous au-delà de 80°C. Cette idée était alors une constatation usuelle ; elle était fondatrice des principes de la pasteurisation et de la stérilisation (débactérisation thermocontrôlée) ; elle était parfaitement expliquée par la dénaturation thermique des macromolécules biologiques (coagulation des protéines ou dénaturation des acides nucléiques, par exemple). Ces organismes extrémophiles vivaient bien au-dessus de la limite présupposée “stérile” à l'époque.
Cette vie dans des milieux présupposés létaux, pose d'ailleurs un problème aujourd'hui dans le milieu médical car les microorganismes regroupés en biofilms représentent de graves menaces pour notre santé. En effet, quand un biofilm se développe, les bactéries qu'il contient peuvent devenir insensibles aux antibiotiques, plus insensibles que des bactéries isolées, ce qui peut engendrer des infections chroniques. Ce sont les grands responsables des maladies nosocomiales. En France, environ 6 % des patients subissent une infection bactérienne lors d'une hospitalisation. Elles provoqueraient environ 3 000 à 6 000 décès par an (Sauer, 2018 [22]).
La découverte de ce nouveau champ du vivant a alors déclenché une « chasse aux extrémophiles » au sein des milieux extrêmes. Elle a abouti à la découverte d'une diversité inouïe, complètement inattendue. On découvre alors que beaucoup de ces microbes, s'ils ressemblent morphologiquement à des bactéries telles qu'on les définissait à l'époque, n'en sont pas. Vis-à-vis de leur génome, de leur métabolisme…, beaucoup de ces organismes sont très éloignés des bactéries “classiques”. À cause de leur métabolisme singulier, supposé à l'époque être très primitif, sur la base des anciens modèles de la composition de l'atmosphère terrestre d'il y a 3 à 4 milliards d'années et possiblement présente là où vivaient les premières formes de vie, Fox et Woese baptisèrent ce groupe Archaebacteria et proposèrent que le monde vivant se divise en trois super-règnes : les Eubacteria, les Eucarya et les Archaebacteria. Des deux micro-organismes étudiés par Thomas Brock (Thermus aquaticus et Sulfolobus acidocaldarius), le premier s'est avéré être une bactérie, et l'autre une archée.
Cette découverte des extrémophiles a ainsi conduit à une professionnalisation méthodologique et conceptuelle en microbiologie moléculaire en proposant une phylogénie du vivant. Celle-ci est fondée sur le séquençage de l'ARN ribosomique. Certains de ces gènes (ARNr 16S et 18S) ont été retenus comme marqueurs taxonomiques standards. Le gène encodant l'ARN ribosomique (16S chez les “procaryotes” et 18S chez les eucaryotes) a, en effet, la particularité d'être présent chez tous les êtres vivants. Il existe aujourd'hui une banque de données de plusieurs millions d'ARNr 16S et 18S. En comparant sa séquence chez différents organismes, on peut construire des arbres phylogénétiques, c'est-à-dire quantifier les relations de parenté entre organismes. La longueur des branches des arbres phylogénétiques indique la distance génétique (c'est-à-dire évolutive) entre les organismes. L'arbre phylogénétique ainsi obtenu a créé une surprise importante. En effet, on a découvert que tout le groupe d'organismes appelés archées, dont la morphologie ressemblait beaucoup à celle des bactéries classiques, se retrouvait isolé, distant à la fois des bactéries classiques (qu'on appelait procaryotes quand elles étaient les seules cellules sans noyau) et des eucaryotes, qui rassemblent la plus grande diversité morphologique (plantes, champignons, animaux et micro-organismes eucaryotes). Cela remettait en question la traditionnelle représentation des relations entre organismes vivants. On a découvert depuis que ces organismes n'étaient pas du tout les premiers, qu'ils dérivaient d'évolutions complexes, mais le nom historique d'archée, consacré par l'usage, demeure. Et les généticiens proposent aujourd'hui que les archées soient plus proches des eucaryotes que des bactéries (cf. figure ci-dessous). Les Archaea sont présents dans tous les milieux et dominent la biomasse de certains d'entre eux, comme l'océan profond par exemple.
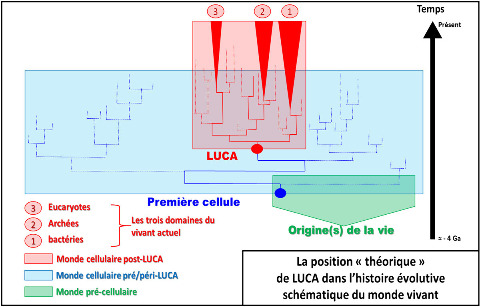
Source - © 2018 Inspiré de P. Forterre, S. Gribaldo, C. Brochier / Médecine sciences (2005)
Le cénancêtre représente la position du dernier ancêtre théorique commun à tous les êtres vivants actuels connus et analysés. Il a été appelé LUCA (Last Universal Common Ancestor). Ce n'est donc pas la figure théorique du premier être vivant terrestre, mais au contraire du plus jeune, du dernier (the last) des ancêtres communs à ce qui vit aujourd'hui. La vie anté-LUCA (ou péri/post-LUCA mais n'ayant pas de descendant actuel connu) a été représentée de façon toute théorique (en bleu et en vert) pour bien insister sur le fait que LUCA n'est pas le premier être vivant. L'échelle des temps est arbitraire et non linéaire.
Les extrémophiles dans leurs différents milieux
On classe les organismes extrémophiles selon le paramètre physico-chimique auquel ils sont adaptés dans une valeur extrême. Par exemple, pour la température, on a des organismes hyperthermophiles, thermophiles et psychrophiles. Pour le pH, on a des organismes qui vivent à pH bas (acidophiles), ou élevé (alcalophiles).
Tableau 1. Principaux types d'extrémophiles et extrémotolérants
Type | Caractéristiques - Organismes vivant dans des environnements : |
|---|---|
Thermophile * | — chauds avec des optimums de croissance proche de 60 °C (sources chaudes). |
Hyperthermophile ** | — très chauds avec des optimums de croissance proche de 90 °C à 115 °C. Ils peuvent se diviser dans un milieu d'eau portée à ébullition quand la pression n'est pas trop forte, (sources chaudes, geysers, solfatares, fumeurs…). |
Acidophile * | — acides avec un pH optimum de croissance proche de 3 (lacs de cratère, sources chaudes, solfatares, Dallol, mines et couches de sulfures…). |
Alcalophile *, alcaliphile ou alcalinophile | — basiques avec un pH optimum de croissance proche de 9 et plus (lacs natrons, lac riches en Na2CO, Dallol, sources chaudes alcalines…). |
Halophile * | — très salés, forte concentration en NaCl (lacs du rift Est-africain, salar d'Uyuni en Bolivie, marais salants, sources sortant de couches d'évaporites, mines de sel, diapirs de sels…). |
Métallotolérant * | — avec de hautes concentrations en métal (cuivre, cadmium, arsenic, zinc) (fumeurs, mines, filons minéraux, déchets industriels…). |
Radiorésistant | — soumis à des radiations ionisantes élevées (gisements et mines d'uranium, centrales nucléaires, accidents nucléaires [Three Mile Island, Tchernobyl, Fukushima], centres de stockage radioactifs…). |
Lithophile * | — endogées. Organismes « qui aiment la roche », vivant dans la croûte terrestre (tunnels de lave, aquifères profonds, sous-sol profond, voire Mars, Europe, Encelade ?). Ils fabriquent leur propre matière organique, en utilisant H2O et CO2, et des réactions entre des composés inorganiques de la roche ou de l'environnement pour produire des réactions énergétiques. |
Psychrophile | — froids (abysses, calottes polaires, glaciers, inlandsis, neige, montagne, permafrost, et, de façon toute à fait artificielle, dans l'espace où ils peuvent résister au vide et aux radiations, mais pas s'y développer). |
Piézophile ou barophile* | — soumis à des pressions élevées (fonds océaniques profonds jusqu'à – 11 000 m : fosse des Mariannes), sous-sol profond… |
Xérophile | — très secs. Organismes capables de résister à la dessiccation : ayant besoin de peu d'eau pour survivre (vallées antarctiques, déserts, espace). |
* fréquent mais non exclusif en milieu volcanique
** exclusif des milieux volcaniques
Les milieux chauds et très chauds
Les micro-organismes non eucaryotes thermophiles et hyperthermophiles isolés dans des zones d'activité géothermale terrestres et marines appartiennent aux deux domaines bactéries et archées. Ces micro-organismes présentent des caractéristiques physiologiques et métaboliques très diverses et interviennent dans la plupart des grands cycles biogéochimiques, notamment celui du soufre.
Les hyperthermophiles sont probablement les plus connus des extrémophiles. Leur température optimale de croissance est supérieure à 80°C, valeur longtemps considérée comme la frontière biolimitante. En effet, les eucaryotes n'arrivent quasiment pas à vivre au-delà de 60°C. Seuls quelques champignons et quelques eucaryotes unicellulaires supportent 60°C. Au-dessus de cette température, on ne rencontre plus que des archées et des bactéries thermophiles et hyperthermophiles. On ne trouve plus de bactéries au-delà de 95°C. Au-dessus de cette température limite, c'est le territoire exclusif des archées dont certaines se développent en milieu paravolcanique jusqu'à 110-115°C. Elles ont été isolées pour la première fois dans les sources chaudes du parc National de Yellowstone aux États-Unis. Des hyperthermophiles colorent les eaux du Grand Prismatic Spring (dans le parc de Yellowstone, États-Unis), du Tokaanu (zone volcanique de Taupo, ile du Nord, Nouvelle-Zélande) et du célèbre Champagne Pool proche de la zone thermale de Wai-o-Tapu (Nouvelle-Zélande), mais aussi en Islande, en Italie, au Chili, etc. En France métropolitaine, on doit en trouver à la source du Par (+82°C) à Chaudes Aigues dans le Cantal.
Elles sont également présentes à de très grandes profondeurs, entre − 1 500 et − 4 000 m, le long des dorsales océaniques. La plupart des micro-organismes hyperthermophiles sont des archéobactéries (par exemple l'archée Pyrolobus fumarii trouvée sur les parois d'un fumeur noir sur le site TAG (− 3 650 m) en Atlantique, se développe entre 90°C et 113°C avec un optimum de croissance à 106°C. Près de Vulcano (Italie) on a pu isoler, en 1982, une archée appelée Pyrodictium (« doigts de feu ») dont la température optimale de croissance est de 105°C à 110°C. La plupart de ces archées peuvent vivre à des températures nettement supérieures à 80°C : Pyrococcus furiosus (« coque brulante furieuse »), Pyrobaculum islandicum (« bâton brûlant d'Islande »), et Thermococcus celer (« coque thermique qui bouge ») croissent à des températures comprises entre 85 et 100°C.
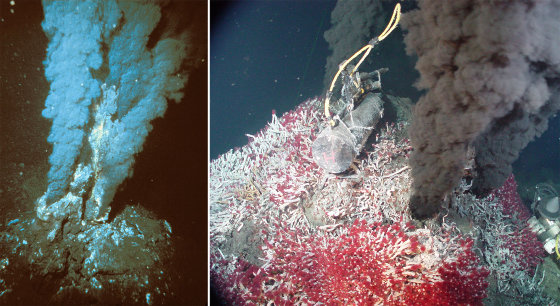
Source - © 2000-2004 OAR/NURP ; NOAA - NOAA PMEL EOI Program Figure 7. Deux fumeurs noirs quelque part le long des 60 000 km de dorsales océaniques Des organismes chimiolitotrophes y vivent « partout », dès que la température est ≤ 115°C (et peut-être trouvera-t-on un jour des organismes vivant à une température plus haute). Ils forment des colonies libres, que consomment d'autres organismes pluricellulaires (ou vivent en symbiose dans d'autres organismes pluricellulaires). À gauche fumeur “jeune” sans doute actif depuis quelques années seulement dont la périphérie est peu colonisée par ces organismes pluricellulaires. À droite, le fumeur est plus ancien, et sa périphérie est complètement colonisée d'organismes variés. | Source - © 2000-2004 Ifremer Pyrococcus abyssi a été découvert à − 2 000 m au niveau d'une source hydrothermale de l'Océan Pacifique. À cette pression (2000 m de profondeur = 20 MPa), en laboratoire, son optimum de croissance est à 100°C. À la pression atmosphérique (0,1 MPa), elle est de 96°C. |
Les sources hydrothermales émettent des fluides très réduits (en particulier riches en Fe2+ et H2S), et souvent des gaz considérés comme toxiques pour la plupart des organismes (sulfure d'hydrogène, hydrogène, méthane), mais aussi beaucoup de métaux lourds provenant du lessivage des couches volcaniques ou plutoniques profondes. Des colonies d'extrémophiles se développent, vivant libres dans l'eau ou fixées sur le sol et dans le sous-sol, où elles forment des matelas de plusieurs centimètres d'épaisseur, généralement en symbiose avec les autres espèces.
Les composés dissouts s'avèrent utiles pour le développement des communautés d'organismes qui y vivent. Ils sont en effet autotrophes, c'est-à-dire capables de synthétiser leur propre matière organique (glucide, protéines…) à partir de matière inorganique (CO2, H2O, NH3…) et d'énergie. Mais contrairement aux photo-autotrophes, ces organismes sont chimiolitho-autotrophes. Ils obtiennent l'énergie permettant leurs synthèses non pas à partir de la lumière, mais à partir de réactions d'oxydoréduction qui font intervenir les composés réduits et oxydants issus des fluides ou du substrat. On peut citer 3 réactions classiques dans ces contextes, deux faisant intervenir l'O2 dissout dans la mer et la troisième ne faisant pas intervenir cet O2 :
- 4 FeO + O2 → 2 Fe2O3 + énergie
- H2S + 2 O2 → H2SO4 + énergie
- CO2 + 4 H2 → CH4 + 2 H2O + énergie
Dans cette dernière réaction, H2 moléculaire qui n'existe pas “normalement” sur Terre provient de la réaction de serpentinisation (cf. Serpentinisation océanique et vie primitive' ou L'origine de la vie vue par un géologue qui aime l'astronomie) : olivine (forstérite et fayalite) + H2O → serpentine + brucite + magnétite + H2.
On peut remarquer que les deux premières réactions ci-dessus dépendent indirectement de la lumière solaire même si elles ont lieu au fond de l'océan, via l'O2 dissout dans les eaux ou présent dans l'atmosphère, O2 issu de la photosynthèse. La troisième réaction est, elle, totalement indépendante de l'O2, donc de la lumière solaire.
Ces organismes sont parfois à la base de chaines trophiques complexes, comme autour des fumeurs des dorsales : ils réalisent la production primaire de l'écosystème et nourrissent d'autres bactéries, des animaux situés à proximité…
On peut noter que la PCR (Polymérase Chain reaction), technique d'amplification génétique maintenant très utilisée en biologie, en criminologie, en recherche généalogique… utilise les propriétés spécifiques des ADN polymérases thermostables, initialement découvertes chez des bactéries thermophiles comme Thermus aquaticus…
Les pH acides
Ces milieux sont fréquents dans les régions volcaniques, bien que non exclusifs de ces régions.
Les organismes acidophiles se rencontrent à pH très bas. Certains peuvent proliférer dans une solution d'acide sulfurique. Ils se rencontrent dans différents milieux dont les zones volcaniques bien sûr. Dans de nombreuses régions volcaniques, en effet, abondent solfatares et autres sources riches en soufre et hydrogène sulfuré (H2S), qui s'oxydent en SO2 ou SO3 en arrivant à l'air libre ou au contact d'une nappe phréatique oxydée. En solution dans l'eau, ces oxydes donnent de l'acide sulfurique (H2SO4) et autres sulfates acides, par exemple le sulfate ferrique [Fe2(SO4)3]. Et les fumeroles contiennent aussi souvent de l'acide chlorhydrique (HCl).
L'organisme le plus acidophile connu est Picrophilus achemaï, isolé d'une solfatare au Japon. Son pH optimum est de 0,7 et il peut se développer à pH 0.
Figure 9. Le cratère du Mont Aso (Japon) dans son état d'août 1981 Le cratère est rempli par un lac acide dont la couleur indique qu'il contient du soufre colloïdal et sans doute des archées et/ou des bactéries. Une tache jaune sur la paroi à gauche indique la présence d'une solfatare à cet endroit. | Figure 10. Un ruisseau acide tiède (environ 35°C) à Furnas, Açores Diverses venues d'eau à divers pH entrainent le développement de divers micro-organismes aux couleurs variées. |
Mais il n'y a pas que les régions volcaniques qui sont riches en sources et autres suintements acides. On rencontre des milieux acides en dehors de tout volcanisme actif, à chaque fois que des terrains sont riches en sulfures à l'affleurement. Dans la chaine hercynienne européenne, par exemple, il y a de nombreuses formations géologiques contenant des sulfures (principalement de la pyrite FeS2) déposés par de l'hydrothermalisme ancien assimilé à de l'hydrothermalisme océanique (ophiolites au sens large) ; il y a également des filons péri-granitiques riches en sulfures. Il y a aussi, et même surtout de nombreuses roches sédimentaires riches en sulfures, en particulier les roches argileuses qui ont sédimenté dans un milieu anoxique. En l'absence d'oxygène mais en présence des sulfates de l'eau de mer, des bactéries sulfato-réductrices ont généré des sulfures. C'est par exemple le cas des sédiments siluriens de la chaine hercynienne dans tout l'Ouest et le Sud-Ouest de la France, de l'Armorique aux Pyrénées.
Quand ces roches riches en sulfures (sulfures hydrothermaux ou sédimentaires) arrivent à l'affleurement, que ce soit naturellement suite à l'érosion ou à la suite d'exploitations minières, ces sulfures s'oxydent, spontanément ou sous l'action de bactéries acidophiles. Les sulfures deviennent soufre et/ou sulfates. Des colonies de bactéries acidophiles peuvent se développer sur des parois rocheuses où affleurent des sulfures. Cela donne des amas gélatineux, des efflorescences colorées en jaune par du soufre, des efflorescences blanches de sulfates… Si les sulfures contenaient des métaux comme le cuivre ou le fer dont les sels sont colorés, cela peut donner des encroutements bleus ou verts pour le cuivre, couleur rouille pour le fer…
Figure 11. Paroi au fond de la Carrière Saint Antoine, Saint Pierre la Palud, Rhône
Cette falaise correspond au front de taille d'une ancienne carrière de pyrite (FeS2) qui exploitait un ancien amas sulfuré déposé par des sources hydrothermales dans un petit “bassin océanique” (bassin marginal probable) au Dévonien supérieur (360 Ma). Des micro-organismes acidophiles se développent sur cette paroi, et des sulfates solubles subsistent dans les endroits abrités de la pluie. La figure suivante montre des détails situés au centre de l'image.
Figure 12. Détails de la paroi riche en pyrite de la carrière Saint Antoine de Saint Pierre la Palud (Rhône)
Les vues de droite sont localisées (cadres rouge et bleus) sur le cliché de gauche.
Des amas gélatineux ou des efflorescences jaunes correspondent à des colonies de micro-organismes ou des dépôts de soufre. Les efflorescences blanches correspondent à des sulfates indéterminés, et les dépôts verts correspondent à des colonies de micro-organismes et/ou des dépôts de sulfates de cuivre.
Si un secteur est très riche en pyrite, pyrrhotite… (sulfures de fer), ils deviennent des sulfates ferriques, qui, en solution, donnent une eau très acide, par exemple dans la région du Rio Tinto au Sud de l'Espagne. Ce « ruisseau teinté » doit son nom à la couleur rouge de l'eau, due à la présence de fer (Fe3+) à pH 2 en solution, et aussi à un voile microbien qui recouvre le fond du ruisseau.
Cette photo a été prise l'été en période de basses eaux. En période de hautes eaux, tout le lit majeur du rio est sous l'eau acide, ce qui empêche la croissance des végétaux et de toute espèce non acidophile. | Figure 14. Vue de près des tapis microbiens très colorés qui recouvrent le fond du Rio Tinto (Espagne) Le cache photo donne l'échelle. |
Parmi les espèces acidophiles et les réactions chimiques classiques, on peut citer la bactérie Beggiatoa du bassin El Pond (Massachusetts). Elle oxyde le sulfure d'hydrogène en soufre puis en acide sulfurique selon les réactions :
- 2 H2S + O2 → 2 H2O + 2 S
- 2 S + 2 H2O + 3 O2 → 2 H2SO4
Des grains de soufre sont déposés dans la cellule. Ils y induisent une apparence opaque blanche ou jaune.
Ces réactions faisant intervenir soufre et sulfures ne sont pas sans nous rappeler la théorie de Günther Wächtershäuser en 1988, selon laquelle la vie serait apparue sur des surfaces de pyrite (catalyseur), car le gaz carbonique de l'atmosphère aurait pu former des molécules organiques prébiotiques en présence de sulfure d'hydrogène et de sulfure de fer (cf., Evolution of the first metabolic cycles).
Ces extrémophiles acidophiles sont utiles en biotechnologie, pour la lixiviation des métaux. Ils se chargent de lessiver et de solubiliser les métaux résiduels encore présents dans les terrils.
L'intérêt majeur des procédés microbiologiques est leur utilisation avec des minerais à faible teneur dans des conditions relativement douces dans des terrils de « stérile ». Le plus grand terril de minerai traité par biolixiviation (mine de cuivre d'Escondida dans le désert de l'Atacama au Chili) fait 5 km de long, 130 m de haut, 2 km de large. Les organismes acidophiles sont également utilisés pour la désulfuration industrielle du charbon.
Les pH basiques
Les organismes alcaliphiles vivent dans des milieux à pH basique. En Afrique de l'Est, surlignant le tracé du rift Est-africain, de Djibouti au Mozambique, on rencontre des lacs alcalins riches en saumures. Un soda lake représente un environnement alcalin riche en sel de sodium dissout, notamment carbonate, chlorure et sulfate de sodium. Ces lacs sont basiques, car ils contiennent en grande concentration (souvent proche de la saturation) du carbonate de sodium Na2CO3 dissout qui, par évaporation, donne du carbonate de sodium déca-hydraté (Na2CO3)10(H2O), minéral appelé natron.
Cette grande concentration en carbonate de sodium a deux origines qui s'ajoutent :
la richesse en sodium vient de l'altération des silicates alcalins des roches volcaniques ou du socle sous-jacent, altération par des eaux riches en CO2 (beaucoup plus riches en CO2 qu'en soufre dont l'acidité induite neutraliserait l'alcalinité). Par exemple, l'altération de l'albite peut s'écrire :
4 NaAlSi3O8 (albite) + 4 H2O + 2 CO2 → Si4O10Al4(OH)8 (kaolinite) + 2 CO32− + 4 Na+ + 8 SiO2
La présence près du rift Est-africain de volcans carbonatitiques, en particulier de natrocarbonatite, renforce localement cette richesse en sodium (cf. Le Lengaï et ses carbonatites).
une évaporation très importante entrainant un endoréisme et une concentration de carbonates dissouts.
C'est le cas des lacs de type natron (comme le lac éponyme de Tanzanie), de la saline du cratère Chew Bet en pays Borana (Éthiopie) et de nombreux autres lacs en région sèche hors d'Afrique…
Des organismes alcaliphiles y vivent à pH alcalin, au-dessus de pH 9 et pouvant atteindre 11,5, notamment dans les nombreux lacs et déserts sodiques, fréquents dans les régions volcaniques (mais non exclusifs de ce contexte). On retrouve également des organismes alcaliphiles dans d'autres types de lacs, moins salés, où ils peuvent former des stromatolithes qui peuvent atteindre plusieurs mètres de haut. Ainsi, malgré des conditions apparemment très inhospitalières à cause de conditions alcalines extrêmes, souvent de salinité élevée et associées à une disponibilité faible d'ions Mg2+ et Ca2+, les lacs sodiques renferment de nombreux micro-organismes représentant les principaux groupes phylogénétiques et trophiques des bactéries et des archées, qui sont très souvent polyextrémophiles (alcalinophiles et halophiles) : cyanobactéries fermentaires, halophiles aérobies et anaérobies, protéobactéries nitrato- et sulfato-réductrices, archées méthanogènes et halophiles. Les cycles élémentaires du carbone, de l'azote et du soufre sont particulièrement actifs dans les lacs sodiques. Malgré des conditions apparemment hostiles, les lacs de saumures alcalines font partie des environnements aquatiques les plus productifs connus sur Terre. La production primaire de matière organique dans ces lacs est considérable et peut dépasser les 10 g.cm-2.j-1 (sachant que la production primaire des lacs et réservoirs est généralement de l'ordre de 0,6 g.cm-2.j-1). Les bactéries et notamment les cyanobactéries y jouent un rôle déterminant.
Source - © 2018 - 2010 Google Earth - Stefan Thüngen
Figure 15. Cratère de l'Emi Koussi dans le massif du Tibesti (Tchad)
En haut, le cratère principal contient un cratère secondaire, tapissé de natron (petite tache blanche). Lors des rares pluies, ce cratère devient un lac qui héberge des micro-organismes alcalinophiles.
En bas, le lac intérieur du cratère Emi Koussi au Tchad, dont le fond est sec, et tapissé de natron en dehors des (rares) périodes humides.
On peut noter de façon anecdotique que le natron a été utilisé par les Égyptiens pour ses capacités de déshydratation, par exemple dans les processus de momification. Les Égyptiens appelaient cette substance le neter, mot devenu natrium puis natron après la conquête romaine. C'est des mots natrium et natron que vient le symbole « Na » du sodium.
Les communautés microbiennes des milieux alcalins naturels ont, depuis longtemps, attiré l'attention des industriels en raison des nombreuses utilisations possibles de leurs enzymes ou de leurs métabolites. Les micro-organismes alcaliphiles ont un intérêt commercial pour la production d'enzymes comme les protéases alcalines couramment utilisées dans les poudres de lessives biologiques et dans l'industrie du cuir par exemple.
Les milieux salés et les DHABs
Les organismes halophiles, qui « aiment » les fortes concentrations de sels (majoritairement NaCl), peuvent vivre jusqu'à saturation en sel (concentration à laquelle le sel précipite). On les retrouve souvent en régions volcaniques où abondent les sources salées (cf. Les sources thermominérales d'Auvergne : aspects géologiques), car (1) les eaux riches en CO2 altèrent les silicates alcalins (cf. ci-dessus), et (2) les gaz et sources volcaniques contiennent aussi du chlore et des ions Cl−. Mais on les retrouve surtout associés à des couches de halite sédimentaire (et dans les effluents de certaines mines de sel qui exploitent ces couches, comme par exemple en Lorraine), dans des lacs endoréiques, et très souvent dans les salines (naturelles ou artificielles) de bord de mer. Dans ces salines artificielles, les marais salants, les sauniers font circuler et évaporer l'eau de bassin en bassin ; la concentration en sel augmente jusqu'à atteindre la saturation. La couleur rouge-rose-orangée que l'on observe souvent dans ces différents étangs correspond à la couleur des pigments de ces organismes halophiles, que ce soient des bactéries, des algues unicellulaires ou des organismes pluricellulaires (comme par exemple le crustacé branchiopode Artemia salina). Ces algues unicellulaires synthétisent des caroténoïdes, qui se retrouvent dans les crustacés, puis dans les consommateurs de crustacés, notamment les flamants roses qui vivent dans ces milieux salés.
Figure 16. Les marais salants de Gruissan (Aude) et leur couleur rose caractéristique à certaines saisons
En haut, vue aérienne de Gruissan avec les marais salants au centre de l'image. En bas à gauche, vue d'un bassin de pré-concentration du sel. En bas à droite, gros plan sur le tapis algo-bactérien rose qui tapisse le fond du bassin.
Dans les bassins endoréiques naturels des pays chauds, la température de l'eau peut atteindre 60°C. Les organismes y sont alors halophiles et thermophiles. Dans les bassins endoréiques des pays froids ou de haute altitude, comme sur les plateaux tibétain, du Ladakh, ou de la haute Cordillères des Andes, les lacs peuvent rester liquides jusqu'à −21°C en hiver (température de congélation de l'eau saturée en sel). Les organismes y sont alors halophiles et psychrophiles (littéralement « qui aiment le froid »).
Source - © 2010 - 1013 Pierre Thomas - Benoît (blogspot)
Figure 17. Le lac du Tso Kar (4636 m), Ladakh, Inde
Ce lac d'altitude, endoréique, est saturé en sel qui forme des croûtes blanches sur ses bords. Le fond du lac est tapissé d'un voile microbien halophile qui vit très bien dans ce milieu saturé. Ces micro-organismes sont consommés par des métazoaires, notamment des crustacés brachiopodes du genre Artemia. L'hiver, la température de l'eau peut descendre à −21°C et rester liquide (température de congélation de l'eau saturée en sel). Microbes et crustacés “hibernent” et résistent très bien à ces températures. Ce sont donc des organismes à la fois halophiles et psychrophiles (« qui aiment le froid »).
Les fosses profondes hypersalées. Au cours de ces 25 dernières années, des dépressions profondes, hyper-salées et anoxiques, connues sous l'acronyme de DHABs pour Deep Hypersaline Anoxic Basins, ont été découvertes, entre 2 000 et 4 000 m de profondeur : Atalante, Urania, Discovery, Bannock, Tyro, Thetis, Medee et Kryos, par exemple, en Méditerranée. Ces dépressions peuvent être de toute taille, parfois moins d'une dizaines de mètres de diamètre. Tous ces Deep Hypersaline Anoxic Basins ont en commun de se situer au-dessus de dépôts salins d'évaporites à faible profondeur sous le plancher marin, évaporites datant par exemple du Jurassique pour le golfe du Mexique et du Miocène supérieur (Messinien) pour la mer Rouge et la mer Méditerranée. Ces eaux sur-salées sont tellement denses qu'elles ne se mélangent pas aux eaux marines “normales”, non-mélange qui explique leur anoxie. Les DHABs sont des biotopes extrêmes, caractérisés par une salinité et une densité très élevées, une forte pression hydrostatique (> 20 MPa), l'absence de lumière, l'anoxie et une chemocline (profil de composition chimique) abrupte très prononcée. Cette tranche d'eau qui fait passer d'une salinité normale (en haut) à une salinité extrême (en bas) ne mesure que quelques mètres d'épaisseur pour les “grandes” dépressions, et seulement quelques centimètres pour les plus petites. La variation très rapide de la salinité se traduit par une variation très rapide de l'indice de réfraction de l'eau. En se déplaçant au-dessus de cette interface, les sous-marins ont l'impression de voir un “lac” surmonté d'une atmosphère. Malgré ces conditions extrêmes, les fosses hyper-salées ne constituent pas des zones mortes d'un point de vue biogéochimique. Des activités microbiennes (hétérotrophie, sulfato-réduction, méthanogenèse, méthanotrophie…) ont été mises en évidence dans les saumures et les sédiments des différentes fosses, indiquant la présence de populations extrémophiles adaptées à ces milieux. Les microbiologistes tentent de caractériser la physiologie et l'écologie des communautés microbiennes extrémophiles des DHABs et des volcans de boue sous-marins que l'on y rencontre ainsi que leur fonctionnement et leur rôle dans les cycles biogéochimiques de la planète.
Source - © 2007 Ifremer/Victor-Medeco
Il existe aujourd'hui des applications biotechnologiques qui font appel aux halophiles. La fermentation de la sauce soja, par exemple, fait intervenir des micro-organismes halophiles se développant en présence de 19 % de NaCl. De même, on utilise dans la préparation du nuoc-mâm (sauce de poisson fermentée dans de la saumure) des bactéries halotolérantes et modérément halophiles. De récents progrès dans la fermentation et la génétique des bactéries halophiles a permis de réaliser des transferts de gènes à partir de bactéries modérément halophiles pour donner à des céréales (blé, riz ou orge) une capacité de résistance aux sels et à la sécheresse, ce qui, peut-être, leur permettra notamment de pousser sur des sols plus salins en environnement aride.
Les milieux très pauvres en eau
Les micro-organismes xérophiles supportent les milieux arides et les forts dessèchements. On les retrouve dans le désert, connus sous le nom de vernis (ou patine) du désert. Ils se présentent sous la forme de fins biofilms riches en oxydes de fer et de manganèse associés à des argiles d'altération résultant de l'action biologique d'organismes xérophiles. Ces derniers peuvent vivre dans des roches, ce qui leur permet de se protéger, à la fois de la perte d'eau et des fortes radiations solaires. De telles structures peuvent renseigner sur d'éventuelles traces de vie passées ou actuelles, l'ADN pouvant être piégé dans le vernis. Elles pourraient être présentes sur d'autres planètes (Mars).
Les milieux sous-marins à haute pression
Les organismes qui vivent à haute pression sont appelés piézophiles (ou barophiles). Ils sont présents dans les grands fonds (de −2000 jusqu'à −11 000 m, comme dans la fosse des Mariannes dans le Pacifique). Les micro-organismes piézophiles des plaines abyssales et des fosses océaniques (> 5 000 m) sont en général psychrophiles, car la température moyenne qui règne à ces profondeurs est de l'ordre de 2 à 4°C. Ceux qui vivent près de sources hydrothermales sont à la fois hyperthermophiles et piézophiles. Ceux qui vivent à quelques kilomètres dans la lithosphère sont thermophiles et piézophiles.
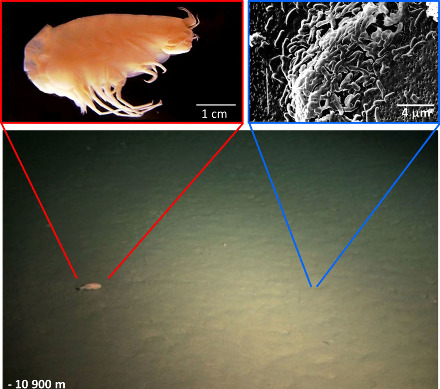
Les hyperpiézophiles ne sont pas que des bactéries ou des archées. Au moins 2 genres de poissons téléostéens ont été trouvés à plus de 6000 m de profondeur ; le record pour les poissons est actuellement de −8145 m. Il y a aussi des crustacés (amphipodes) et des échinodermes (holothuries) bien vivants au fond de la fosse des Mariannes.
Source - © 2006 - 1981 - 2013 D'après Daiju AzumaCC BY-SA 2.5 - Yayanos et al., PNAS - Glud et al., Nature Geoscience (et smithsonianmag.com)
Les sous-sols superficiels et profonds : la vie endogée
La vie ne s'arrête pas au sol, aux racines, à la boue sédimentaire sous-marine. Elle est présente dans les sous-sols océaniques comme continentaux, jusqu'à des profondeurs de plusieurs kilomètres.
La caractérisation des bactéries et archées qui constituent la biosphère profonde a fait d'immenses progrès grâce aux forages profonds (continentaux et océaniques) et aux méthodes biomoléculaires. La biosphère profonde reste toutefois l'une des dernières grandes frontières de l'exploration scientifique.
On a aussi identifié de l'activité microbienne dans des grottes (notamment des tunnels de lave). Dans ce cas, la vie se développe à la pression atmosphérique.
Ces bactéries chimilithotrophes utilisent vraisemblablement l'oxydation du Fe2+ des silicates par l'O2 atmosphérique comme source d'énergie pour réaliser leur synthèse.
Mais, grâce à des forages océaniques, et à des mines ou des forages continentaux, on a découvert des micro-organismes vivant dans des milieux beaucoup plus profonds que des grottes : dans sédiments océaniques non encore complétement diagénisés, dans les sous-sols océaniques ou continentaux indurés, dans des aquifères ou des “nappes” de pétrole profondes. Cette vie “profonde” est qualifiée d'endogée. En général, ces organismes endogés sont chimiolitho-autotrophes. Ils fabriquent leur propre matière organique, en utilisant H2O et CO2, des composés inorganiques de la roche ou des eaux circulantes pour produire des réactions énergétiques leur permettant leurs synthèses organiques. Même quand ces organismes profonds sont abondants, ils n'occupent que de petites niches (fractures, porosité…). Mais, même s'ils sont souvent en densité faible, ils occupent d'énormes volumes en colonisant les moindres micro-porosités et microfissures, jusqu'à une grande profondeur. Si l'on pense qu'ils peuvent vivre jusqu'à 115°C, et avec un gradient géothermique moyen de 30°C/km, on peut trouver ces micro-organismes jusqu'à une profondeur de 3 à 4 km sous la surface des terres émergées ou sous le fond des océans, et bien plus profondément dans les zones à faible gradient géothermique. Ainsi, par exemple, Bacillus infernus a été isolé pour la première fois dans un forage aux USA, à une profondeur de 2,8 km (soit une pression voisine de 0,07 GPa = 700 atmosphères), une température de 60°C, dans des eaux concentrées en NaCl (35g/L) à un pH de 7,8. Des bactéries et des archées ayant les mêmes exigences écologiques semblent omniprésentes dans toutes les profondeurs des sous-sols continentaux et océaniques.
En fonction de la densité de biomasse dans ces profondeurs (en gramme de matière organique par m3 de roche, densité moyenne très mal connue et quantifiée aujourd'hui), il n'est pas impossible que la biomasse profonde totale soit du même ordre de grandeur, voire supérieure, à la biomasse superficielle (et marine) totale. Affaire à suivre !
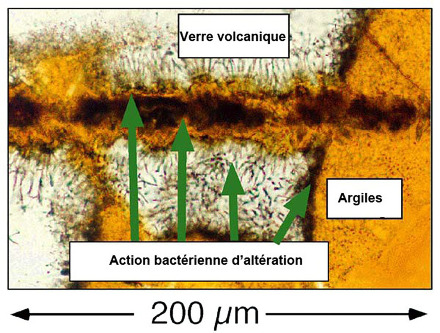
Source - © 2002 D'après Exploring Alaska's Seamounts 2002, NOAA/OER Figure 22. Action microbienne et altération des roches volcaniques Cette image montre un verre volcanique (en blanc) qui s'est formé lors d'une éruption volcanique sous-océanique. Les argiles (orange) se sont formées par altération bactérienne du verre. Les zones noires entre les zones oranges et blanches représentent les zones où l'activité bactérienne est active. Les filaments noirs correspondent aux développements microbiens au sein de la roche. | Source - © 2002 Exploring Alaska's Seamounts 2002, NOAA/OER Figure 23. Populations microbiennes dans un basalte au sein d'une zone de verre non altéré Une fissure traverse l'échantillon de basalte et l'on voit des zones rondes et vides qui se sont formées lorsque la lave était liquide. Des bactéries se développent à partir de ces irrégularités de manière radiale. Les cristaux d'olivine ne semblent pas être affectés par l'activité bactérienne. |
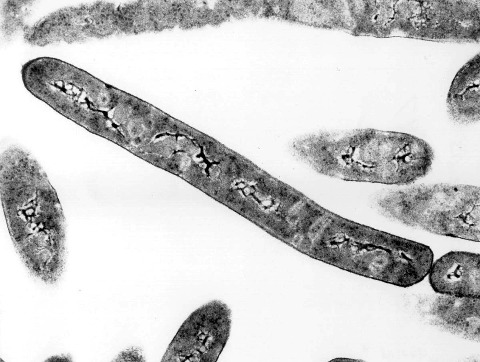
Source - © 1997 Henry Aldrich / Michigan State University | |
Les milieux à forte radioactivité
Dans les milieux naturels, il existe des sites à relativement forte radioactivité, là où la teneur en uranium est élevée. Sur ces terres riches en uranium, vivent de nombreux végétaux, arthropodes, vers et micro-organismes radiorésistants. L'activité humaine a bien sûr généré des milieux à beaucoup plus forte radioactivité (centrales nucléaires, zones de stockage de déchets nucléaires, zones en périphéries d'accidents de type Tchernobyl, Hiroshima…, et bien sûr laboratoires d'études). La radiorésistance à une exposition artificielle varie d'un facteur 1 à 1000 chez les métazoaires (1 chez les mammifères, 200 chez les arthropodes, 1000 chez les tardigrades), et de 1 à 2000 chez les bactéries et archées “classiques”. Le champion de la résistance est la bactérie Deinococcus radiodurans qui résiste à 3000 fois la dose létale pour un humain. Cette bactérie possède plusieurs mécanismes « réparateurs d'ADN » qui intéressent et les biologistes cellulaires, et les spécialistes du nucléaire.
Si résister à de telles doses qui n'existent pas dans la nature n'apportent pas d'avantages évolutifs évidents, résister à des doses modérées permet de coloniser les milieux riches en uranium, et même d'en tirer parti.
Le minéral naturel le plus riche en uranium est la pechblende (UO2). Sous l'action de la radioactivité (rayonnement γ) d'un tel minéral, il y a radiolyse et décomposition de l'eau à son voisinage :
- 4 H2O → 2 H2 + 2 H2O2 (peroxyde d'hydrogène = eau oxygénée).
Si, associée à la pechblende, il y a de la pyrrhotite (FeS), ce qui est une association minéralogique assez classique, une deuxième réaction s'effectue entre la pyrrhotite et les produits de décomposition de l'eau :
- FeS + 2 H2 + 2 H2O2 → FeSO4 + 4 H2.
La bactérie Desulforudis audaxviator, est une bactérie sulfato-réductrice “classique” qui vit normalement entre −1500 et −3000 m de profondeur dans le sous-sol. Mais on a également trouvé cette bactérie dans une mine d'uranium Sud-africaine, où elle constitue des biofilms sur des associations de cristaux pechblende-pyrrhotite. Cette bactérie est alors capable d'effectuer une réaction exothermique classique dans le domaine des chimiolithotrophes et d'en utiliser l'énergie pour faire ses synthèses de matière organique à partir du CO2 et de l'H2O ambiants :
- FeSO4 + 4 H2 → FeS + 4 H2O + énergie.
Dans ce cas, les réactifs initiaux (FeS et H2O initialement présents dans la roche), contrairement à la chimiolithotrophie usuelle, ne sont pas “consommés”, car ils sont reconstitués.
Dans ce cas précis, la source d'énergie de Desulforudis audaxviator à la base de son autotrophie vis-à-vis du carbone, ce n'est pas la lumière, ni la consommation d'un couple oxydant-réducteur, mais la radioactivité.
Source - © 2017 - 2009 WeirdmeisterCC BY-SA 4.0 - Ra'ikeCC BY-SA 3.0
Figure 25. Échantillons de pechblende (UO2) et de pyrrhotite (FeS)
La bactérie Desulforudis audaxviator profite de l'association de ces deux minéraux pour utiliser la radioactivité comme source d'énergie pour ses synthèses.
Les milieux froids
Les organismes psychrophiles (littéralement, « qui aiment le froid ») se développent et prospèrent à moins de 5°C, généralement aux alentours de 0°C, et souvent à une température inférieure à 0°C dans de l'eau restée liquide à cause d'une grande concentration en sel. Ces organismes peuvent se rencontrer dans les grands fonds océaniques (60 % de la surface terrestre est couverte par des mers et océans de profondeur supérieure à 1 000 m où la température est de l'ordre de 2°C), dans la neige de montagne, sur ou dans les inlandsis, sur ou dans le permafrost, dans les lacs sous-glaciaires antarctiques (comme le lac Vostock), sur ou sous la banquise…
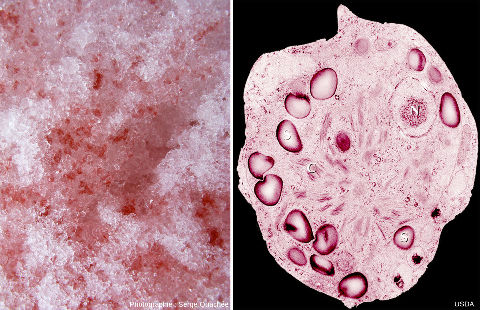
Sous nos climats, les randonneurs qui parcourent les montagnes au printemps voient souvent des plaques de neige fondante rose. Ces plaques de neige contiennent des algues unicellulaires qui appartiennent au groupe des algues vertes (eucaryotes) malgré leur couleur rouge, qui ne vivent que sous ces conditions : Chlamydomonas nivalis.
Source - © 2013 Muséum National d'Histoire naturel | Source - © 2009 - 2008 Serge OuachéeCC BY-SA 3.0 - US Dept of Agriculture Figure 27. Neige fondante rose et Chlamydomonas nivalis À gauche, gros plan sur de la neige fondante colorée en rose par des Chlamydomonas nivalis. À droite, vue au microscope de l'algue unicellulaire Chlamydomonas nivalis. |
De nombreux extrémophiles ont également été récoltés dans les sédiments noirs (nommés cryoconite) collectés sur le fond des lacs groenlandais et les innombrables trous d'eau présents dans la zone de fusion Ouest de la calotte groenlandaise. Ces lacs bleus saisonniers constituent des placers (zones de concentration) de particules cosmiques, de particules éoliennes, de cendres volcaniques et de particules carbonées résultants des incendies de forêt et des combustions humaines (industrie, transport...) ; il s'y développe des extrémophiles psychrophiles. Ces organismes sont actifs pendant les 2 à 3 mois d'été, sous la forme de cocons de cyanobactéries photosynthétiques qui ont des propriétés extraordinaires. Elles prolifèrent pendant l'été, car elles forment des colonies qui capturent des grains minéraux qui les lestent, et qui leur apportent des sels minéraux (micrométéorites, particules éoliennes et retombées volcaniques produites lors d'épisodes volcaniques en Islande). Elles sont ensuite piégées dans la glace pendant environ neuf mois, où elles hibernent sans mourir.
Source - © 2018 CNRS - Le Journal 291 |
L'un des environnements les plus étudiés pour ces organismes psychrophiles a été l'Antarctique, à partir des carottes de glace, où ces organismes forment des couches d'algues rouges ou vertes. Ces algues sont photosynthétiques ; elles vivaient donc en surface avant d'être ensevelies sous une couche de neige. D'autres microorganismes peuvent être présents : des organismes hétérotrophes, qui profitent de la fixation de matière organique par la photosynthèse, réalisée des années auparavant au niveau des couches supérieures. C'est au niveau du pôle Sud qu'on a détecté le record d'activité microbienne à basse température : de −12 à −17°C.
La vie dans les lacs sous-glaciaires, notamment en Antarctique, est également un sujet d'étude majeur. Citons deux exemples.
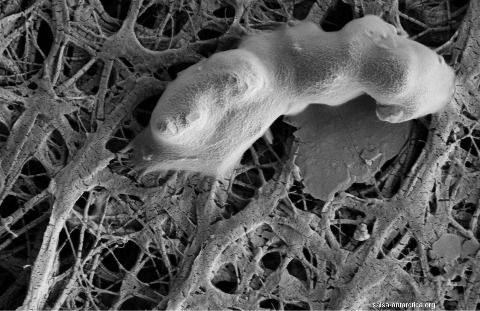
Le lac Whillans se trouve sous 800 m de glace sous l'inlandsis de l'Antarctique de l'Ouest. Un forage en condition quasi-stérile a été effectué en 2013, et a récupéré de l'eau du lac et des sédiments de son fond. Des dizaines d'espèces de bactéries et d'archées y ont été récupérées, dont beaucoup étaient chimiolithotrophes et constituaient la base d'écosystèmes complexes entièrement constitués d'organismes psychrophiles. Des détails sont disponibles en ligne dans l'article Microbial Community Structure of Subglacial Lake Whillans, West Antarctica.
Source - © 2017 salsa-antarctica.org
La vie dans un lac anoxique, salé et basique sous le glacier Taylor dans l'Antarctique de l'Est (non loin de la région volcanique active de l'Érébus) est encore plus “exotique”. Le glacier Taylor se jette dans le lac Bonney. De son front sort épisodiquement de l'eau liquide froide (-7°C), sursalée (80g/L de NaCl), anoxique mais riche en sulfate (SO42−), avec un pH compris entre 8 et 9,2, et riche en ions Fe2+. Dès qu'il arrive à l'air libre, le Fe2+ s'oxyde en Fe3+ grâce à l'O2 atmosphérique et précipite. C'est ce Fe3+ insoluble qui colore en rouge la zone d'où sort cette eau. Ce site est connu sous le nom de « Chutes de sang » (Blood Falls). Cette eau provient d'un lac sous-glaciaire de dimensions mal connues, situé plusieurs kilomètres en amont du front du glacier. Les processus biogéochimiques donnant à l'eau de ce lac cette composition très particulière restent à élucider. La présence dans le substratum régional de dolérite, roche riche en minéraux ferro-magnésiens pourrait expliquer en partie la richesse en fer. La grande concentration en sels, dont des sulfates, serait due à des phénomènes de cryoconcentration. La relative proximité avec la province volcanique active de l'Érébus complique encore les choses. Au moins 17 types de micro-organismes ont été découverts dans les eaux qui s'échappent de ce lac sous-glaciaire, aussi bien des chimiolithotrophes que des hétérotrophes. Ces organismes sont donc en même temps halophiles, alcaliphles et psychrophiles.
Source - © 2013 - 2006 Michael Studinger / NASA Earth Observatory - Peter Rejcek (NSF) / US Antarctic Program
Figure 31. Le glacier Taylor et les Blood Falls (« Chutes de sang »), Antarctique de l'Est
En haut, vue du contexte morphologique du glacier Taylor et de la position des Blood Falls. C'est dans ces Blood Falls qu'on a identifié l'une des associations de micro-organismes les plus “improbables” sur Terre.
En bas, vue de détail des Blood Falls (« Chutes de sang ») au front du glacier Taylor qui se jette dans le lac Bonney dans la vallée de McMurdo en Antarctique.
Il n'y a pas que des micro-organismes qui vivent et résistent aux grands froids. On peut citer un insecte aptère, Belgica antarctica, le plus gros animal purement terrestre du continent antarctique. L'hiver, il s'enterre et survit gelé dans le sol recouvert de neige (la neige est un bon isolant) jusqu'à une température de −15°C.
Source - © 2009 Tasteofcrayons
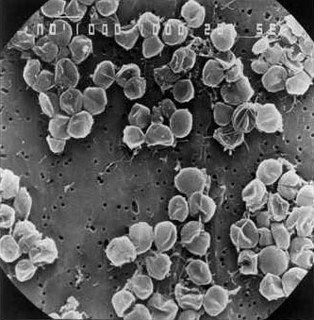
Un autre exemple, les « oursons d'eau » (tardigrades), qui forment un embranchement voisin des arthropodes. Aujourd'hui, plus de 1 200 espèces ont été identifiées. Ils ont la particularité de survivre dans des milieux poly-extrêmes extrêmement diversifiés, terrestres comme aquatiques. Il y en a qui vivent dans des milieux “cléments” comme les mousses de nos forêts. Mais des représentants de cet embranchement ont été identifiés sur des sommets de l'Himalaya (à plus de 6 000 m d'altitude), au Groenland, et jusque dans les eaux profondes (−4 000 m). Ils sont de petite taille, entre 0,1 et 1,5 mm de longueur pour un adulte. Ils ont la capacité, quand l'environnement devient trop hostile, d'entrer en cryptobiose, « état d'hibernation avancé », proche de la non-vie, durant lequel l'activité vitale devient presque indécelable en s'abaissant à 0,01 % de la normale. Pour atteindre cet état cryptobiotique, ils évacuent la quasi-totalité de leurs réserves hydriques (anhydrobiose) et peuvent perdre ainsi plus de 99 % de leur eau, en limitant les conséquences de cette perte d'eau par l'accumulation d'un sucre (le tréhalose), qu'ils synthétisent. Il en a été trouvé dans des glaces du Groenland âgées de 2000 ans. Ces derniers ont repris vie dès qu'on a fait fondre cette glace.
Source - © 2016 Hashimoto et al., Nature
Cette caractéristique de pouvoir atteindre un état cryptobiotique leur permet de survivre à des conditions naturelles extrêmes (150°C par exemple), mais aussi à des conditions auxquelles ces animaux ne sont pas naturellement soumis : le vide de l'espace, des températures très basses, jusqu'à −200°C, des radiations plus de 1000 fois supérieures à ce qui tuerait un homme. Des tardigrades (Richtersius coronifer et Milnesium tardigradum) en orbite dans l'espace ont survécu à la déshydratation extrême du vide spatial, au froid et aux radiations cosmiques (expérience Biopan-6 de l'ESA – mission FOTOM-M3 en septembre 2007). D'autres organismes extrémorésitants survivent dans le froid et dans l'espace comme Bacillus subtilis qui a été retrouvé sur un satellite de la NASA. Il a survécu pendant 6 ans dans l'espace.
Tous ces organismes ont donc développé des mécanismes de survie très largement surdimensionnés par rapport aux conditions naturelles présentes sur Terre. Comprendre ces mécanismes peut avoir un intérêt purement scientifique, mais aussi d'importantes applications pratiques.
Les intérêts pratiques et scientifiques des extrémophiles
De nombreuses applications pratiques et industrielles impliquant les extrémophiles ont été identifiées et développées dans les paragraphes qui précèdent, qui vont de l'amplification de l'ADN par la PCR à l'exploitation de minerais métalliques pauvres.
Mais la découverte et l'étude des extrémophiles a surtout un intérêt scientifique. Comme on l'a vu, cette découverte a remis en cause l'arbre phylogénétique du vivant des années 1980. Surtout, elle apporte des données et implications nouvelles à quatre grandes questions : les limites des conditions permettant la vie, l'origine de la vie sur Terre, son maintien quand les conditions deviennent très “défavorables”, et les possibilités de vie extra-terrestre.
Les limites des conditions permettant la vie
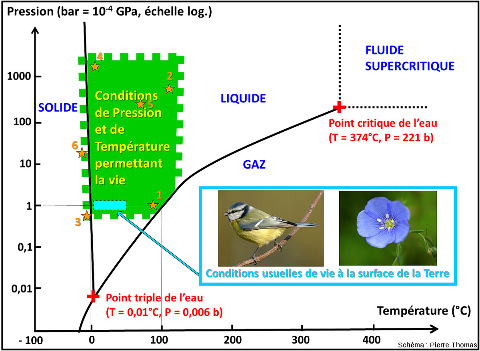
Le rapide tour d'horizon que nous venons de faire montre que la vie sur (et dans) notre planète occupe des domaines écologiques beaucoup plus variés et nombreux que ce que l'on l'imaginait il y a 50 ans, alors que le microscope existe pourtant depuis 350 ans. Les sources chaudes continentales (comme celles de la région de Naples pour rester en Europe continentale) sont connues depuis toujours, des mines profondes sont exploitées depuis plus d'un siècle… mais bien peu de biologistes avaient pensé à y amener un microscope. Les plaines abyssales et les fosses océaniques étaient “postulées” azoïques jusqu'à ce que bathyscaphes et autres sous-marins les explorent. D'abord limités à quelques niches (sources chaudes, milieux acides…) ce qu'on appelle encore les extrémophiles semble exister (naturellement) dans une très vaste gamme de pressions, de températures, de concentrations en sels, de pH, de potentiels rédox, de doses de radiations ionisantes… En fait, il semble y avoir de la vie partout tant qu'il y a de l'eau liquide et que la température est inférieure à 115°C. Il y a 40 ans, on cherchait des niches à extrémophiles ; maintenant, on cherche (en vain tant qu'il y a de l'eau liquide et une température < 115°C) des niches sans vie. Il est même possible (bien que ce soit très mal contraint et quantifié) que la vie endogée (piézophiles et thermophiles) soit plus importante en diversité génétique et métabolique (à défaut de l'être en diversité morphologique), et plus importante en biomasse que la vie “usuelle” qui ne représenterait que la partie émergée d'un iceberg sur lequel nous (Homo sapiens) serions. Si l'on se contente de considérer la pression et la température (figure ci-dessous), le champ de la vie que nous appelons “usuelle” (autour de 15°C et 1 atmosphère) n'est que dans un petit coin du champ P-T où prospère la vie (−15 à +115°C' et 0,3 à 1000 atmosphère). Bacillus infernus est plus près que nous du centre du domaine du vivant dans le champ P-T. Si on était provocateur, ce serait nous (et la vie “usuelle” à la surface de la Terre) qu'on appellerait « extrémophiles ». Vis-à-vis du champ où existe la vie, nous sommes en effet des êtres modérément psychrophiles (adaptés à des températures inférieures à 20°C) et vacuophiles (qui aiment les basses pressions).
La vie peut exister dans le domaine théorique de l'eau solide car l'eau peut être liquide à des températures plus basses si elle est suffisamment concentrée en sels. Le figuré dentelé des limites du domaine de la vie indique notre grande incertitude voire ignorance quant aux valeurs exactes de ces limites.
Les étoiles oranges indiquent certains des environnements évoqués dans cet article : (1) sources chaudes en surface, (2) fumeurs noirs, (3) lacs sur-salés de l'Himalaya, (4) fosse des Mariannes, (5) bactéries endogées de type Bacillus infernus, (6) lacs sous-glaciaires antarctiques type Blood Falls.
On pourrait compliquer ce diagramme en rajoutant une troisième dimension (le pH), voire une quatrième (la concentration en sels).
La vie primitive ne pouvait (probablement) être que thermophile, et les dernières formes de vie sur Terre, dans environ 2 Ga, le seront aussi
On s'inquiète à juste titre du réchauffement climatique que nous occasionnons à cause de nos activités humaines, majoritairement à cause de notre production de CO2. Ce réchauffement, s'il risque d'être catastrophique pour beaucoup d'écosystèmes, dont les écosystèmes humains, ne sera qu'un feu de paille à l'échelle des milliards d'années d'existence de la vie sur Terre, ne serait-ce que parce que la combustion du carbone fossile s'arrêtera par la force des choses d'ici quelques siècles quand le dernier morceau de charbon aura été brûlé. En plus des effets anthropiques dont la durée se mesure en 102 ans (siècles), il y a des variations d'origine astronomique dont la durée se mesure en 105 ans (centaines de milliers d'années), des variations géologiques dues aux variations naturelles du cycle du carbone et dont la durée se mesure en 107 ans (dizaines de millions d'années) (voir, par exemple, un résumé de ces différentes échelles de temps dans Les variations climatiques « pour les nuls »).
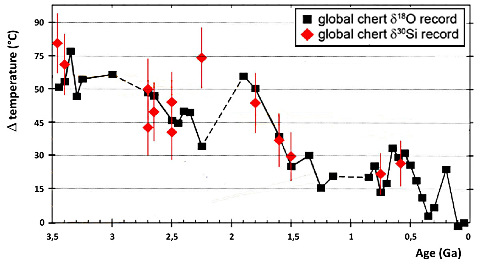
Il y a aussi deux autres effets, qui jouent sur le très long terme (109 ans, milliard d'années), et qui modifient la température de la surface de la Terre : (1) la puissance rayonnée par le Soleil augmente régulièrement depuis 4 Ga (7 à 10 % par milliard d'années), époque à laquelle elle devait être 30 à 40 % inférieure à sa valeur actuelle, et (2) il y a de plus en plus de CO2 stocké dans les calcaires, et le CO2 atmosphérique baisse inexorablement (il est approximativement divisé par 10 tous les 109 ans) indépendamment de toutes les oscillations citées ci-dessus. Depuis 4 Ga, la baisse du CO2 atmosphérique l'emporte sur l'augmentation de la puissance solaire et la température baisse (aux oscillations près), et ce depuis qu'on a des données isotopiques permettant d'estimer la température de l'océan. D'après ces données isotopiques, l'océan archéen aurait eu une température supérieure d'environ 50°C par rapport à l'océan actuel (soit une température de 65°C). Les organismes archéens (et protérozoïques inférieurs) étaient très probablement des organismes thermophiles. La « thermophilie » n'est pas une adaptation aux hautes températures, c'est « nous » qui résultons d'adaptations aux basses températures.
Source - © 2016 D'après Tartèse et al. [25], modifié
Les chiffres de l'ordonnée indiquent l'écart par rapport à la température de l'océan actuel (15°C). L'épisode « Terre boule de neige » est mal marqué, sans doute parce qu'aucun chert n'a précipité dans ces océans gelés (ou n'a été trouvé). D'après ces données (encore fragmentaires), depuis ces 3,5 Ga, la température de l'océan a perdu 50°C. Les premiers organismes vivants devaient être thermophiles.
D'après les astronomes, la puissance rayonnée par le Soleil va continuer à augmenter. Mais si jusqu'à présent cette augmentation avait été plus que compensée par la baisse du CO2 atmosphérique, cela ne va pas encore durer très longtemps. En effet, il n'y a presque plus de CO2 dans l'atmosphère (0,03 % avant l'ère industrielle), et il ne va plus pouvoir continuer à baisser longtemps. D'après les modèle, d'ici 1 à 2 Ga, la température superficielle de la Terre va commencer à augmenter. Et, avant l'emballement du phénomène qui risque d'évaporer tous les océans et de faire ressembler la Terre à Vénus, les derniers organismes vivants sur Terre seront probablement des hyperthermophiles.
La question de l'origine de la vie sur Terre
Ce n'est pas ici le lieu de tenter de résoudre la question de l'origine de la vie sur Terre, mais seulement de voir comment l'étude de l'environnement des extrémophiles actuels peut apporter quelques lumières à ce sujet. À partir du moment où il y a de l'eau liquide, que faut-il pour que de la vie apparaisse (cf. L'origine de la vie vue par un géologue qui aime l'astronomie) ?
Il faut tout d'abord des macro-molécules carbonées pré-biotiques. Deux sites peuvent fournir de telles molécules : les comètes ou les chondrites carbonées tombant sur Terre, et les milieux hydrothermaux où l'action de l'H2O et du CO2 sur des silicates contenant du fer (Fe2+) peut produire de telle molécules.
Il faut ensuite des surfaces minérales où peuvent se faire des réactions chimiques, entre autres, de polymérisation des molécules carbonées. Les phyllosilicates (argiles, serpentines…) et les sulfures ont de telles propriétés. Les sources hydrothermales sont riches en telles surfaces minérales, à priori plus riches que des mares côtières où tomberaient chondrites ou poussières cométaires.
Il faut enfin (1) soit que la disponibilité en molécules organiques soit abondante et pérenne, (2) soit que réactifs et énergie soient disponibles pour que la vie synthétise elle-même ces molécules. Ces deux conditions existent dans le cas des sources hydrothermales.
Et tant que la vie n'a pas “inventé” une certaine forme de photosynthèse, les sources hydrothermales sont à priori plus favorables au développement de la vie que des mares côtières.
Il est à noter que ces synthèses organiques de type chimiosynthèse sont beaucoup plus faciles en milieu neutre (ou basique) qu'en milieu acide. Or les sources hydrothermales sur croutes basaltiques sont relativement acides, alors que les sources sur péridotites ne crachent pas d'eaux acides. En effet, l'altération de l'olivine par de l'eau produit serpentine, magnétite, di-hydrogène (c'est lui qui réduira le CO2 et sera à la base des synthèses organiques) et brucite [Mg(OH)2]. Or [Mg(OH)2] neutralise les eaux. C'est sans doute dans des contextes de sources hydrothermales dans des roches très riches en magnésium comme les péridotites ou les komatiites (laves très riches en olivine qui n'existent qu'à l'Hadéen et à l'Archéen) qu'a eu lieu l'origine de la vie terrestre, si elle est liée à de l'hydrothermalisme (cf. Serpentinisation océanique et vie primitive).
Or les “habitants” de ces sources hydrothermales sont des extrémophiles. Il est donc bien possible que les premiers terriens aient été des extrémophiles, et qu'ils le soient restés longtemps, puisque l'océan aurait eu une température d'environ 65°C jusque vers −2 Ga.
Mais attention, ces extrémophiles primordiaux n'étaient en aucun cas les mêmes que maintenant, “nos” extrémophiles actuels étant le résultat de 4 milliards d'années d'évolution.
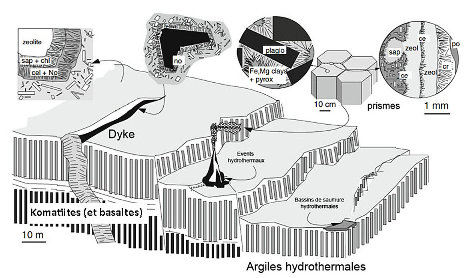
Source - © 2010 D'après Meunier et al., modifié
La structure très poreuse, en nid d'abeille, des édifices hydrothermaux est propice à la catalyse de réactions chimiques, la surface des pores fonctionnant comme des mini-réacteurs. Les systèmes hydrothermaux constituent des sources importantes de donneurs d'électrons (H2, H2O, SO, Fe2+, CH4, NH4, CH2O) et d'éléments métalliques utiles à la vie (Mn, Fe, Co, Ni, Cu, Zn…). Les premières proto-cellules et premiers biofilms pourraient être nés des systèmes hydrothermaux (fumeur blanc) ou de l'enchainement des réactions qui accompagnent la serpentinisation des péridotites, et komatiites (et basaltes) hadéens qui fournissent de l'énergie, des surfaces réactionnelles et des lieux de confinement (modèle de Thomas Mc Collom et Jeffrey Seewald [18] ; modèle de Mike Russell et Allan Hall [20]). La mackinawite, (sulfure de fer), et les argiles produites dans le processus d'altération des komatiites et basaltes, servant de catalyseurs et de surfaces d'échange à la synthèse de molécules prébiotiques dans de nombreux microsites.
D'après Meunier et al., chaque mètre carré de basalte-komatiite offrait de 4 à 8.104 microsites potentiels.
Depuis 2015, la recherche de possibles traces de vie archéenne a fait beaucoup de progrès.
Au moins quatre articles dans des grandes revues scientifiques décrivent des roches et des affleurements de plus de 3,7 Ga, dont les analyses et/ou la morphologie permettent de proposer l'intervention de la vie, bien que ce soit encore abondamment débattu :
- découverte d'anomalies isotopiques du carbone dans des zircons australiens de 4,1 Ga : Potentially biogenic carbon preserved in a 4.1 billion-year-old zircon (E.A. Bell et al., 2015) ;
- découverte d'anomalies isotopiques du carbone dans des roches métamorphiques canadiennes d'âge > 3,95 Ga : Oldest traces of life on Earth may lurk in Canadian rocks (A. Witze, 2017) ;
- découverte au Groenland de structures ressemblant à des stromatolithes âgées de 3,7 Ga : Rapid emergence of life shown by discovery of 3,700-million-year-old microbial structures (A.P. Nutman et al., 2016) ;
- découverte de paléo-sources hydrothermales d'âge compris entre 3,7 et 4,2 Ga et comportant des structures morphologiques (rosettes, tubes…) pouvant être interprétées (c'est encore discuté) comme des structures biologiques : Evidence for early life in Earth’s oldest hydrothermal vent precipitates (M.S. Dodd, 2017).
Un des deux cas où on a pu reconstituer l'environnement où existaient ces possibles organismes vivants correspond à une source hydrothermale, et ses éventuels habitants devaient être des extrémophiles.
Source - © 2017 Dodd. et al, Nature
Ces tubes pourraient être des structures biologiques âgées de 3,7 à 4, Ga. Les premiers fossiles d'extrémophiles ?
Les épisodes de Snowball Earth (Terre « boule de neige »)
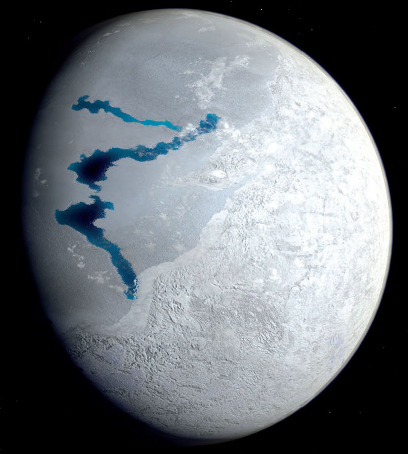
De très nombreux et très variés arguments géologiques montrent qu'au moins à deux reprise au Néo-protérozoïque (vers −700 et −650 Ma) la Terre a été entièrement gelée (épisodes dits de Snowball Earth). Les continents étaient recouverts de calottes glaciaires, et les océans de banquises épaisses, même à l'équateur. Ces deux épisodes qui ont duré respectivement 50 et 10 millions d'années sont nommés respectivement Sturtien et Marinoen. Ces deux épisodes posent un problème : comment la vie (sans doute uniquement unicellulaire) qui existait depuis des milliards d'années a pu survivre à ces épisodes. Les extrémophiles actuels nous donnent des propositions de solution. Une vie analogue à celles des sources hydrothermales actuelles a dû constituer des oasis de survie au fond des océans ; la vie endogée et la vie sous-glaciaire n'a pas dû être très perturbée par ces épisodes glaciaires. On peut même se demander si ces formes de vie se sont “rendus compte” de ces glaciations généralisées. Le problème est plus délicat pour la vie photosynthétique, superficielle par la force des choses. Comment ont survécu cyanobactéries et autres eucaryotes (majoritairement unicellulaires) photosynthétiques qui peuplaient la surface des mers et constituaient des biofilms à la surface des continents depuis très longtemps ? Mais des modélisations (cf. Hoffman et al., 2017 [12]) suggèrent qu'au niveau de l'équateur, la surface des banquises et des glaciers continentaux pouvait dégeler très superficiellement l'été, comme cela se produit chaque été sur la calotte groenlandaise actuelle. Les trous, flaques et lacs superficiels sur ces glaciers groenlandais sont remplis de cryoconites, mélanges de cendres volcaniques, de poussières diverses, et d'organismes microbiens dont de nombreux sont photosynthétiques. Il pouvait en être de même à l'équateur pendant les épisodes « boule de neige ». Et pourquoi pas des organismes analogues à Chlamydomonas nivalis sur les glaces équatoriales estivales de la boule de neige ?
Les organismes psychrophiles ont sans doute sauvé la vie superficielle et la photosynthèse à la surface de la Terre.
La surface de cet inlandsis fond très localement et très temporairement chaque été. C'est au fond de tels lacs qu'on trouve de la cryoconite, mélange de poussière minérale et d'organismes unicellulaire, notamment des cyanobactéries. Une analogie de ce à quoi pouvait ressembler la zone équatoriale terrestre pendant les étés des épisodes « boule de neige » ? | Source - © 2017 in Gilles Ramstein, Une brève histoire du climat de la Terre Figure 39. Représentation artistique de la Terre pendant un été d'un épisode « boule de neige » Il y avait probablement des lacs peu profonds, résultant de la fonte superficielle de la banquise au niveau de la ceinture équatoriale. Comme les lacs estivaux du Groenland actuel, ces lacs devaient contenir de la cryoconite (notamment alimentée par le volcanisme), derniers refuges probables des micro-organismes photosynthétiques. |
La question de la vie extra-terrestre
Assez souvent, ceux qui parlent ou écrivent dans les médias à propos de la vie extra-terrestre ne pensent qu'à la vie de type « petite fleurs et petits oiseaux ». Ah, anthropocentrisme, quand tu nous tiens ! Si les exobiologistes et autre scientifiques connaissent bien sûr tout le champ où la vie terrestre est possible (cf. figure 34), ceux que les médias font intervenir ne pensent souvent qu'au petit rectangle bleu de la figure 34, en oubliant la majorité du grand rectangle vert.
L'étude des environnements où vivent les extrémophiles terrestres actuels [eau liquide ; −15°C < T < +115°C ; 0,3 atm. < P < 1100 atm. ; 1 < pH < 12 ; lumière ou contact eau/silicates…] nous indiquent où il pourrait y avoir une vie extra-terrestre, en ne prenant en compte que la vie « à la mode de chez nous », et sans envisager une vie fonctionnant avec une biochimie complètement différente.
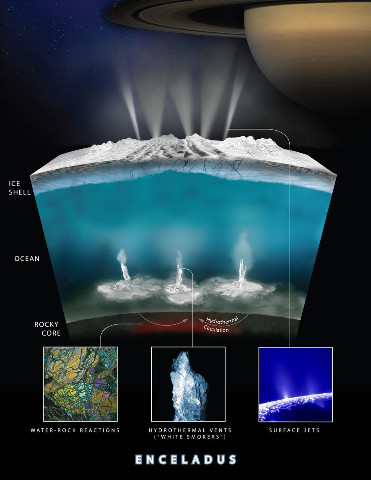
En se limitant au système solaire, où, en plus de la Terre, trouve-t-on des environnements contenus dans le rectangle vert de la figure 34 (cf. Où le système solaire serait-il habitable ?) ? Au moins trois sites remplissent aujourd'hui ces conditions, et un quatrième l'a rempli dans un passé lointain. Le sous-sol profond de Mars, en dessous de 5 km de profondeur, pourrait héberger une vie endogée analogue à celle du sous-sol terrestre. La base des banquises d'Europe et d'Encelade pourrait héberger une vie analogue à celle qui existe sous le lac Whillans. Le plancher de ces mêmes océans d'Europe et d'Encelade maintenu chaud par un fort dégagement de chaleur et des sources hydrothermales pourrait abriter des écosystèmes analogues à ceux des sources hydrothermales. Et la surface de Mars, il y a 4 à 3,5 Ga, pouvait abriter des écosystèmes analogues à ceux de l'Archéen terrestre.
Source - © 2017 NASA/JPL-Caltech/Southwest Research Institute
Des extrémophiles terrestres transplantés dans ces environnements pourraient sans doute y vivre (et c'est pourquoi la sonde Cassini a été stérilisée pour éviter une contamination en cas de crash sur ce satellite). Mais habitable ne signifie pas habité. Il ne reste plus qu'à aller voir de plus près.
Conclusion
L'étude des extrémophiles (beaucoup d'archées, pas mal de bactéries, un peu d'eucaryotes unicellulaires et quelques rares eucaryotes pluricellulaires) représente l'exemple parfait de symbiose entre les sciences de la vie et les sciences de la Terre voire de l'Univers, et de nécessité d'une approche scientifique pluridisciplinaire. Elle éclaire sur les conditions de vie possibles à l'Hadéen et à l'Archéen. Elle relance le débat sur l'origine de la vie sur Terre en mettant en balance l'ensemencement de la Terre à partir de molécules d'origine extraterrestre (micrométéorites, comètes, météorites) et la synthèse bien terrestre de ces mêmes molécules. Elle rend très raisonnable la possibilité d'une vie en dehors de la Terre et sa recherche (exobiologie).
Le dialogue que nous entretenons avec la nature n'en est qu'à ses débuts. Les extrémophiles ont évolué, au cours du temps, par sélection naturelle telle qu'elle a été initialement proposée par Darwin, et se sont adaptés à des environnements géologiques très variés. Ces organismes présentent, de ce fait, un répertoire de voies métaboliques et de biomolécules originales leur permettant de se développer de manière optimale dans des niches écologiques extrêmes pour nous. Les propriétés singulières de certaines de ces biomolécules ont très vite attiré l'attention des opérateurs des biotechnologies : extrémo-enzymes, bio-polymères et certains métabolites secondaires. L'étude du métabolisme des extrémophiles présente un intérêt réel dans les domaines fondamentaux et industriels. Un certain nombre d'extrémophiles utilise du carbone organique comme source d'énergie au cours de diverses fermentations. Mais de nombreux extrémophiles sont des lithotrophes (leur source d'énergie est minérale), anaérobies (leur accepteur d'électrons n'est pas l'oxygène moléculaire), et autotrophes (leur source de carbone est le dioxyde de carbone). Le domaine des extrémophiles permet également de fonder de nouveaux espoirs en bio-ingénierie et en potentiel biotechnologique : décontamination des milieux extrêmes (bioremédiation), traitement des lixiviats des milieux miniers (biolixiviation lors l'extraction des terres rares, exploitation extrêmement polluante), dépollution des aquifères ou des sites radioactifs, désulfurisation des charbons, extraction d'enzymes pour l'industrie agro-alimentaire (dont les lessives), biocarburants, bioraffinerie, etc. Des biotraitements des pollutions industrielles ou l'extraction des métaux à partir des minerais par procédés bio-hydro-métallurgiques apportent également des perspectives d'utilisation des extrémophiles, procédés bien moins polluants que certains procédés “traditionnels”.
Tous domaines confondus, les enzymes et composés organiques issus d'organismes extrémophiles drainent un marché mondial estimé, en 1999, à 17 milliards de dollars, d'après la société américaine Diversa – dont 5 milliards de dollars pour la seule filière pharmaceutique. Et cela a dû beaucoup augmenter depuis 20 ans. Par ailleurs, les enjeux financiers dans le domaine des biocarburants sont considérables.
Ainsi, les applications industrielles rendues possibles par l'exploitation des propriétés des extrémophiles sont, comme pour les OGM (Organismes Génétiquement Modifiés), à la fois porteurs de nombreux espoirs mais aussi d'inquiétudes. Espérons que les recherches, et les applications industrielles qui en découleront, seront encadrées par une approche éthique responsable dans le respect des dimensions écologiques, sociétales, économiques, politiques… dans la perspective d'un mieux vivre avec la nature.
Orientation bibliographique
T.D. Brock, M.R. Edwards, 1970. Fine Structure of Thermus aquaticus, an Extreme Thermophile, Journal of Bacteriology, 104, 1, 509-517
M. Detay, 2004. Origine contingente de l'eau sur Terre – éléments de synthèse déduits des données géologiques, géochimiques et des modèles astronomiques et planétologiques, La Houille Blanche, revue internationale de l'eau, 1, 88-100
M. Detay, 2005. Présence historique et contemporaine d'eau sur Mars — des modèles géochimiques et planétologiques aux observations in situ : état des connaissances, La Houille Blanche, revue internationale de l'eau, 6, 38-58
M. Detay, 2012. Hydrovolcanologie appliquée à la phase hydrothermale, LAVE, 159, 14-27
M. Detay, 2012. Le sel du rift – la saline du cratère de Chew Bet en pays Borana, dans les terres semi-arides du sud de l'Éthiopie, Bulletin de la Société Volcanologique de Genève, 119, 4-11
M. Detay, 2015. Une aventure aux frontières du vivant — Les extrêmophiles en environnement volcanique : de l’origine de la vie à l’exploration spatiale, LAVE, 173, 19-32
M. Detay, 2017. Traité de Volcanologie Physique, Tech et Doc Lavoisier Éd., 500p.
P. Forterre, 2007. Microbes de l'enfer, Belin - Pour la Science Éd., 250p.
M. Gargaud, H. Martin, P. Lopez-Garcia, T. Montmerle, R. Pascal, 2009. Le Soleil, la Terre… la Vie. Belin - Pour la Science Éd., 301p.
C. Gerday, N. Glansdorff, 2007. Physiology and Biochemistry of Extremophiles, American Society for Microbiology, ASM Press, 429p.
S. Gribaldo, P. Forterre, C. Brochier-Armanet, 2008. Les Archaea : Évolution et diversité du troisième domaine du vivant, Bull. Soc. Fr. Microbiol., 23, 3, 137-145
P.F. Hoffman, D.S. Abbot, Y. Ashkenazy, D.I. Benn, J.J. Brocks, P.A. Cohen, G.M. Cox, J.R. Creveling, Y. Donnadieu, D.H. Erwin, I.J. Fairchild, D. Ferreira, J.C. Goodman, G.P. Halverson, M.F. Jansen, G. Le Hir, G.D. Love, F.A. Macdonald, A.C. Maloof, C.A. Partin, G. Ramstein, B.E.J. Rose, C.V. Rose, P.M. Sadler, E. Tziperman, A. Voigt, S.G. Warren, 2017. Snowball Earth climate dynamics and Cryogenian, geology-geobiology, Sci. Adv., 3, 11, e1600983 [pdf]
P. Lopez-Garcia, 2002. La vie dans les milieux extrêmes, 433e conférence de l'Université de tous les savoirs
P. Lopez-Garcia, 2003. Extrémophiles, les limites du vivant, in Les traces du vivant, M. Gargaud (dir.), Presses Universitaires de Bordeaux, 255-271
M. Maurette, 2007. Micrometeorites and the mysteries of our origins, Springer Berlin Heidelberg Ed., 330p.
M. Maurette, C. Hammer, 1993. Collecte de micrométéorites en Antarctique et au Groenland, Recherches polaires, une stratégie pour l'an 2000, Académie des Sciences Paris, Tech et Doc. Éd., 69-89
M. Maurette, C. Hammer, N. Reeh, D.E. Brownlee, H.H. Thomsen, 1986. Placers of cosmic dust in the blue ice lakes of Greenland, Science, 233, 869-872
T.M. McCollom, J.S. Seewald, 2013. Serpentines, hydrogen, and life, Elements, 9, 129-134
A. Meunier, S. Petit, C.S. Cockell, A. El Albani, D. Beaufort, 2010. The Fe-Rich Clay Microsystems in Basalt-Komatiite Lavas: Importance of Fe-Smectites for Pre-Biotic Molecule Catalysis During the Hadean Eon, Orig. Life Evol. Biosph., 40, 3, 253-72
M.J. Russell, A.J. Hall, 1997. The emergence of life from iron monosulphide bubbles at a submarine hydrothermal redox and pH front. Journal of the Geological Society of London, 154, 377-402
P. Sanjoffre, G. Le Hir, 2018. Le paradoxe de la Terre boule de neige, Pour la Science, 486, 26-35
K. Sauer, 2018. Vaincre les biofilms, Pour la Science, 486, 55-589
D.Y. Sorokin, T. Berben, E.D. Melton, L. Overmars, C.D. Vavourakis, G. Muyzer, 2014. Microbial diversity and biogeochemical cycling in soda lakes, Extremophiles, 18, 791–809
R.Y. Stanier, C.B. Van Niel, 1962. The Concept of a Bacterium, Arch. Mikrobiol., 42, 17-35
R. Tartèse, M. Chaussidon, A. Gurenko. F. Delarue, F. Robert, 2016. Warm Archean oceans reconstructed from oxygen isotope composition of early-life remnants, Geochemical Perspectives Letters, 3, 1, 55-65
D.M. Ward, M.J. Ferris, S.C. Nold, M.M. Bateson, 1998. A Natural View of Microbial Biodiversity within Hot Spring Cyanobacterial Mat Communities, Microbiology and Molecular Biology Review, 62, 4, 1353–1370
C.R. Woese, G.E. Fox, 1977. Phylogenetic structure of the prokaryotic domain: the primary kingdoms. Proc. Natl. Acad. Sci. USA, 74, 5088-5090
C.R. Woese, O. Kandler, M.L. Wheelis, 1990. Towards a natural system of organisms: proposal for the domains Archeas, Bacteria, and Eucarya, Proc. Natl. Acad. Sci. USA, 87, 4576-4579
Extremophiles - Microbial Life Under Extreme Conditions, Springer Japan, ISSN:1431-0651 - Un périodique spécialisé